I tre pilastri fondamentali della terapia per i pazienti con fibrillazione atriale (FA) sono la riduzione del rischio di ictus, la prevenzione della tachicardiomiopatia e il miglioramento della qualità di vita attraverso il sollievo dei sintomi. L’ablazione catetere della fibrillazione atriale è superiore alla terapia antiaritmica in termini di controllo del ritmo e di qualità della vita [1,2]. Le attuali linee guida lasciano un margine di manovra relativamente ampio nell’indicazione dell’isolamento della vena polmonare. I pazienti senza malattie cardiache strutturali con FA parossistica sintomatica o persistente da meno di un anno hanno le migliori probabilità di successo. Quanto più precoce è il trattamento nel corso della malattia, tanto più alte sono le percentuali di successo dell’ablazione con catetere. Grazie ai grandi progressi tecnologici, i tassi di complicanze nei centri esperti sono molto bassi, per cui si può parlare di una procedura molto sicura.
Con una prevalenza dell’1,5-2%, la fibrillazione atriale è l’aritmia cardiaca più comune nella pratica clinica. La prevalenza aumenta con l’età. Tra gli ottantenni, più dell’8% è colpito [3,4], gli uomini un po’ più spesso delle donne. La fibrillazione atriale idiopatica non associata a una cardiopatia strutturale ha una prevalenza fino al 30% [5].
A seconda della durata, la fibrillazione atriale si divide in parossistica (≤48 ore), persistente (>7 giorni), persistente lunga (>1 anno) e permanente. In quest’ultimo caso, il disturbo del ritmo viene accettato e non si cerca più il controllo del ritmo. In modo simile al punteggio NYHA, il carico di aritmia viene assegnato a un punteggio di sintomi (EHRA I-IV).
La mortalità dei pazienti con fibrillazione atriale aumenta di circa 1,5 volte negli uomini e di 1,9 volte nelle donne. Questo è il risultato delle analisi dello Studio Framingham. Da un lato, c’è un aumento del rischio di insufficienza cardiaca con un rischio triplicato di scompenso cardiaco; dall’altro, c’è un rischio cinque volte maggiore di insulto cerebrovascolare o embolia sistemica. Utilizzando il punteggio CHA2DS2-VASc, il rischio di ictus può essere stimato individualmente e in modo un po’ più accurato.
Opzioni di trattamento e indicazioni per il controllo del ritmo
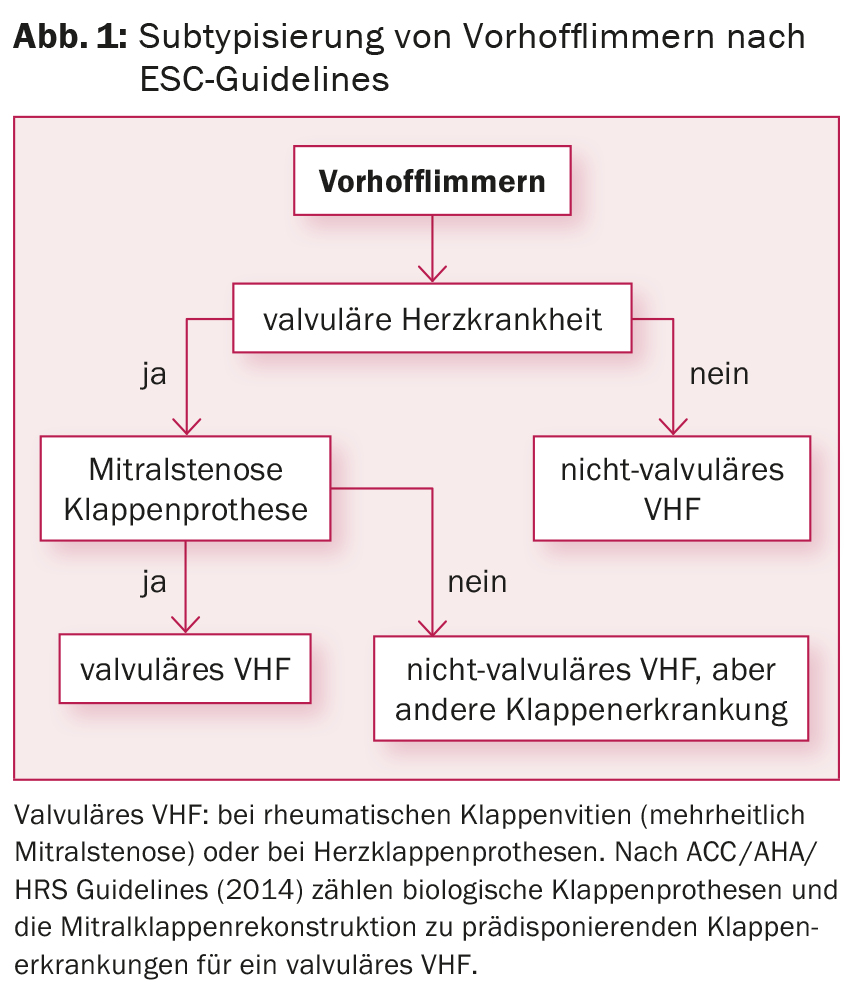
Tenendo conto della stratificazione del rischio mediante il punteggio CHA2DS2-VASc, l’anticoagulazione orale (OAC) con Marcoumar® o, in caso di fibrillazione atriale non valvolare (fig. 1), con uno dei nuovi anticoagulanti (noti come “anticoagulanti”) deve essere iniziata in tutti i pazienti con ≥1 punto, indipendentemente dalla sottotipizzazione della fibrillazione atriale e anche in caso di controllo del ritmo. anticoagulanti orali diretti [DOAK], ad esempio rivaroxaban, dabigatran, apixaban, edoxaban). Per ridurre i sintomi e prevenire la tachicardiomiopatia (con tassi sostenuti >120 bpm), si deve cercare di controllare la frequenza. Gli studi condotti finora non hanno mostrato differenze nella morbilità e nella mortalità quando si confronta il controllo della frequenza con il controllo del ritmo [6]. Se la terapia farmacologica non ha successo, l’ablazione del nodo AV con l’inserimento di un pacemaker permanente è un’opzione possibile per il controllo della frequenza, soprattutto se sono presenti delle comorbidità.
Il controllo del ritmo è essenziale nella fibrillazione atriale parossistica e persistente, soprattutto nei pazienti sintomatici nonostante il rigoroso controllo della frequenza. Si possono utilizzare due metodi di base: la terapia farmacologica a lungo termine con farmaci antiaritmici e l’approccio invasivo con procedure di ablazione. Nella situazione acuta con instabilità emodinamica, questo può essere ottenuto anche con l’elettroconversione (ECV). Se il trattamento ritmico è preferito al controllo della frequenza, deve essere iniziato il prima possibile dopo la diagnosi, poiché diventa più difficile mantenere il ritmo sinusale con l’aumentare della durata della FA [7,8].
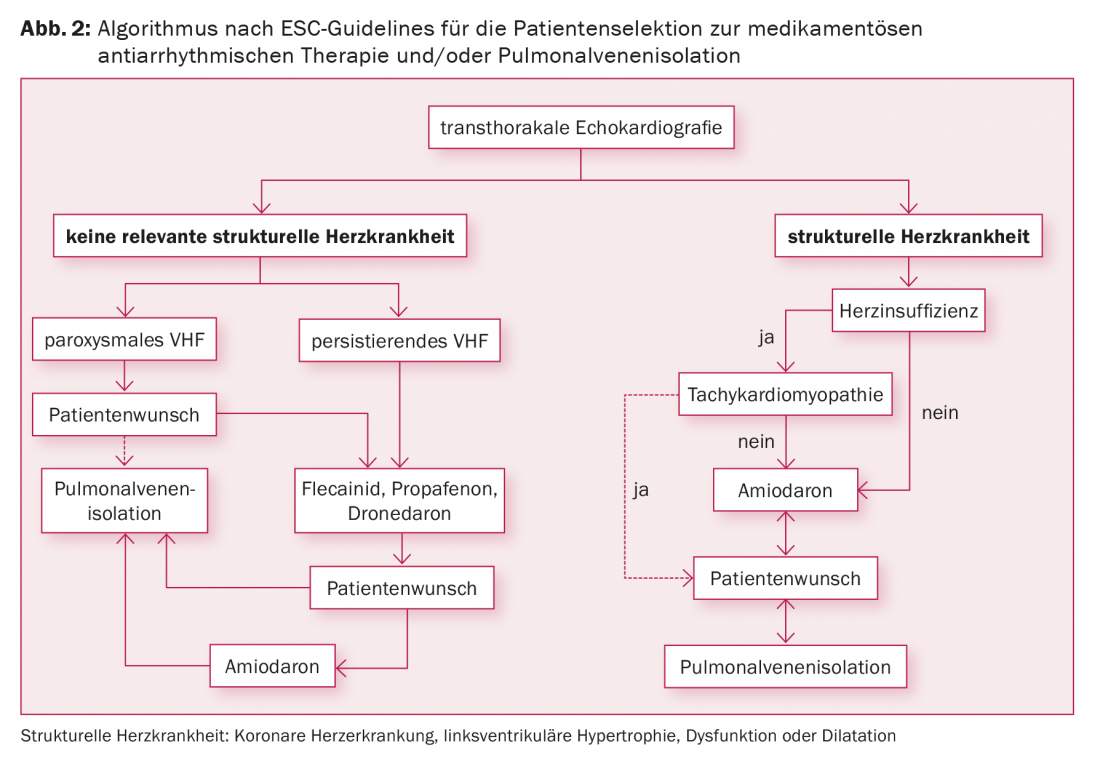
Le indicazioni per l’isolamento della vena polmonare includono la fibrillazione atriale sintomatica nonostante la terapia antiaritmica, la fibrillazione atriale sintomatica e il desiderio del paziente di non dover assumere farmaci antiaritmici, e la fibrillazione atriale sintomatica in combinazione con le controindicazioni ai farmaci antiaritmici (Fig. 2) . Attualmente mancano dati che dimostrino la prevenzione degli eventi cardioembolici mediante l’ablazione con catetere. Il desiderio di interrompere l’OAC non è quindi un’indicazione per l’isolamento della vena polmonare secondo gli studi attuali, poiché l’OAC deve essere continuata anche dopo un’ablazione riuscita, a seconda del punteggio CHA2DS2 VASc.
Isolamento della vena polmonare
Dalla fine degli anni ’90, si sa che oltre il 90% dei focolai ectopici (i cosiddetti trigger) per lo sviluppo della fibrillazione atriale sono localizzati nelle vene polmonari. Inizialmente, si è cercato di eliminare questi focolai attivi mediante ablazione locale diretta. Tuttavia, non di rado questo ha portato alla stenosi della vena polmonare. Oggi si sa che l’isolamento delle vene nella regione in cui si uniscono all’atrio sinistro (antrum) è sufficiente e più delicato. Sulla base di queste scoperte, l’isolamento della vena polmonare si è affermato come strategia terapeutica invasiva grazie al successo dell’ulteriore sviluppo di varie tecniche di ablazione e mappatura, con miglioramenti consecutivi in termini di efficacia e sicurezza negli ultimi 10-15 anni.
Di norma, i pazienti entrano in ospedale il giorno prima dell’esame. Nello stesso giorno, viene eseguita un’ecocardiografia transesofagea e, se necessario, una tomografia computerizzata o una risonanza magnetica del cuore. Queste immagini possono facilitare una ricostruzione tridimensionale dell’atrio sinistro.
Sotto analgesia (l’anestesia generale non è obbligatoria), vengono inseriti diversi cateteri attraverso un accesso venoso nell’inguine, nell’atrio destro attraverso la vena cava inferiore e infine vengono posizionati nell’atrio sinistro attraverso una puntura trans-settale (Fig. 3) .
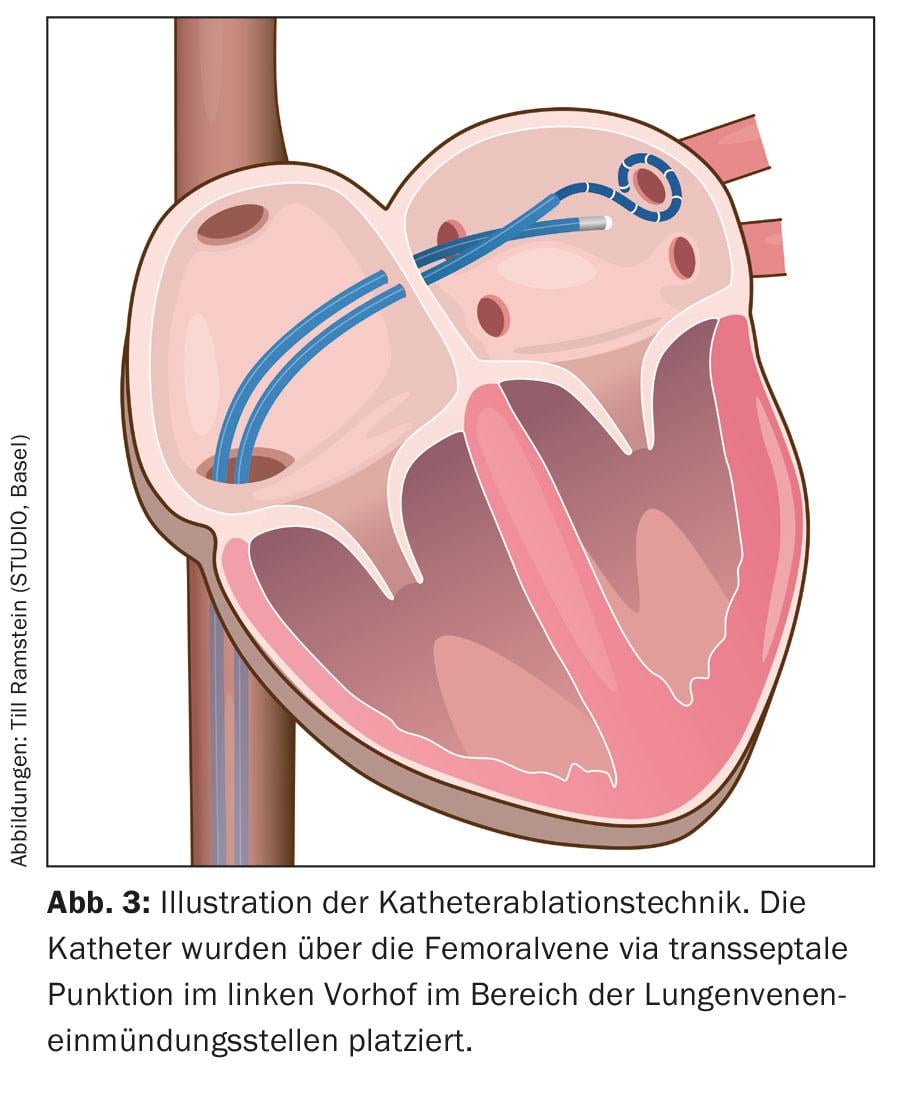
Questi cateteri vengono utilizzati per una ricostruzione tridimensionale dell’area di ablazione, la cosiddetta mappatura 3D (Fig. 4). Oltre ai metodi basati sui raggi X che utilizzano cateteri di mappatura puri per visualizzare la connessione tra le vene polmonari e l’atrio sinistro, sono stati integrati nella procedura i cosiddetti “metodi di mappatura elettroanatomica”, che utilizzano un sistema tridimensionale e non principalmente basato sui raggi X.
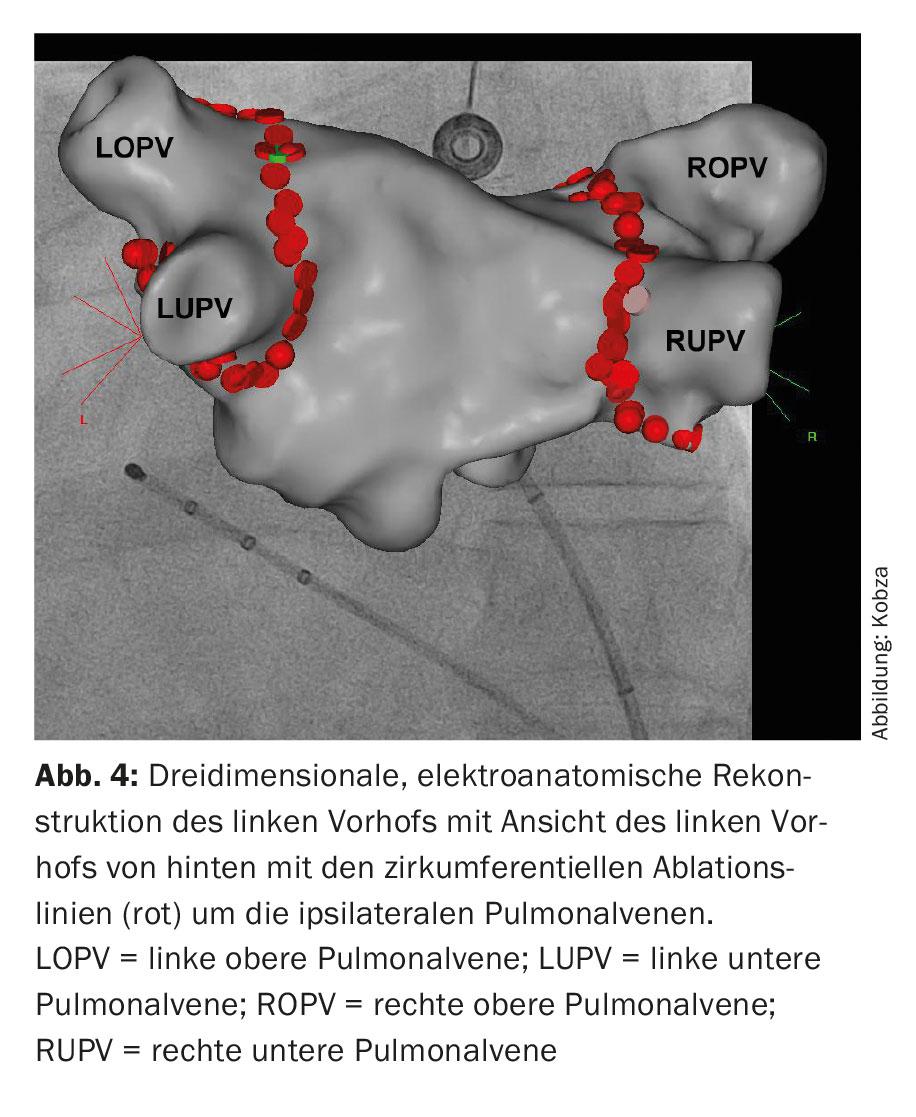
Qui è possibile l’integrazione dell’immagine dell’anatomia atriale sinistra ricostruita con la TAC e la risonanza magnetica. Successivamente, viene eseguita l’ablazione. L’ablazione circonferenziale punto a punto viene eseguita a coppie intorno all’ostio della vena polmonare omolaterale, utilizzando energia a radiofrequenza, una corrente alternata ad alta frequenza (“ablazione con catetere a radiofrequenza circonferenziale ad ampia area”, WACA) (Fig. 4). In alternativa, l’isolamento si ottiene con il congelamento, la cosiddetta ablazione con palloncino (Fig. 5). Si utilizzano anche nuovi cateteri di ablazione circolari e multipolari. Anche le procedure laser, che vengono eseguite tramite un catetere supportato da un palloncino, stanno diventando sempre più comuni. Tuttavia, la possibile asimmetria e la variabilità delle dimensioni degli orifizi della vena polmonare e le loro variazioni anatomiche possono complicare il design unico dei cateteri per ablazione con palloncino. L’ablazione con radiofrequenza continua ad essere la più comune. Per controllare l’isolamento elettrico ottenuto, si utilizza un catetere di mappatura circolare. L’isolamento di tutte e quattro le vene polmonari è il principio fondamentale e l’obiettivo primario della procedura, altrimenti possono verificarsi recidive di FA, con conseguente fallimento del trattamento.
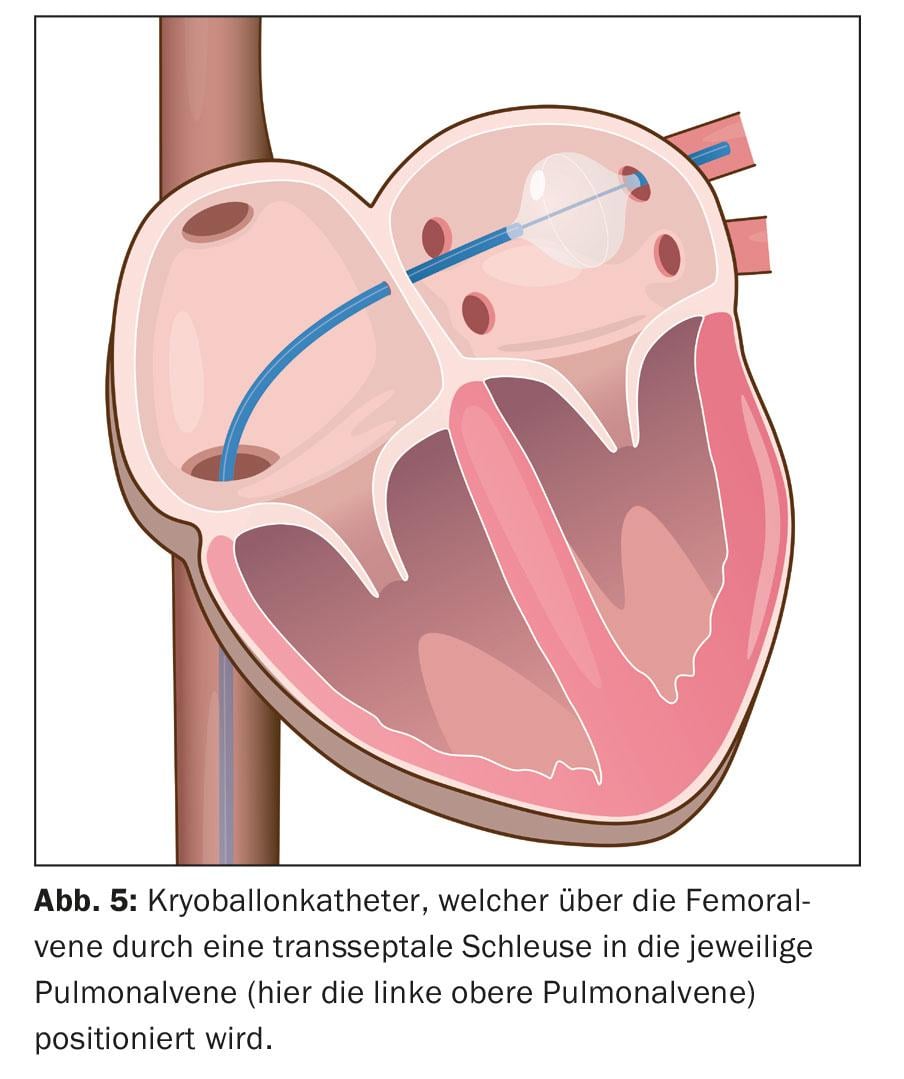
L’intervento dura solitamente 90-180 minuti. Dopo la rimozione di tutti i cateteri, viene applicata una medicazione a pressione. Nella maggior parte dei casi, i pazienti possono essere dimessi il giorno successivo.
L’OAK non viene interrotto periintervento, in quanto questa strategia è associata a minori complicazioni [9]. Dopo l’intervento, l’OAK viene continuato per almeno tre mesi (a causa della cicatrizzazione nell’area di ablazione) e poi aggiustato in base al rischio individuale secondo il punteggio CHA2DS2-VASc.
Successo del trattamento
Non è ancora stato stabilito un metodo ottimale come gold standard per la diagnosi di possibili recidive di fibrillazione atriale. A seconda del centro, i controlli ECG a lungo termine (da 24 ore a 7 giorni) vengono effettuati dopo l’intervento a intervalli diversi, di solito dopo tre, sei e dodici mesi, e poi annualmente.
Il successo dipende in gran parte dall’esperienza del centro di attuazione. Nei primi tre mesi, a volte si osservano ancora aritmie cardiache (extrasistoli atriali e fibrillazione atriale), che non devono essere considerate una recidiva (“periodo di vuoto”). Se in seguito si verifica un ritmo sinusale continuo, la procedura si può definire riuscita. Il tasso di successo è dell’80-90% nei pazienti con fibrillazione atriale parossistica senza malattie cardiache strutturali, con il 20-30% che richiede una procedura ripetuta. Nella fibrillazione atriale persistente o in presenza di una cardiopatia strutturale, il tasso di successo è del 60-70%. La terapia di ablazione è diventata quindi molto importante, poiché anche il farmaco antiaritmico più efficace, l’amiodarone, raggiunge un mantenimento del ritmo di circa il 40-50% a lungo termine.
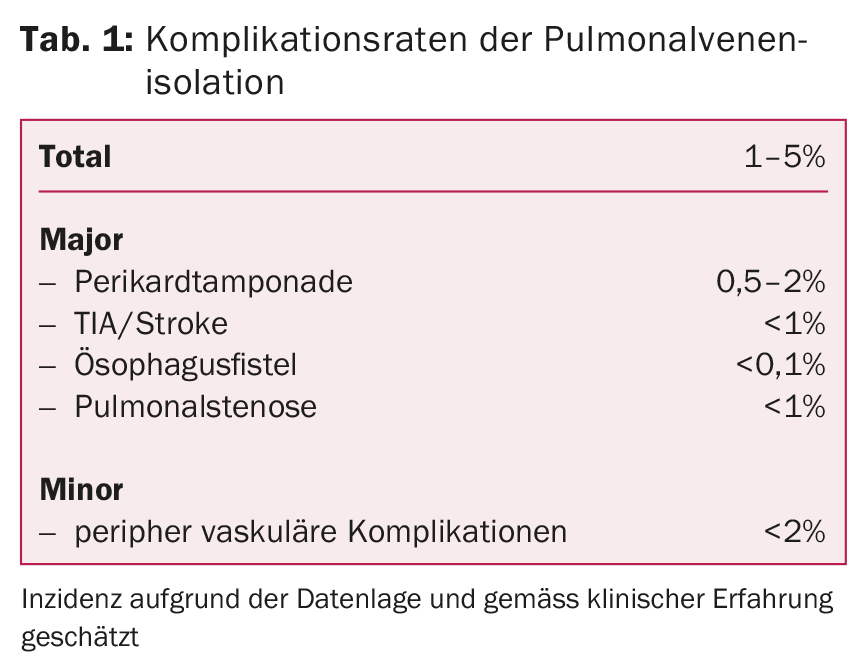
Nei centri esperti, questo trattamento è molto sicuro e associato a poche complicazioni. Le complicazioni più pericolose includono eventi tromboembolici (TIA, ictus), tamponamento pericardico, stenosi della vena polmonare o fistole esofagoatriali. Le complicazioni nell’area del sito di iniezione, come emorragie secondarie, ematomi o lesioni vascolari, possono verificarsi più frequentemente (tab. 1).
Ringraziamenti: Un grande ringraziamento va a Till Ramstein (STUDIO, Basilea) per la preparazione delle figure 3 e 5.
Letteratura:
- Cosedis Nielsen J, et al: Ablazione con radiofrequenza come terapia iniziale nella fibrillazione atriale parossistica. N Engl J Med 2012; 367(17): 1587-1595.
- Wazni OM, et al: Ablazione con radiofrequenza vs farmaci antiaritmici come trattamento di prima linea della fibrillazione atriale sintomatica: uno studio randomizzato. JAMA 2005; 293: 2634-2640.
- Feinberg WM, et al: Prevalenza, distribuzione dell’età e sesso dei pazienti con fibrillazione atriale. Analisi e implicazioni. Arch Intern Med 1995; 155: 469-473.
- Heeringa J, et al: Prevalenza, incidenza e rischio di fibrillazione atriale nel corso della vita: lo studio di Rotterdam. Eur Heart J 2006; 27: 949-953.
- Sankaranarayan R, et al: Confronto tra la fibrillazione atriale nei giovani e quella negli anziani: una revisione. Cardiol Res Practice 2013; 2013: 976976.
- Gli investigatori dell’Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM): un confronto tra controllo della frequenza e controllo del ritmo nei pazienti con fibrillazione atriale. N Engl J Med 2002; 347: 1825-1833.
- Cosio FG, et al: Il controllo ritardato del ritmo della fibrillazione atriale può essere una causa di mancata prevenzione delle recidive: motivi per passare al trattamento antiaritmico attivo al momento o al primo episodio rilevato. Europace 2008; 10: 21-27.
- Kirchhof P: Possiamo migliorare gli esiti nei pazienti con fibrillazione atriale con una terapia precoce? BMC Med 2009; 7: 72.
- Cappato R, et al: Rivaroxaban ininterrotto vs. antagonisti della vitamina K ininterrotti per l’ablazione con catetere nella fibrillazione atriale non valvolare. Eur Heart J 2015 Jul 21; 36(28): 1805-1811.
CARDIOVASC 2015; 14(5): 3-6