L’aneurisma dell’aorta addominale rotto (rBAA) può essere trattato sia in modo chirurgico aperto che in modo minimamente invasivo, cioè endovascolare. Le storie di successo entusiasmanti suggeriscono che la nuova tecnica endovascolare ha finalmente portato una svolta nella riduzione della mortalità stagnante. Tuttavia, un’analisi più dettagliata mostra che si possono ottenere risultati altrettanto buoni con entrambe le tecniche. Quindi, la prognosi della rBAA sembra essere determinata principalmente da fattori legati alla costituzione del paziente e alla gestione peri-operatoria. Due vantaggi chiave della sostituzione aortica a cielo aperto sono che può essere eseguita ovunque sia disponibile un’équipe qualificata e non richiede un’infrastruttura specializzata. Inoltre, può essere utilizzato indipendentemente dalle condizioni anatomiche. Pertanto, la sostituzione aortica a cielo aperto dovrebbe continuare ad essere lo standard di riferimento per la rBAA, fino a quando la superiorità di una particolare tecnica non è stata dimostrata in modo scientifico e senza pregiudizi, oppure l’esperienza non è disponibile.
L’aneurisma dell’aorta addominale (BAA) è una malattia dell’invecchiamento maschile e si sviluppa tipicamente alla base dell’aterosclerosi. L’aumento delle dimensioni è solitamente graduale (in media 3 mm/anno), motivo per cui la maggior parte dei BAA rimane asintomatica per lungo tempo, anche se la tensione della parete aumenta con l’aumentare del diametro e la parete del vaso si assottiglia. La conseguenza temuta è la rottura, che è associata a un’elevata mortalità. Gli studi epidemiologici suggeriscono che la prevalenza della BAA è in lento calo dal 1999 (attualmente circa il 2,2% negli uomini di età superiore ai 65 anni ) [1]. Parallelamente, l’incidenza della rottura sta diminuendo, soprattutto perché sempre meno persone fumano e i pazienti sempre più anziani si sottopongono a un intervento chirurgico elettivo prima che il BAA scoppi [2]. Al contrario, la mortalità peri-operatoria in caso di rottura non è praticamente diminuita (ancora 30-50% in media) [3, 4], il che è sorprendente se si considerano gli altri progressi nella cura del paziente in fase peri-operatoria.
Sostituzione aortica aperta ed endovascolare – due alternative di trattamento
I BAA intatti vengono oggi trattati praticamente ovunque in uno dei due modi: La sostituzione aortica a cielo aperto con una protesi di plastica (Dacron o ePTFE) viene eseguita da circa 60 anni ed è una tecnica comprovata con un’eccellente durata a lungo termine. La sostituzione aortica endovascolare (EVAR) con una protesi stent-graft è disponibile come alternativa minimamente invasiva da circa 15 anni.
I primi studi randomizzati hanno dimostrato in modo coerente che l’EVAR può ridurre la mortalità peri-operatoria di un fattore fino a 3 rispetto alla chirurgia aperta [5–7]. Tuttavia, nessuno di questi studi ha mostrato un beneficio di sopravvivenza a lungo termine e, per loro natura, i risultati degli studi si applicano solo agli aneurismi che presentano una morfologia favorevole alla diagnostica per immagini. Nonostante queste limitazioni, i risultati elettivi suggeriscono che un beneficio di sopravvivenza peri-operatoria dell’EVAR può essere particolarmente importante nei BAA rotti. E in effetti, questa ipotesi sembra essere confermata da meta-analisi di serie di casi (per lo più non controllati) che suggeriscono una riduzione della mortalità da una media del 40% al 20% [8]. Tuttavia, in primo luogo, i pazienti di queste serie sono stati selezionati in modo diverso e, in secondo luogo, i confronti randomizzati (che, tra l’altro, hanno esaminato solo pazienti eleggibili all’EVAR!) non hanno finora mostrato differenze di mortalità tra la sostituzione aortica aperta e quella endovascolare. Nel primo studio randomizzato, molto piccolo, la mortalità è stata identica, pari al 53% [9]; nello studio più ampio AJAX (acute endovascular treatment to improve outcome of ruptured aortoiliac aneurysms), apparentemente non c’è stata alcuna differenza statisticamente significativa [10]. Tuttavia, la pubblicazione di questo studio è ancora in sospeso.
L’EVAR elettiva differisce fondamentalmente dall’EVAR d’emergenza per la rottura in almeno tre aspetti. In primo luogo, quest’ultima, per sua natura, non può essere pianificata in anticipo. Questo significa mettere a disposizione in modo permanente competenze, infrastrutture e un assortimento di innesti di stent. Poiché solo il 50-60% delle BAA rotte sono anatomicamente adatte all’EVAR [8], non si può evitare il back-up chirurgico aperto. In secondo luogo, a volte è necessario un palloncino aortico soprarenale per il controllo dell’emorragia acuta, che può portare all’ischemia viscerale, le cui conseguenze deleterie passano facilmente inosservate. In terzo luogo, il sito di rottura dell’aorta impedisce che la compartimentazione della sacca aneurismatica faccia sì che le arterie lombari che si riformano provochino una sindrome compartimentale addominale [11]. In questo contesto, i dubbi su una relazione causale tra il metodo di trattamento (tecnico) e il rischio di mortalità peri-operatoria sono appropriati.
Questo articolo intende illustrare l’importanza di altre strategie di trattamento (indipendenti) che finora hanno ricevuto poca attenzione. È importante che i concetti siano indipendenti da una complessa infrastruttura tecnica, in modo che possano essere implementati ovunque, almeno in teoria.
Fattori chiave del successo del trattamento rBAA
Il significato prognostico dei diversi aspetti del trattamento è stato recentemente studiato in una serie omogenea di pazienti consecutivi di un unico centro che garantisce l’assistenza a circa 1,5 milioni di abitanti [8, 12, 13]. La coorte era predestinata a tali analisi, in quanto praticamente tutti i pazienti sono stati trattati allo stesso modo (cioè con chirurgia aperta). Questo riduce l’influenza di disturbo della selezione del metodo e della selezione del paziente. In particolare, tutti i pazienti trattati per rBAA tra gennaio 2001 e dicembre 2012 sono stati inclusi in un registro dati prospettico [8, 12, 13].
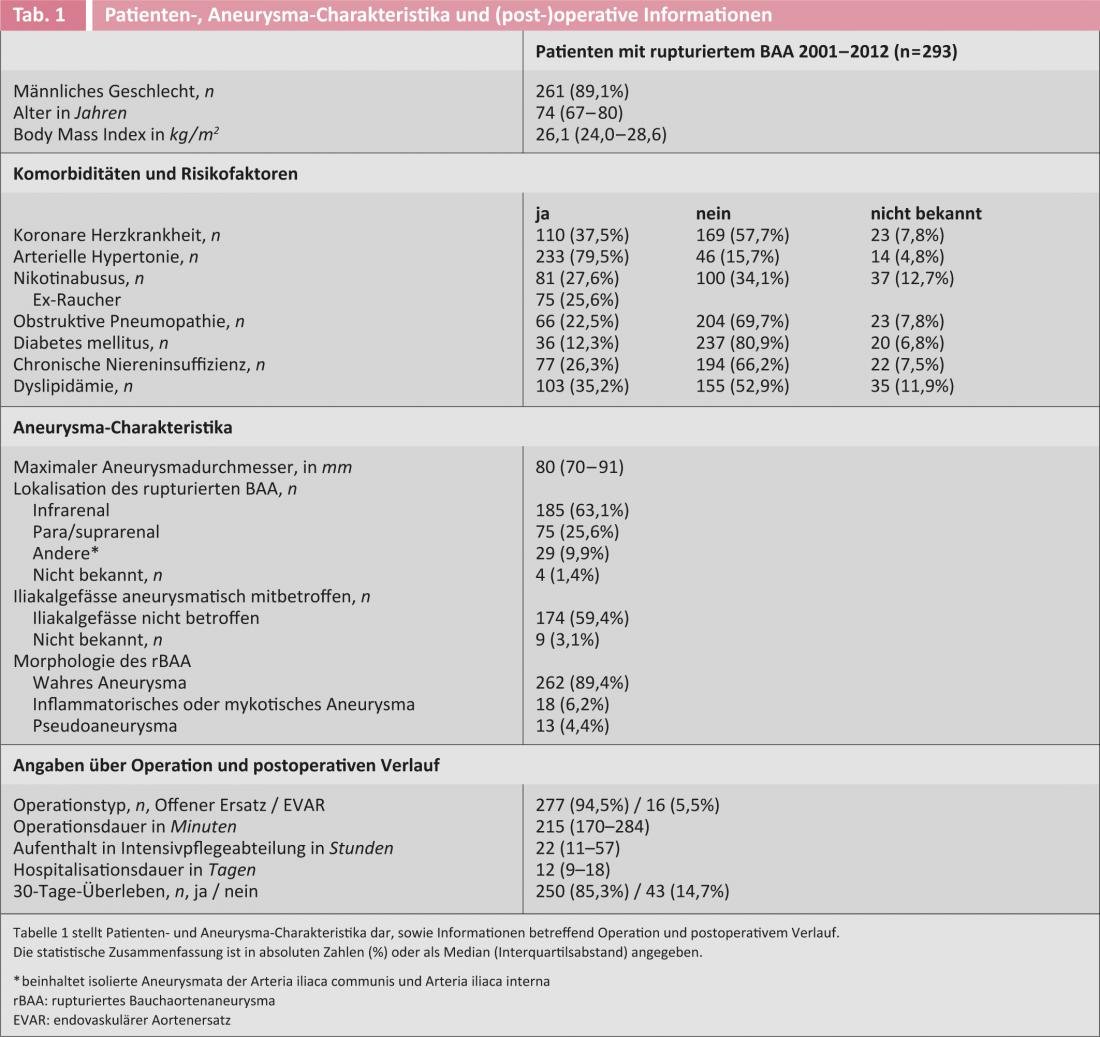
Tutti gli aneurismi in cui è stato rilevato del sangue sulla diagnostica per immagini o che sono stati trovati intraoperatoriamente al di fuori della parete del vaso sono stati analizzati in modo non selezionato (cioè aneurismi veri, pseudoaneurismi e aneurismi micotici, ciascuno situato a livello juxta- o infrarenale e/o iliaco). I pazienti del primo decennio (2001-2010) sono stati studiati in modo più dettagliato in diversi articoli(Fig. 1) [8, 12, 13]. Quasi tutti (97%) sono stati sottoposti a chirurgia aperta e i sopravvissuti sono stati seguiti per un periodo mediano di 3,2 anni (range interquartile [iqr] 1,1-5,4 anni).

Fig. 1: Il diagramma mostra il flusso di pazienti da gennaio 2001 alla fine del 2012. Utilizzando i dati dal decennio 2001 alla fine del 2010 (n=248 pazienti), sono state eseguite analisi separate per stimare l’influenza di vari fattori preoperatori sulla sopravvivenza dei pazienti con un BAA rotto.
La mortalità peri-operatoria (definita come mortalità a 30 giorni; questa informazione era nota in tutti i pazienti) dell’intera serie (n=293) è stata del 14,7%. Solo al 10% dei pazienti non è stato offerto il trattamento per una serie di motivi. Quindi, i risultati di questa serie di pazienti non selezionati sono almeno altrettanto buoni di quelli della migliore serie EVAR pubblicata [14], soprattutto considerando che quest’ultima riporta solo pazienti accuratamente selezionati. Nei 248 pazienti della prima decade, che sono descritti più dettagliatamente di seguito, il tasso di mortalità a 30 giorni era in un range comparabile, pari al 15,3%. Le caratteristiche del paziente e dell’aneurisma associato, nonché le informazioni chirurgiche e peri-operatorie sono riportate nella Tabella 1.
“Anatomia aortica favorevole” come spiegazione?
Finché non è stato dimostrato un effetto causale in esperimenti randomizzati, il beneficio di sopravvivenza dell’EVAR osservato nelle meta-analisi può essere spiegato fondamentalmente in due modi:
- o (a) l’EVAR è effettivamente concettualmente superiore nella rBAA (=effetto causale),
- oppure (b) nei pazienti che si qualificano per l’EVAR d’emergenza, c’è un vantaggio di sopravvivenza indipendente (=bias di selezione).
Se la variante (b) fosse corretta, i pazienti idonei all’EVAR dovrebbero avere una performance migliore dopo la sostituzione aortica a cielo aperto rispetto ai pazienti non idonei all’EVAR. Nella coorte di rBAA di cui sopra, tutti i casi sono stati classificati come “EVAR-eleggibili”, “EVAR-non eleggibili” o “non valutabili” da due investigatori indipendenti secondo criteri predefiniti [8]. Ne sono risultate le seguenti categorie ordinali e una categoria aggiuntiva: (1) “EVAR-idoneo” (quando entrambi gli sperimentatori erano d’accordo), (2) “discutibilmente idoneo” (quando erano in disaccordo), (3) “EVAR-non idoneo” (quando entrambi erano d’accordo) e (4) “non classificabile”. Coerentemente con i rapporti precedenti, (di questi pazienti operati apertamente!) il 54% (n=133) è stato classificato come adatto all’EVAR (28% “adatto all’EVAR” e 26% “discutibilmente adatto”) e il 40% (n=100) come “non adatto all’EVAR”. Il restante 6% (n=15) non ha potuto essere classificato, ad esempio a causa di CT mancanti.
La mortalità a 30 giorni ha seguito le categorie ordinali in modo impressionante [8]: i pazienti “EVAR-eleggibili” avevano un rischio di morte del 4%, “discutibilmente eleggibili” del 16% (odds ratio [OR] 4,73 [95% Konfidenzintervall [KI] 1,13-19,77; p=0,033]) e “EVAR-non eleggibili” del 24% (OR 8,03 [95% CI 2,06-31, 34; p=0,003]) come categoria di riferimento. I risultati sono stati corretti per i potenziali confondenti e sono rimasti invariati nelle analisi di sensibilità, ad esempio quando i pazienti non classificabili sono stati assegnati a ciascuna categoria a turno. Pertanto, l’effetto positivo dell’anatomia favorevole sembra essere davvero indipendente dalla tecnica di trattamento e da altri fattori di influenza e molto robusto. L’anatomia spiega quindi almeno in parte la differenza osservata tra l’EVAR (selezione di pazienti anatomicamente favorevoli) e la sostituzione aortica aperta (a seconda del centro, i pazienti tendono a non essere adatti all’EVAR, mentre i pazienti anatomicamente favorevoli vengono trattati con l’EVAR).
Pazienti ad “alto rischio” chirurgico
I modelli tradizionali di stratificazione del rischio chirurgico, come il punteggio di Hardmann, suggeriscono che i pazienti anziani con rBAA (ad esempio, di età superiore a 75-80 anni) presentano un rischio chirurgico proibitivo e dovrebbero essere scartati per una sostituzione aortica aperta d’emergenza. L’EVAR potrebbe teoricamente offrire un vantaggio decisivo in questi pazienti. Tuttavia, sappiamo dallo studio EVAR (elettivo!) 2 che l’EVAR non è vantaggioso nei pazienti non operabili chirurgicamente [15]. Nella coorte di rBAA studiata, è stata affrontata la questione se l’età avanzata di per sé abbia un impatto negativo sulla mortalità peri-operatoria tale da giustificarla come motivo di rifiuto.
Il 24% dei pazienti (n=60) aveva più di 80 anni. Come previsto, la mortalità a 30 giorni nell’analisi bivariata era più alta in questi pazienti (26,7% contro 11,7%; p=0,007). Tuttavia, nelle analisi multivariate che correggevano il risultato per i confondenti, l’età avanzata perdeva il suo svantaggio statisticamente indipendente (l’OR di morte peri-operatoria era 2,1 [95% CI 0,9-5,2; p=0,099]). L’effetto negativo dell’età era dovuto principalmente al fatto che i pazienti più anziani presentavano più spesso una malattia coronarica, che a sua volta era associata a una mortalità più elevata. Questo è anche coerente con il fatto che, all’interno del gruppo di pazienti anziani, un indice di shock >1 (nel senso di riserva cardiaca limitata) è stato il predittore più importante di aumento della mortalità [12]. È interessante notare che i pazienti sopravvissuti ai primi 30 giorni avevano la stessa prognosi di sopravvivenza della popolazione complessiva aggiustata per età, sesso e anno solare – e indipendentemente dall’età al momento dell’intervento di rBAA [12].
L’età avanzata da sola non è quindi un criterio di esclusione valido per la sostituzione aortica d’emergenza. Nei pazienti anziani altrimenti sani, i risultati della chirurgia aperta possono essere equivalenti a quelli dell’EVAR. Tuttavia, la sostituzione aortica a cielo aperto non apporta benefici ai pazienti anziani con malattia coronarica che sono già assegnati in stato di shock. Che l’EVAR possa portare a risultati migliori in questo caso è ipoteticamente possibile, ma non è ancora stato dimostrato.
Gestione del volume peri-operatorio
Il fattore prognostico più importante – oltre al rapido intervento di emergenza – potrebbe essere il volume e la gestione emodinamica tra la diagnosi e l’emostasi chirurgica. Dagli studi sui traumi e dagli esperimenti sugli animali è noto che la restrizione del volume e l’ipotensione arteriosa permissiva fino all’emostasi chirurgica salvano più vite nello shock emorragico rispetto alla “stabilizzazione” della circolazione assistita dal volume [13]. La tolleranza dello stato di shock, soprattutto nei pazienti rBAA che spesso sono più polimorfi e più anziani dei pazienti traumatizzati, sembra controintuitiva a prima vista, ma è convincente in teoria. La pressione sanguigna più bassa e la coagulopatia diluitiva ridotta favoriscono la coagulazione e il tamponamento del retroperitoneo, che riduce la perdita di sangue. Inoltre, la restrizione del volume riduce il rischio di ipotermia e di squilibrio acido-base.
È interessante notare che, sulla base di tali considerazioni, il concetto di “restrizione del volume fino all’emostasi chirurgica” viene ripetutamente raccomandato anche nei pazienti con rBAA, ma non è mai stato studiato sistematicamente. Pertanto, questo concetto è stato esplorato nella coorte studiata. Le informazioni sulla quantità di volume erogato prima dell’intervento e sulla velocità di erogazione del volume (in l/h) prima del clampaggio dell’aorta sono state raccolte dalle cartelle di trasferimento e di anestesia e sono state correlate con la mortalità a 30 giorni dopo la sostituzione aortica aperta d’emergenza, dopo la correzione per i possibili confondenti [13].
Sia il tasso di volume che il volume assoluto somministrato hanno avuto un effetto negativo indipendente e statisticamente significativo sul rischio di morire entro i primi 30 giorni . In particolare, ogni litro aggiuntivo di volume all’ora ha aumentato il rischio di mortalità di 1,57 volte (95% CI 1,1-2,3; p=0,026). Questo era indipendente dalle condizioni del paziente, dalla pressione arteriosa media e da altri fattori del paziente o misure terapeutiche. L’effetto è stato determinato principalmente dal tasso di volume e meno dal volume totale [13].
Al contrario, questo significa che la restrizione costante del volume durante l’intera catena di soccorso, cioè dalla diagnosi all’intervento di emergenza, è un concetto prognosticamente importante ed efficiente nei pazienti con rBAA, che aiuta a garantire la loro sopravvivenza. Di conseguenza, tutti gli attori dovrebbero essere formati in questo senso. Il controllo della sostituzione del volume nel paziente sveglio dipende principalmente dallo stato di coscienza. Nei pazienti opacizzati, la pressione arteriosa sistolica deve essere sostenuta ma non aumentata oltre i 70-80 mmHg per periodi prolungati. Sebbene queste analisi si applichino ai pazienti sottoposti a chirurgia aperta, non c’è motivo di non ipotizzare un effetto positivo simile della restrizione del volume nei pazienti EVAR.
Conclusione
Fattori come (1) una catena di soccorso efficiente con diagnosi e trasporto rapido all’ospedale di cura, (2) una restrizione costante del volume con ipotensione permissiva, (3) una valutazione radiologica rapida e sistematica, (4) una selezione del rischio etica e prognosticamente significativa e (5) la presenza costante di un’équipe di trattamento competente ed esperta salvano molte più vite di pazienti con rBAA rispetto a una particolare tecnica di trattamento o impianto. Per ottenere risultati ottimali, il team di trattamento deve fare ciò che sa fare meglio e ciò per cui l’infrastruttura è adatta, tenendo conto di questi fattori.
Regula von Allmen, MD
Prof. Dr. med. Jürg Schmidli
PD Matthias Widmer, MD
PD Florian Dick, MD
Letteratura:
- Svensjo S, et al: Circulation 2011; 124: 1118-1123.
- Anjum A, et al: The British journal of surgery 2012; 99: 637-645.
- Bown M.J, et al: The British journal of surgery 2002; 89: 714-730.
- Holt PJ, et al: The British journal of surgery 2010; 97: 496-503.
- Greenhalgh RM, et al: Lancet 2004; 364: 843-848.
- Blankensteijn JD, et al: The New England journal of medicine 2005; 352: 2398-2405.
- Lederle FA, et al: JAMA : the journal of the American Medical Association 2009; 302: 1535-1542.
- Dick F, et al: The British journal of surgery 2012; 99: 940-947.
- Hinchliffe RJ, et al: European journal of vascular and endovascular surgery: the official journal of the European Society for Vascular Surgery 2006; 32: 506-513; discussione 14-15.
- Balm R.: Presentazione orale al Charing Cross Symposium, Londra, 15 aprile 2012.
- Mayer D, et al: Journal of vascular surgery 2009; 50: 1-7.
- Opfermann P, et al: European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery 2011; 42: 475-483.
- Dick F, et al: Journal of vascular surgery 2013.
- Veith FJ, et al. Ann Surg 2009; 250: 818-824.
- Greenhalgh RM, et al: The New England journal of medicine 2010; 362: 1872-1880.











