Un maggior numero di donatori volontari e un condizionamento a intensità ridotta rendono oggi il trapianto di cellule staminali allogeniche accessibile a una popolazione di pazienti più ampia. Il trapianto di cellule staminali autologhe, a sua volta, blocca anche le malattie autoimmuni attraverso il “riavvio” del sistema immunitario.
Il trapianto di midollo osseo allogenico ha compiuto 60 anni l’anno scorso. A quel tempo (1957), E. Donnall Thomas e colleghi ottennero cellule del midollo osseo dalle costole di cadaveri adulti o fetali, le filtrarono, le sospesero in terreno di coltura, le congelarono a -80°C e successivamente le infusero in pazienti irradiati. In una parte dei pazienti è stato possibile rilevare una crescita passiva delle cellule del donatore, ma tutti i pazienti sono morti nei primi 100 giorni dopo il trapianto. Sebbene molto sia cambiato da allora, il trapianto di cellule staminali allogeniche (allo-SCT, mediante trasferimento di midollo osseo, sangue periferico mobilizzato o sangue del cordone ombelicale) rimane ancora un trattamento complesso, intensivo e complicato. Alla luce delle nuove sostanze mirate e delle immunoterapie, alcuni esperti ritengono che l’allo-SCT abbia superato il suo apice e che tra pochi anni non sarà più necessaria per curare molte malattie maligne del sangue e del sistema linfatico. Le cifre reali parlano a sfavore: la tendenza all’aumento annuale del numero di trapianti di cellule staminali allogeniche e autologhe è ancora in atto [1]. Questo articolo illustrerà gli sviluppi del trapianto di cellule staminali negli ultimi anni con esempi selezionati e azzarderà una prospettiva per il futuro.
Selezione e disponibilità dei donatori
I primi trapianti di midollo osseo allogenico hanno avuto luogo prima della scoperta degli antigeni leucocitari umani (HLA). Negli anni ’60, le conoscenze erano ancora essenzialmente limitate alle osservazioni che il sangue o i leucociti di alcuni pazienti reagivano tra loro e che era possibile una “sensibilizzazione del sistema immunitario”. Negli anni ’70, R. Zinkernagel e P. Doherty hanno scoperto il principio di base dell’attivazione delle cellule T attraverso la presentazione dell’antigene e la restrizione HLA. Solo alla fine degli anni ’80 è stata presentata la struttura proteica dell’HLA. Oggi sono note due classi HLA, ciascuna con 7678 alleli di classe I e 2268 di classe II. Oggi, l’allo-SCT viene eseguita tenendo conto delle caratteristiche HLA, poiché è noto che i cosiddetti “mismatch” nell’HLA sono la causa più forte di una reazione di rigetto inversa (malattia del trapianto contro l’ospite, GVHD). Inoltre, è noto – ma non ancora implementato nella clinica – che il livello di espressione di alcune varianti alleliche HLA disparate può essere associato alla gravità della GVHD [2], e che alcune varianti alleliche disparate possono allo stesso tempo influenzare la probabilità di recidiva della malattia [3]. La considerazione di questi “mismatch” permissivi (per la GVHD o gli effetti graft-versus-leukaemia, GVL) nella selezione dei donatori è abbastanza concepibile in futuro, in vista di un numero crescente di donatori registrati. Attualmente ci sono oltre 32 milioni di donatori di cellule staminali registrati in tutto il mondo (123 471 in Svizzera al 12.08.2018 e >8 milioni in Germania, www.wmda.info), il che significa che nonostante la diminuzione delle dimensioni della famiglia e del numero di fratelli, è possibile trovare un donatore HLA-identico non correlato per oltre il 70% dei pazienti di origine caucasica. Per altri gruppi etnici, tuttavia, questa probabilità è significativamente più bassa [4], e le persone di discendenza etnica mista di solito hanno solo basse possibilità di trovare con successo un donatore non imparentato.
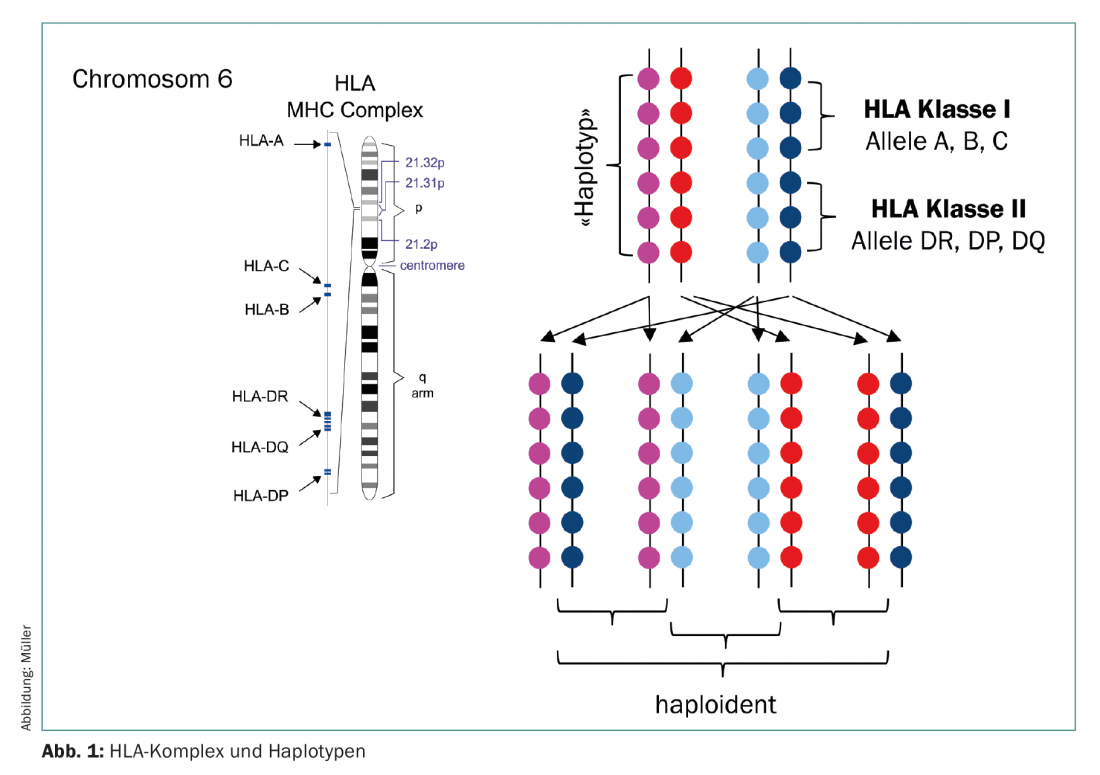
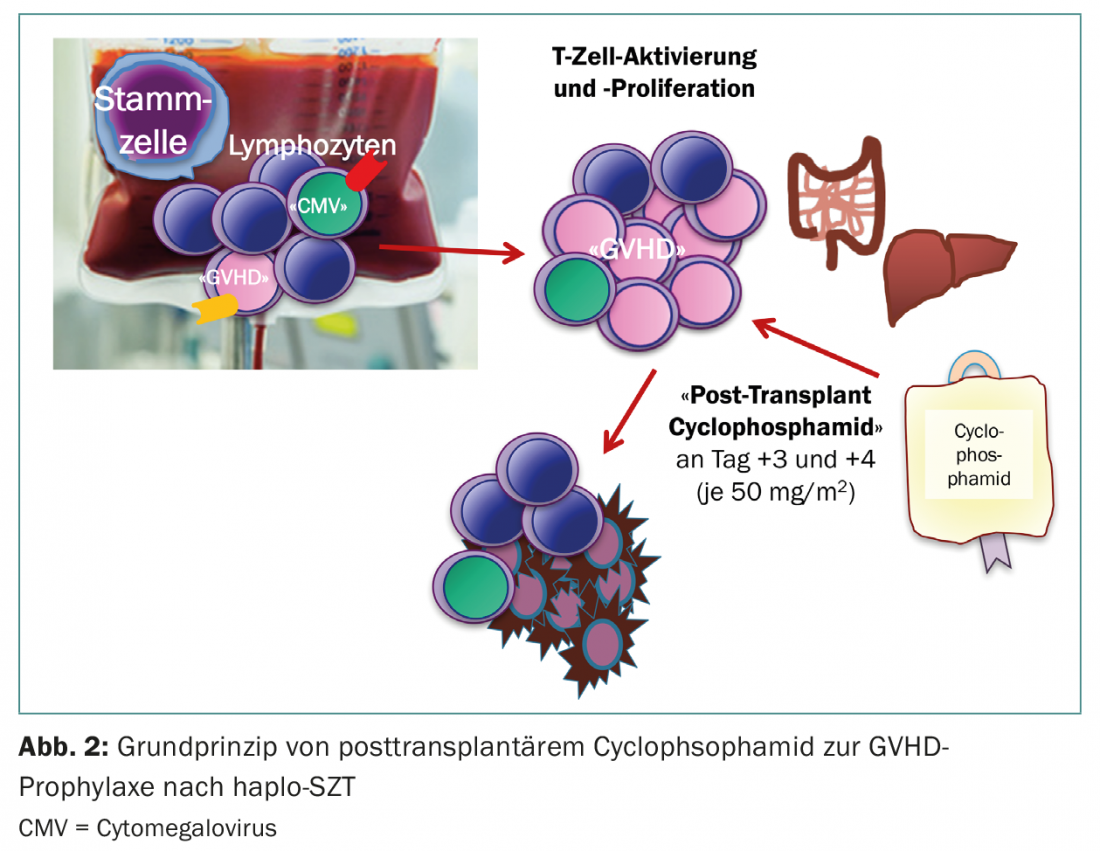
Una fonte alternativa di cellule staminali è rappresentata dai donatori aploidentici (semi-accoppiati) (Fig. 1) . Fino a pochi anni fa, i trapianti aploidentici venivano utilizzati con la stessa riluttanza dei cordoni ombelicali, in quanto entrambi erano associati a un alto rischio di gravi complicazioni. Dal 2012 circa, tuttavia, l’aplo-SCT sta guadagnando popolarità, in quanto una nuova manovra terapeutica è entrata in clinica. Il gruppo guidato da E. Fuchs e L. Luznik ha sviluppato un regime di condizionamento in cui il midollo osseo non manipolato di donatori aploidentici con un contenuto completo di cellule T viene infuso nei pazienti senza immunosoppressione concomitante. È noto che nei primi giorni dopo il trapianto, a causa della linfopenia nel ricevente, si verifica una massiccia proliferazione ed espansione dei linfociti (espansione omeostatica). Qui proliferano soprattutto i linfociti attivati, cioè le cellule che hanno trovato il loro antigene bersaglio sui tessuti del ricevente e che di conseguenza porterebbero alla GVHD acuta. In questa ipotesi, il giorno 3 e 4 dopo l’aplo-SZT viene somministrata una dose elevata di ciclofosfamide, che a sua volta uccide i linfociti che si stanno dividendo. I linfociti a riposo, invece, vengono risparmiati, così come le stesse cellule staminali, in modo che la rigenerazione ematopoietica avvenga senza limitazioni (Fig. 2) [5,6]. Il successo di questo regime è ormai dimostrato, sia negli studi che nella pratica clinica [7,8]. Poiché i genitori e i figli sono certi, e i fratelli hanno una probabilità del 50% di essere aploidentici, ora è possibile identificare un donatore per quasi tutti i pazienti – anche per quelli la cui origine etnica non è sufficientemente rappresentata nel registro, o nei Paesi in cui non è possibile finanziare una donazione esterna costosa.
Condizionamento, effetti collaterali e mortalità
Ci sono meno novità nell’area del condizionamento e delle sue complicazioni. Con la consapevolezza che il trapianto allogenico è un’immunoterapia e che non è tanto la chemioterapia di condizionamento, quanto piuttosto l’alloreattività delle cellule T dirette contro le cellule maligne, che può ottenere un controllo immunologico a lungo termine della neoplasia sottostante, l’intensità della chemioterapia preparatoria è stata ridotta (“condizionamento a intensità ridotta”, RIC), il che ha ridotto in modo significativo la sua tossicità e mortalità. Di conseguenza, il trapianto allogenico è ora accessibile anche ai pazienti anziani e a quelli con comorbilità. Questo si riflette chiaramente nelle cifre dei trapianti, poiché le neoplasie mieloidi in particolare sono malattie dell’età avanzata. Il condizionamento RIC ha conquistato un posto fisso nella clinica negli ultimi 10-15 anni e oggi rappresenta circa la metà della SCT allogenica. La questione se si verifichi un maggior numero di recidive dopo la RIC rispetto al condizionamento mieloablativo (MAC) non è ancora stata chiarita per tutte le entità patologiche e rimane oggetto di un dibattito continuo.
Una componente diffusa dei regimi di condizionamento ridotti e mieloablativi è oggi la globulina anti-timociti (ATG), che funge da deplezione delle cellule T in vivo per la profilassi della GVHD. Diversi studi hanno dimostrato che l’ATG può ridurre non solo il tasso di GVHD acuta, ma anche quello di GVHD cronica. Tuttavia, le esperienze relative alla probabilità di recidiva dopo la SCT sono contrarie, motivo per cui l’ATG viene utilizzato con maggiore cautela negli Stati Uniti rispetto all’Europa.
Una minore GVHD cronica (ma non acuta) è associata all’uso del midollo osseo (BM) piuttosto che del sangue periferico mobilizzato come fonte di cellule staminali [9], il che è attribuito al minore contenuto di cellule T del midollo osseo. Tuttavia, a causa delle spese significativamente più elevate per il donatore e il centro di raccolta, attualmente sembra improbabile che il numero di trapianti di BM a scapito dei trapianti di cellule staminali del sangue periferico acquisisca importanza nel prossimo futuro.
Nella GVHD conclamata, due “nuove” sostanze promettenti sono attualmente in fase di sperimentazione clinica – da un lato, l’inibitore JAK1/2 ruxolitinib, che può anche inibire l’attività delle cellule T attraverso i percorsi di segnalazione STAT [10], dall’altro, ibrutinib è stato approvato negli Stati Uniti per il trattamento della GVHD cronica. Ibrutinib è un inibitore irreversibile di piccole molecole della tirosin-chinasi Bruton e della chinasi inducibile dell’interleuchina 2 (ITK). Quest’ultima chinasi è significativamente coinvolta nell’attivazione delle cellule T e quindi nello sviluppo dell’alloreattività e della GVHD [11].
Nuove strategie terapeutiche cellulari contro le recidive
La sopravvivenza complessiva dopo l’allectomia è migliorata in modo significativo negli ultimi due o tre decenni. La mortalità associata alla terapia è diminuita in modo significativo grazie al miglioramento degli agenti antimicrobici (soprattutto antimicotici e antivirali). Tuttavia, nonostante tutti i progressi, il tasso di recidiva dopo l’allosCT non è migliorato, portando infine alla morte oltre il 25% dei pazienti [12]. Gli approcci per prevenire le recidive post-trapianto in futuro includono le seguenti considerazioni: L’effetto dell’allo-SCT e la sua superiorità rispetto alla chemioterapia ad alte dosi con trasfusione di cellule staminali autologhe (auto-SCT) si basano sull’effetto GVL. Questo può essere di lunga durata e proteggere dalle recidive della malattia, ma richiede un certo periodo di tempo per “stabilirsi”. In particolare, nelle leucemie aggressive, spesso si verifica una nuova attività della malattia molto presto dopo la terapia di allotrapianto, anche prima che si verifichi un effetto GVL. Per questo motivo, si stanno sperimentando strategie che prevedono la prosecuzione della terapia farmacologica profilattica all’inizio del periodo successivo all’allotrapianto, ad esempio con sostanze ipometilanti, combinandole con i linfociti del donatore, se necessario, al fine di controllare la malattia fino all’instaurarsi di un effetto GVL sufficiente.
Una strategia alternativa per curare le neoplasie immunologicamente o attraverso l’attività delle cellule T è la manipolazione genetica delle cellule T nelle cosiddette cellule T chimeriche con recettore dell’antigene (CAR-T) (Fig. 3). Per le neoplasie linfoproliferative CD19-positive, le cellule CAR-T commerciali sono già clinicamente disponibili – presto anche in Svizzera. Tali cellule CAR-T modificate riconoscono il loro antigene bersaglio con la sensibilità di un anticorpo, indipendentemente dall’MHC, e agiscono con l’efficienza potenziata di una cellula T [13,14]. A differenza dei trasferimenti cellulari convenzionali di cellule T fresche o espanse in vitro, anche piccoli numeri di queste cellule CAR-T geneticamente modificate sono in grado di dare risposte immunitarie massicce. Lo svantaggio è che le cellule CAR-T possono essere sviluppate solo contro antigeni tumorali noti ed “esclusivi” o che i danni collaterali inevitabili alle cellule sane devono essere tollerati. Nel caso delle cellule CAR-T con bersaglio CD19 per i linfomi aggressivi e la leucemia linfoblastica B acuta, vengono inevitabilmente eliminate anche le cellule B sane. La conseguenza è l’ipogammaglobulinemia, che può essere sostituita in modo clinicamente pragmatico. La situazione è più complessa nel caso della leucemia mieloide acuta, per esempio. La cellula staminale leucemica non può essere chiaramente distinta fenotipicamente dalla cellula staminale sana del sangue. L’immunoterapia diretta contro la cellula staminale leucemica richiede quindi cellule CAR-T modificate e innovative, che abbiano una vita sicura e breve (ma che esercitino la loro funzione effettrice in modo sufficientemente forte e selettivo) o che possano essere eliminate di nuovo in modo specifico. È prevedibile un grave danno collaterale alle cellule staminali ematopoietiche sane con un’aplasia prolungata, per cui tali terapie possono essere clinicamente fattibili solo con il concetto di follow-up della SCT.
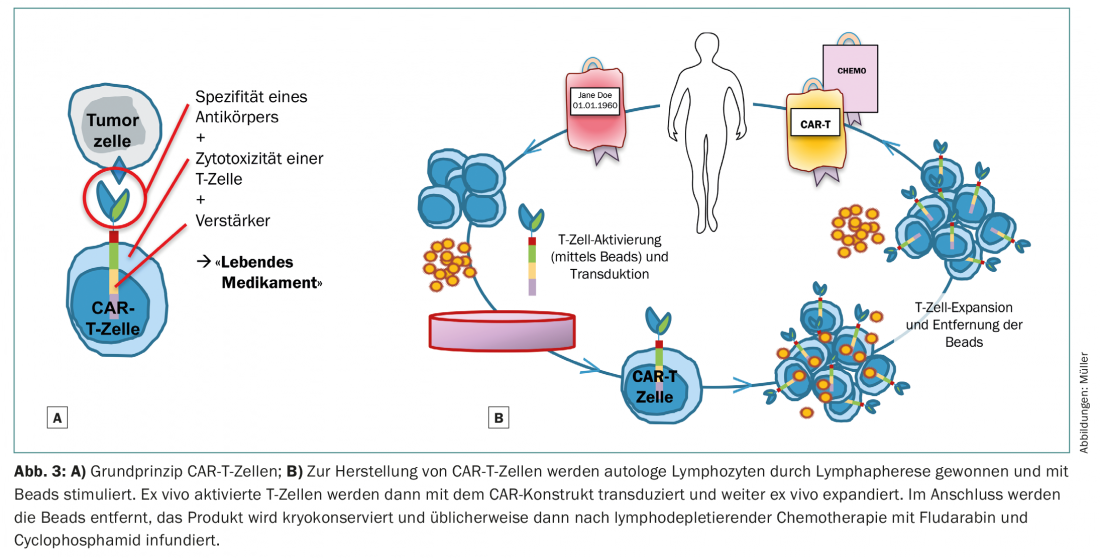
Non è ancora possibile che le terapie cellulari CAR-T sostituiscano completamente l’allo-SCT nel prossimo futuro. Tuttavia, per alcune entità, come i linfomi aggressivi a cellule B e forse anche i mielomi, sembra ipotizzabile che le terapie cellulari CAR-T possano essere superiori alla SCT autologa e allogenica.
Autolog – novità su vecchi percorsi
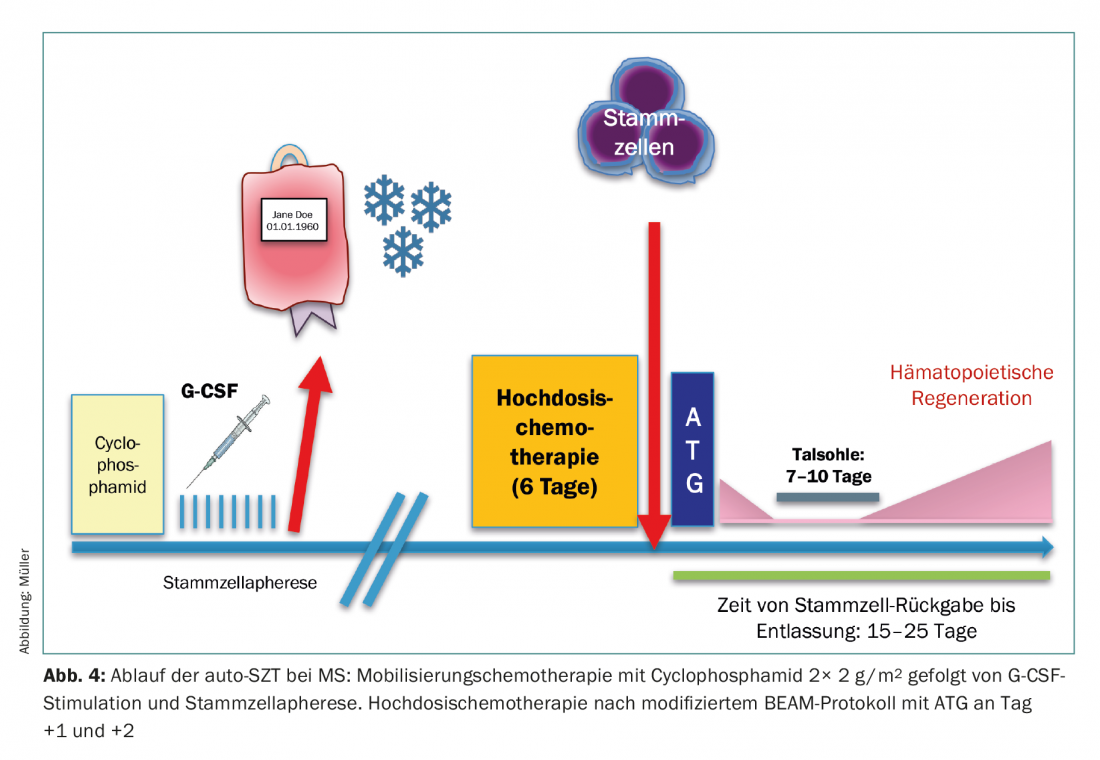
L’uso dell’auto-SCT è attualmente in fase di espansione presso l’Ospedale Universitario di Zurigo, sotto forma di uno studio di registro per i pazienti con sclerosi multipla (SM). La mobilitazione delle cellule staminali viene effettuata con la ciclofosfamide, fortemente linfodepleta, per mantenere la contaminazione linfocitaria dell’aferesi il più bassa possibile. Dopo la chemioterapia ad alte dosi, viene eseguita un’ulteriore deplezione delle cellule T in vivo dopo il trapianto, utilizzando ATG (giorno 1 e 2) per eliminare le cellule T residue. Dopo l’eradicazione completa del sistema ematopoietico e linfatico, la “ripartenza” avviene a partire dalle cellule staminali del sangue. (Fig.4). I dati biologici sull’efficacia di questo principio sono disponibili sotto forma di molte osservazioni fondate in modelli preclinici, ma anche in studi clinici di fase II, che hanno potuto dimostrare che questa manovra terapeutica può arrestare completamente la progressione della SM in molti casi. [15,16].
Il trapianto classico di cellule staminali diventerà una forma di trattamento superflua nel prossimo futuro? Certamente non al momento – ma si spera che il campo si muova nella direzione di terapie cellulari innovative e su misura, che abbiano effetti collaterali minori o meglio controllabili, di più breve durata e che attacchino in modo più efficiente le cellule tumorali invece dei tessuti sani.
Messaggi da portare a casa
- Nonostante le nuove sostanze mirate e le immunoterapie, il numero di trapianti di cellule staminali eseguiti ogni anno continua ad aumentare costantemente.
- Il numero crescente di donatori volontari registrati e i regimi di condizionamento a intensità ridotta consentono oggi l’accesso al trapianto di cellule staminali allogeniche a una popolazione di pazienti significativamente più ampia.
- Le recidive dopo il trapianto di cellule staminali allogeniche rimangono la principale causa di morte e richiedono nuove strategie per la profilassi delle recidive e il rafforzamento degli effetti del trapianto contro la leucemia.
- Le cellule T con recettore dell’antigene chimerico sono la forma più moderna di terapia cellulare, ma sono attualmente in uso clinico solo per alcune entità patologiche.
- I trapianti autologhi di cellule staminali non sono utilizzati solo per il trattamento di malattie ematologiche maligne, ma anche per il trapianto di cellule staminali.
- può anche arrestare il decorso delle malattie autoimmuni, riavviando il sistema immunitario.
Letteratura:
- Passweg JR, et al: L’uso del trapianto da donatore non correlato si sta stabilizzando in Europa? Rapporto sull’attività del 2016 della Società Europea per il Trapianto di Sangue e Midollo. Trapianto di midollo osseo 2018. DOI: 10.1038/s41409-018-0153-1 [Epub ahead of print].
- Petersdorf EW, et al: Alta espressione di HLA-DP e malattia del trapianto contro l’ospite. N Engl J Med 2015; 373(7): 599-609.
- Venstrom JM, et al: prevenzione HLA-C-dipendente della recidiva di leucemia da parte del donatore che attiva KIR2DS1. N Engl J Med 2012; 367(9): 805-816.
- Gragert L, et al: Probabilità di corrispondenza HLA per i trapianti di cellule staminali ematopoietiche nel registro statunitense. N Engl J Med 2014; 371(4): 339-348.
- Robinson TM, et al: Trapianto di midollo osseo e cellule staminali aploidentiche: esperienza con la ciclofosfamide post-trapianto. Semin Hematol 2016; 53(2): 90-97.
- Luznik L, O’Donnell PV, Fuchs EJ: Ciclofosfamide post-trapianto per l’induzione della tolleranza nel trapianto di midollo osseo HLA-aploidentico. Semin Oncol 2012; 39(6): 683-693.
- McCurdy SR, et al: Endpoint compositi comparabili dopo trapianto HLA-matched e HLA-aploidentico con ciclofosfamide post-trapianto. Haematologica 2017; 102(2): 391-400.
- Kasamon YL, et al: Studio prospettico di BMT non mieloablativo, HLA-mismatched, non correlato, con ciclofosfamide post-trapianto ad alto dosaggio. Blood Adv 2017; 1(4): 288-292.
- Anasetti C, et al: Cellule staminali da sangue periferico rispetto al midollo osseo da donatori non correlati. N Engl J Med 2012; 367(16): 1487-1496.
- Zeiser R, et al: Ruxolitinib nella malattia del trapianto contro l’ospite refrattaria ai corticosteroidi dopo il trapianto di cellule staminali allogeniche: uno studio multicentrico. Leucemia 2015; 29(10): 2062-2068.
- Miklos D, et al: Ibrutinib per la malattia cronica del trapianto contro l’ospite dopo il fallimento della terapia precedente. Sangue 2017; 130(21): 2243-2250.
- Appelbaum FR: Migliori risultati con il trapianto di cellule ematopoietiche allogeniche. Best Pract Res Clin Haematol 2012; 25(4): 465-471.
- Dai H, et al: Cellule T modificate con recettori dell’antigene chimerici per la terapia del cancro. J Natl Cancer Inst 2016; 108(7).
- Curran KJ, Pegram HJ, Brentjens RJ: Recettori antigenici chimerici per l’immunoterapia delle cellule T: comprensione attuale e direzioni future. J Gene Med 2012; 14(6): 405-415.
- Muraro PA, et al: Esiti a lungo termine dopo il trapianto autologo di cellule staminali ematopoietiche per la sclerosi multipla. JAMA Neurol 2017; 74(4): 459-469.
- Mancardi GL, et al: Trapianto autologo di cellule staminali ematopoietiche nella sclerosi multipla: uno studio di fase II. Neurologia 2015; 84(10): 981-988.
InFo ONcOLOGIA & EMATOLOGIA 2018; 6(5): 26-30.











