I tumori T1-T2 N0 vengono operati principalmente. Il carcinoma esofageo prossimale è un’indicazione per la sola radio-chemioterapia (RCT). Al contrario, i carcinomi T3-T4 e N+ vengono trattati trimodalmente, se possibile. La RCT neoadiuvante aumenta il tasso di resezione e migliora la sopravvivenza libera da malattia e globale. In caso di inoperabilità, una RCT definitiva può addirittura raggiungere una sopravvivenza a cinque anni fino al 30%. La terapia trimodale del carcinoma esofageo deve essere eseguita in un centro esperto. La sola chemioterapia perioperatoria migliora i risultati della chirurgia per il cancro gastrico. In una situazione N+, si deve prendere in considerazione una RCT adiuvante combinata.
Charles Moertel ha riferito per la prima volta sulla radio-chemioterapia simultanea (RCT) per i tumori gastrointestinali non resecabili nel 1969 su Lancet [1]. Oggi, la combinazione delle due modalità terapeutiche, insieme alla chirurgia, è standard per molti tumori dall’esofago al canale anale. Lo sviluppo dell’endoscopia a fibre ottiche, il perfezionamento delle tecniche di imaging e la standardizzazione della stadiazione hanno permesso di valutare meglio il rischio specifico del tumore per i singoli pazienti. I progressi tecnici nella radioterapia hanno perfezionato l’ottimizzazione dell’applicazione della dose al tumore, risparmiando il più possibile gli organi sani circostanti a rischio.
Nonostante l’introduzione di nuove sostanze in varie combinazioni, lo sviluppo di diversi anticorpi contro l’EGFR e la scoperta di importanti biomarcatori come KRAS, NRAS e BRAF, il 5-fluouracile, utilizzato da decenni, è ancora un componente importante dell’attuale polichemioterapia. Nel complesso, ciò ha comportato un leggero aumento dei tassi di sopravvivenza a cinque anni per il cancro esofageo e gastrico negli ultimi 30 anni.
Cinque studi randomizzati sull’uso della sola radioterapia preoperatoria non hanno mostrato alcun vantaggio in termini di sopravvivenza. Allo stesso modo, tre studi randomizzati hanno mostrato un miglioramento del controllo locale, ma nessun beneficio in termini di sopravvivenza con la sola radioterapia post-operatoria.
Caratteristiche biologiche del carcinoma esofageo
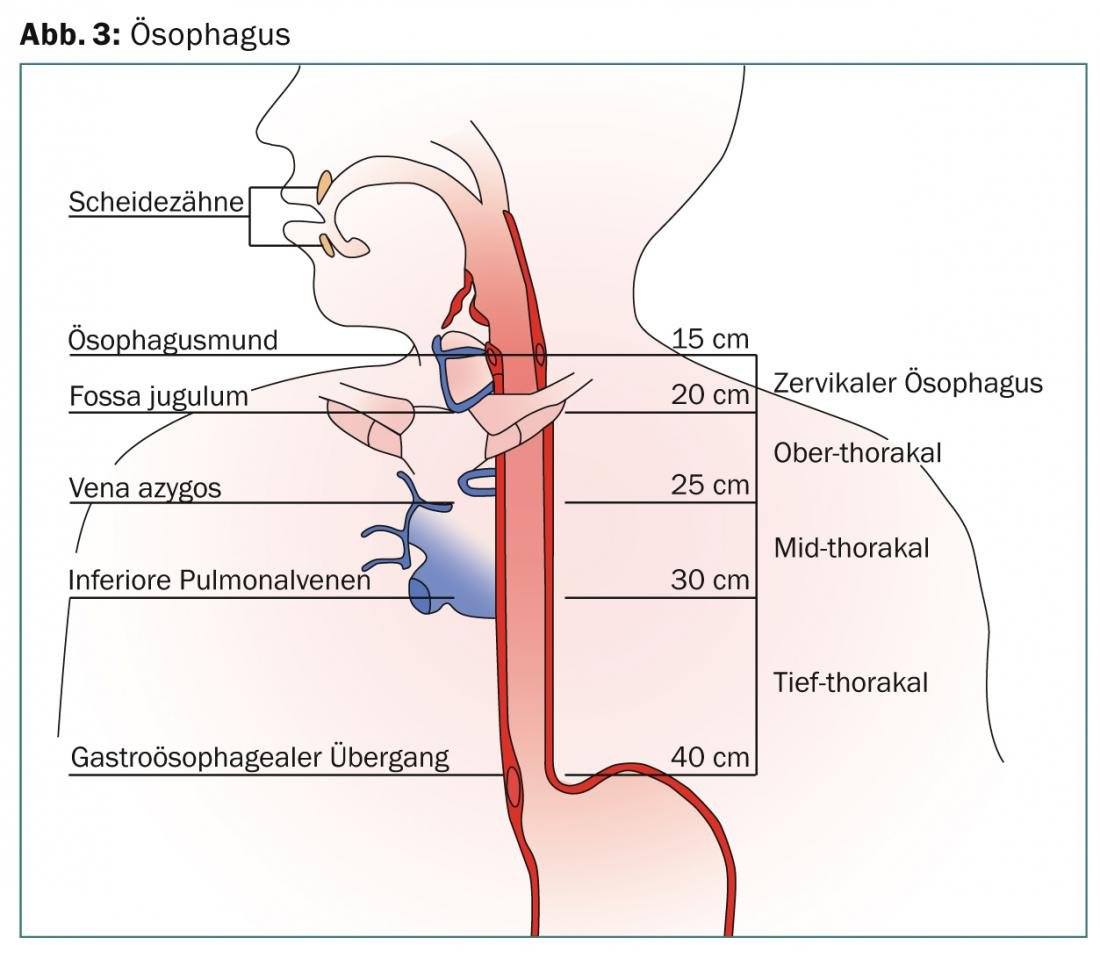
L’esofago si estende per oltre 25 cm dal muscolo cricofaringeo cranialmente alla giunzione esofagogastrica caudalmente. La linea Z visibile endoscopicamente definisce la transizione dalla cellula pavimentale all’epitelio cilindrico. Nell’esofago di Barrett, l’epitelio pavimentale è sostituito da un epitelio cilindrico altamente stratificato. Secondo l’ultimo rapporto AJCC, l’organo è suddiviso nelle regioni cervicale, toracica superiore, toracica media e toracica profonda (Fig. 1) .

La lunghezza viene calcolata endoscopicamente dagli incisivi all’ingresso dello stomaco in centimetri. La struttura muraria multistrato dell’organo è attraversata da un’abbondante rete di vasi linfatici. Le metastasi linfonodali nel tronco celiaco, precedentemente classificate come M1, sono definite come M0 secondo l’ultima classificazione AJCC (2010), poiché sono coperte dal volume di radiazioni per impostazione predefinita. Le metastasi linfogeniche sono correlate allo stadio T, alla lunghezza del tumore e al grado di differenziazione e possono raggiungere il 38-60% in una lesione T2, con un coinvolgimento microscopico in >60% dei casi, che non può essere rilevato con le attuali tecniche di imaging. Il coinvolgimento linfonodale dipende dalla localizzazione del tumore primario (Fig. 2).
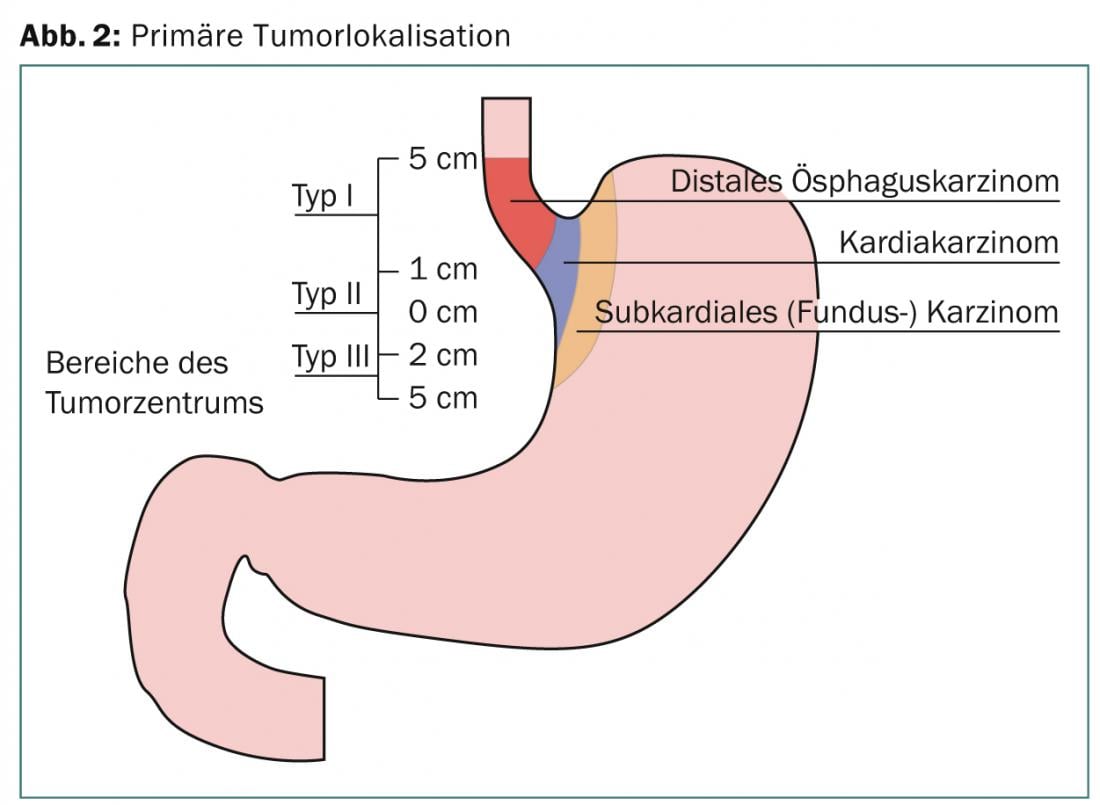
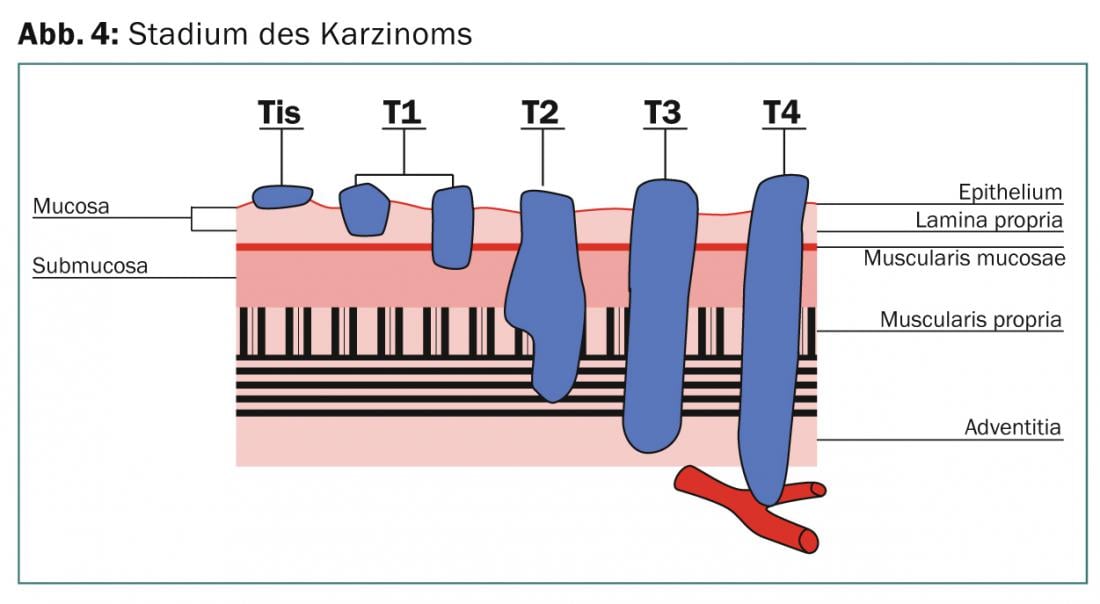
Alla diagnosi, circa la metà dei tumori esofagei non è resecabile o presenta già metastasi a distanza. Con rare eccezioni, di solito si tratta di adenocarcinomi o di carcinomi a cellule pavimentose, dove predomina il primo tipo, la cui incidenza è chiaramente aumentata negli ultimi anni. Si tratta di due entità tumorali diverse con eziologia, epidemiologia e prognosi differenti [2]. Questa circostanza viene presa in considerazione anche nella settima edizione dell’AJCC-Staging-Manuel [3]. Qui viene definita anche la localizzazione del tumore nella giunzione gastro-esofagea. Questi includono tumori dell’esofago distale che si estendono fino a 5 cm nello stomaco (Sievert III) (Fig. 3). Nella maggior parte degli studi prospettici, le diverse entità tumorali non vengono sempre distinte separatamente. Per un’ampia percentuale di localizzazioni distali del tumore, sono inclusi i tumori della giunzione gastro-esofagea.
Stabilizzazione
La diagnosi viene fatta tramite endoscopia e biopsia. In tutti i pazienti viene eseguita una TAC del torace e dell’addome e l’ecografia endoluminale decide lo stadio T e N. Prima di decidere il trattamento RCT o trimodale definitivo, viene eseguita una PET-CT come procedura standard, in quanto le metastasi a distanza vengono trovate fino al 22% dei casi durante questo esame di chiarificazione [4]. Se il tumore si trova al di sopra della carina, si deve escludere una fistola esofago-bronchiale con la broncoscopia, se c’è un sospetto clinico (Fig. 4).
Se il tumore è localizzato distalmente, è necessario eseguire una laparoscopia prima della terapia trimodale per escludere una metastasi peritoneale.
L’RCT neoadiuvante prima dell’intervento chirurgico pianificato
Il trattamento del carcinoma esofageo con intento curativo viene oggi offerto in un centro ospedaliero con un team interdisciplinare esperto. La pianificazione della radioterapia tridimensionale guidata dalla TAC viene eseguita per prima cosa, utilizzando una tecnica altamente specializzata che comprende l’applicazione della dose a intensità modulata e una sequenza di radiazioni guidata dalle immagini (Image-Guided RT).
Nella situazione neoadiuvante, di solito vengono somministrati 45 gradi (Gy) nell’arco di cinque settimane. Negli anni ’90, la chemioterapia simultanea secondo il cosiddetto regime Herskovic (combinazione di cisplatino e 5-fluouracile) veniva somministrata ai pazienti come standard [5]. Lo studio RTOG-8501 ha dimostrato per la prima volta che la radio/chemioterapia simultanea è significativamente superiore alla sola radioterapia [6].
La RCT neoadiuvante migliora la sopravvivenza ed è ora lo standard per i tumori >T2 e/o N+. Il raggiungimento della resezione R0 è uno degli obiettivi più importanti per garantire la sopravvivenza libera da tumore a lungo termine.
Se l’assunzione di cibo è impossibile, si deve creare una digiunostomia invece di una PEG se si pianifica un intervento chirurgico, per non compromettere la successiva formazione di un ‘neo-esofago’ dopo la resezione.
I carcinomi esofagei prossimali sono generalmente trattati con RCT definitiva.
Il risultato della PET-CT è rilevante per la pianificazione della terapia; la parte PET-avida si correla molto bene con il risultato endoscopico dell’estensione del tumore [7]. Gli studi istologici dopo l’esofagectomia hanno dimostrato che una marcatura di 3 cm prossimale e distale al tumore può coprire il 94-100% del coinvolgimento microscopico subclinico [8]. Di norma, oggi vengono definiti come margini di sicurezza 3-5 cm cranio caudali e 2 cm laterali rispetto al GTV (volume tumorale macroscopico). Se il tumore è localizzato prossimalmente, sono incluse le stazioni linfonodali sopraclaveari, mentre se è localizzato distalmente, sono incluse le stazioni linfonodali celiache [8]. I tumori della GEJ distale possono richiedere l’inclusione dei linfonodi celiaci e di quelli della piccola e grande curvatura dello stomaco.
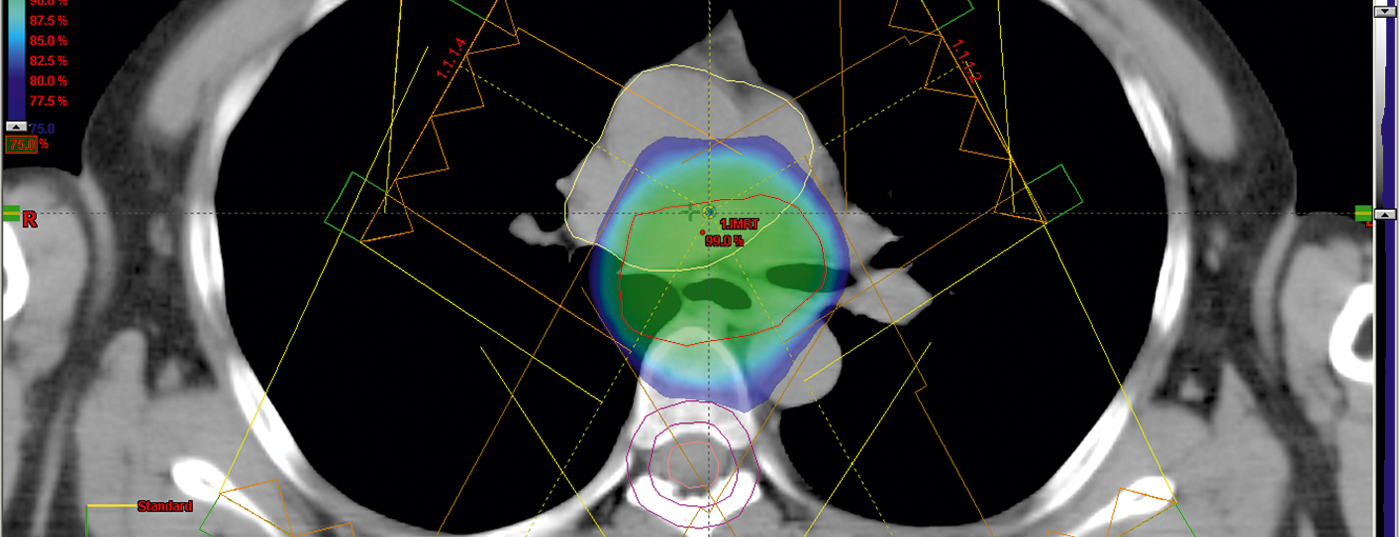
L’irradiazione ottimale a più campi consente di osservare le dosi ammissibili agli organi sani (polmoni, cuore, fegato) o i vincoli (Fig. 5).
L’intervento chirurgico viene solitamente eseguito da sei a otto settimane dopo il completamento della RCT simultanea.
Walsh [9] ha dimostrato un vantaggio significativo a favore della terapia bimodale in 110 pazienti con adenocarcinomi in combinazione con 40 Gy e cisplatino/5-FU rispetto alla sola chirurgia. Tuttavia, il lavoro è stato criticato per gli scarsi risultati chirurgici. Tre studi randomizzati [10–12] hanno mostrato un beneficio in termini di sopravvivenza a favore della terapia combinata e una tendenza a risultati significativamente migliori quando si raggiunge la remissione completa del tumore. Tuttavia, i numeri dei pazienti negli studi erano modesti. Lo studio più grande in termini numerici, il cosiddetto Cross Trial, è stato pubblicato da van Hagen sul New England Journal of Medicine nel 2012. Nello studio, che ha confrontato l’RCT neoadiuvante con taclitaxel e cisplatino con 41,4 Gy in 23 frazioni rispetto alla sola chirurgia, 366 pazienti sono stati randomizzati in ciascuno dei due bracci, il 75% aveva un adenocarcinoma e il 23% un carcinoma a cellule pavimentose. La resezione R0 è stata del 92% nel gruppo combinato rispetto al 69% con la sola chirurgia. È stato raggiunto un 29% di remissione patologica completa. I risultati a tre anni hanno mostrato un miglioramento significativo della sopravvivenza del 58 contro il 44% con la sola chirurgia. Da allora, questo regime è stato accettato come standard per i tumori esofagei e gastro-esofagei resecabili. Una meta-analisi pubblicata nel Lancet Oncology del 2011 [13] conferma il vantaggio della terapia neoadiuvante, risultando in un vantaggio non significativo a favore della RCT rispetto alla chemioterapia. Il beneficio assoluto di sopravvivenza dopo due anni è stato dell’8,7%, indipendentemente dall’istologia. Nel caso dei tumori della giunzione gastro-esofagea Siewert I + II, in occasione della prima conferenza GI-EORTC di due anni fa, è stata data la preferenza all’RCT neoadiuvante [14].
Chemioterapia neoadiuvante per il cancro dell’esofago
Il gruppo del Medical Research Council (MRC) ha randomizzato 800 pazienti con patch cell e adenocarcinoma dell’esofago a un gruppo con due cicli di cisplatino/5-FU e alla sola radioterapia. Anche dopo sei anni, i pazienti mostrano un vantaggio significativo in termini di sopravvivenza, pari al 23 contro il 17%, indipendentemente dall’istologia [15].
Il cosiddetto Magic Trial con l’uso della chemioterapia perioperatoria con epirubicina, cisplatino e 5-FU (ECF) rispetto alla sola chirurgia mostra una sopravvivenza a cinque anni del 36 contro il 23% ed è ora preferito come terapia neoadiuvante per i carcinomi gastrici resecabili. In ciascun gruppo, sono stati randomizzati 250 pazienti con tumore alla GEJ o gastrico.
RCT definitivo nel cancro dell’esofago
Non esistono studi randomizzati che confrontino direttamente la chirurgia e la radioterapia. La radioterapia da sola porta a una sopravvivenza mediana di 6-12 mesi e a una sopravvivenza a cinque anni di <10%. La radioterapia da sola, per via percutanea o con brachiterapia intraluminale, viene quindi utilizzata solo nella situazione palliativa.
I dati a lungo termine dello studio RTOG 85-01 [16] mostrano una sopravvivenza a cinque anni del 26% a favore dell’RCT. Nel complesso, mostrano un miglioramento significativo del controllo locale, della sopravvivenza mediana e complessiva. Questi dati sono abbastanza paragonabili a quelli della sola chirurgia nello studio MRC, con una sopravvivenza a cinque anni di circa il 20%. In generale, il valore del successivo intervento chirurgico non sembra essere significativamente decisivo per la sopravvivenza globale, nonostante il miglioramento del controllo locale. Uno studio randomizzato condotto dal francese Bedenne [17] su 445 pazienti giunge alla conclusione che con un buon tasso di risposta dopo una RCT simultanea, la chirurgia successiva non migliora la sopravvivenza. In uno studio di Stahl [18], progettato in modo simile, sebbene il controllo locale del tumore fosse migliorato da un successivo intervento chirurgico, la sopravvivenza a tre anni non era significativamente diversa. Dopo la chemioterapia di induzione con 5-FU, leucovorina, etoposide e cisplatino, seguita da una radioterapia a 40 Gy, i pazienti sono stati randomizzati in un gruppo con chirurgia diretta e uno con continuazione della RCT fino a 60 Gy. I pazienti che hanno risposto alla chemioterapia di induzione hanno beneficiato della successiva chirurgia in termini di sopravvivenza dopo tre anni, ma la mortalità è stata significativamente più alta nel gruppo operato. Gli autori hanno scoperto che il tasso di chirurgia ha migliorato il controllo locale ma non la sopravvivenza globale. Ulteriori studi devono stabilire se e in quali pazienti si può rinunciare alla chirurgia dopo l’RCT.
Poiché entrambe le modalità di trattamento, compresa la chirurgia, hanno un alto tasso di recidiva locoregionale, sono in corso diversi studi che testano nuove sostanze come i taxani, la gemzitabina o gli inibitori del recettore EGFR.
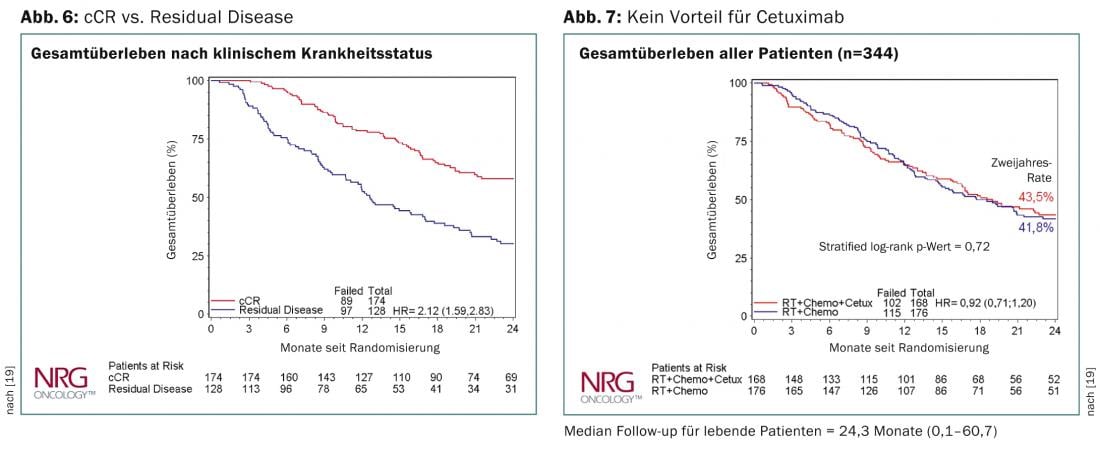
Al meeting ASCO di quest’anno a Chicago, sono stati presentati i dati dello studio RTOG-436 [19]. Si tratta di uno studio randomizzato di fase 3 per valutare l’effetto dell’aggiunta di cetuximab al RCT definitivo con paclitaxel e cisplatino. 344 pazienti sono stati randomizzati in totale; il tasso di remissione clinicamente completa è stato del 70%. La percentuale di tumori T3/T4 è stata riportata come 80%, quella di N+ come 66%, e due terzi dei pazienti avevano un adenocarcinoma. Nonostante l’aggiunta di cetuximab, la sopravvivenza globale non era significativamente diversa tra i due bracci. Non c’è stata inoltre alcuna differenza nei risultati relativi all’istologia. I pazienti con una remissione clinicamente completa avevano una sopravvivenza globale significativamente migliore dopo due anni (Fig. 6 e 7). Lo studio SCOPE [20] giunge alla stessa conclusione e non può raccomandare l’aggiunta di cetuximab nell’RCT definitivo.
In SAKK-75-02, è stata testata con successo la fattibilità della chemioterapia di induzione con docetaxel e cisplatino, seguita da una RCT combinata con 45 Gy e le stesse sostanze. Questo ha mostrato un tasso di risposta più elevato per i carcinomi a cellule pavimentali. Nella successiva SAKK75-06, l’aggiunta di Erbitux ha mostrato un tasso di risposta promettente. Il seguente studio prospettico randomizzato di fase III (SAKK 75-08) sta verificando il valore della terapia multimodale con o senza cetuximab. Lo studio è stato recentemente chiuso dopo l’arruolamento di >300 pazienti.
RCT preoperatorio vs. chemioterapia preoperatoria
Un confronto diretto tra la RCT preoperatoria e la sola chemioterapia neoadiuvante è stato effettuato in uno studio tedesco [21]. A causa di una cattiva accumulazione, purtroppo ha dovuto chiudere in anticipo. Gli autori dello studio hanno riscontrato una migliore remissione patologica completa del 2 contro il 16%, nonché un migliore controllo locale del 59 contro il 76% e una migliore sopravvivenza a tre anni del 28 contro il 47% a favore della modalità combinata.
RCT adiuvante nel cancro gastrico
Nello studio del 2001 pubblicato da Macdonald nel Journal Clinical Oncology, il 20% dei pazienti è indicato come affetto da GEJ. In questi casi, l’RCT adiuvante ha fornito un beneficio significativo per la sopravvivenza mediana di 36 mesi rispetto a 27 mesi con la sola chirurgia [22]. Il follow-up a lungo termine mostra un ulteriore beneficio per i tumori della GEJ in termini di sopravvivenza globale e di libertà dal tumore [23].
Lo studio ARTIST è stato presentato al meeting ASCO 2014 di Chicago. Si tratta di uno studio randomizzato di fase 3 che confronta la chemioterapia adiuvante con capecitabina/cisplatino (XB) da sola rispetto a XB più radioterapia simultanea con capecitabina [24]. Si tratta di un articolo proveniente dalla Corea del Sud con una resezione D-2 di un carcinoma gastrico. Sono stati randomizzati in totale 448 pazienti. Non sono state riscontrate differenze nei due bracci per quanto riguarda la libertà dalla malattia e la sopravvivenza globale.
Al contrario, i pazienti con metastasi linfonodali positive hanno mostrato un miglioramento staticamente significativo della sopravvivenza libera da malattia dopo tre anni, pari al 76 contro il 72% a favore della radioterapia.
Norbert Lombriser, MD
Letteratura:
- Moertel CG, et al: The Lancet 1969 Oct 25; 2(7626): 865-867.
- Siewert A: Surg 2001; 234-360.
- Rice TW, Blackstone EH, Rusch VW: Rice Annals of Surgical Oncology 2010; 17(7): 1721-1724.
- Flammen P, et al: JCO 2000; 18: 3202.
- Al-Sarraf M, et al: JCO 1997; 15(1): 277-284.
- Herskovic A, et al: NEJM 1992; 326(24): 1593-1598.
- Konski A, et al. Int J Radiat Oncol Biol Phys 2005; 61: 1123-1128.
- Hazard L, et al: J Natl Compr Canc Netw 2008; 6: 870-878.
- Walsh TN, et al: N Engl J Med 1996; 335: 462-467.
- Urba SG, et al. J Clin Oncol 2001; 19: 305-313.
- Bosset JF, et al: N Engl J Med 1997; 337: 161-167.
- Burmeister BH, et al: Lancet Oncol 2005; 6: 659-668.
- Sjoquist KM, et al: Lancet Oncology luglio 2011; 12(7): 681-692.
- Lutz MP: European Journal of Cancer 2012; 48: 2941-2953.
- Allum WH, et al: J Clin Oncol 2009; 27: 5062-5067.
- Cooper JS, et al: Gruppo di Oncologia della Radioterapia. JAMA 1999; 281: 1623-1627.
- Bedenne L, et al: J Clin Oncol 2007; 25: 1160-1168.
- Stahl M, et al: J Clin Oncol 2005; 23: 2310-2317.
- Riunione ASCO 2014 Abstract 4007.
- Crosby T, Hurt CN: Lancet Oncology 2013; 14(7): 627-637.
- Stahl M, et al: J Clin Oncol 2009; 27: 851-856.
- Macdonald JS, et al: N Engl J Med 2001; 345: 725-730.
- Smalley SR, et al: J Clin Oncol 2012; 30(19): 2327-2333.
- Riunione ASCO 2014 Abstract 4008.
- Cunningham D, et al: N Engl J Med 2006; 355: 11-20.
- van Hagen P, et al: N Engl J Med 2012; 366: 2074-2084.
- Ruhstaller T: Annali di Oncologia 2009; 20: 1522-1528.
InFo Oncologia & Ematologia 2014; 2(6): 6-10