Le persone con lesioni al di sotto dei segmenti del midollo spinale cervicale soffrono di paraplegia spastica o flaccida. Le limitazioni nella capacità di camminare sono classificate come gravi dai pazienti affetti e sono al centro di questo articolo di formazione.
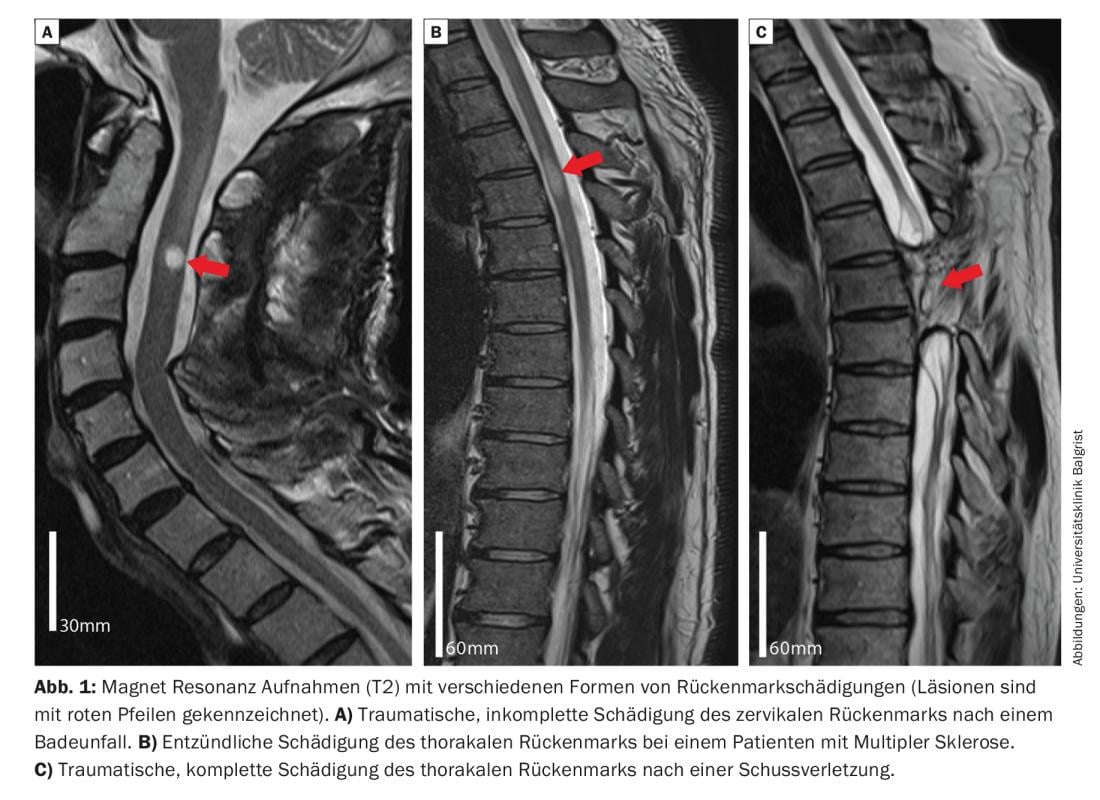
Il danno al midollo spinale può derivare da cause traumatiche, infiammatorie o vascolari ed è spesso associato a limitazioni gravi, spesso persistenti per tutta la vita, delle funzioni motorie, sensoriali e autonomiche. Circa la metà delle lesioni al midollo spinale sono di origine traumatica [1], con il 50% delle lesioni traumatiche al mielon che sono incomplete e conservano le funzioni sensoriali e/o motorie al di sotto della lesione [2]. A seconda dell’estensione e della localizzazione del danno spinale, vengono lesi diversi tratti nervosi ascendenti e discendenti (Fig. 1). Questo porta a vari deficit funzionali, che possono variare da lievi disturbi sensoriali e debolezza di singoli gruppi muscolari all’incapacità di camminare e alla perdita completa della vescica urinaria, dell’intestino e della funzione sessuale. Le lesioni traumatiche colpiscono più comunemente il midollo spinale cervicale, che può portare a una respirazione compromessa e a deficit nelle estremità superiori e inferiori (tetraplegia) [3]. Le persone con lesioni al di sotto dei segmenti del midollo spinale cervicale soffrono di paralisi spastica (lesione toracica o lombare) o flaccida (danno al cono/cauda equina). Le limitazioni nella capacità di camminare sono considerate gravi dai pazienti affetti [4] e sono al centro di questo articolo.
Meccanismi di recupero spontaneo dopo una lesione del midollo spinale
Nel sistema nervoso centrale, c’è solo una capacità limitata di processi di rigenerazione dopo le lesioni. Pertanto, le fibre nervose recise non possono ricrescere su grandi distanze per ripristinare le connessioni nervose originali. Tuttavia, molti pazienti mostrano un recupero funzionale spontaneo dopo una lesione del midollo spinale. I risultati della ricerca sugli animali hanno dimostrato che diversi processi e meccanismi sono responsabili del recupero funzionale nella fase acuta, subacuta e cronica dopo un danno spinale. Questi includono la diminuzione dell’edema e dell’infiammazione nel sito del danno, la remissione dell’eccitotossicità neuronale nel tessuto nervoso perilesionale [5,6], la parziale rimielinizzazione delle fibre nervose demielinizzate [7] e varie forme di plasticità neuronale [8]. Gli adattamenti plastici del sistema nervoso centrale indotti da una lesione vanno dai cambiamenti a livello molecolare (ad esempio, l’aumento dei recettori sui motoneuroni e sugli interneuroni [9]) alle modifiche strutturali delle reti neuronali [10,11]. Le fibre nervose non danneggiate possono crescere nelle regioni spinali denervate dal danno e ripristinare le funzioni (germinazione compensativa di assoni intatti) [12]. Le fibre nervose lesionate dalla lesione mostrano una crescita locale limitata (germinazione rigenerativa degli assoni lesionati) e possono, ad esempio, riproiettarsi nel senso di reindirizzarsi verso interneuroni propriospinali, che a loro volta consentono la trasmissione del segnale intorno al sito della lesione [13]. Tali adattamenti strutturali all’interno del sistema nervoso centrale sono stati osservati in modelli animali in sistemi e reti neurali funzionalmente distinti (ad esempio, i sistemi cortico-spinale, bulbo-spinale e propriospinale) e sono stati associati al recupero delle funzioni motorie grossolane e fini dopo un danno al midollo spinale [14].
Effetti neurobiologici della formazione
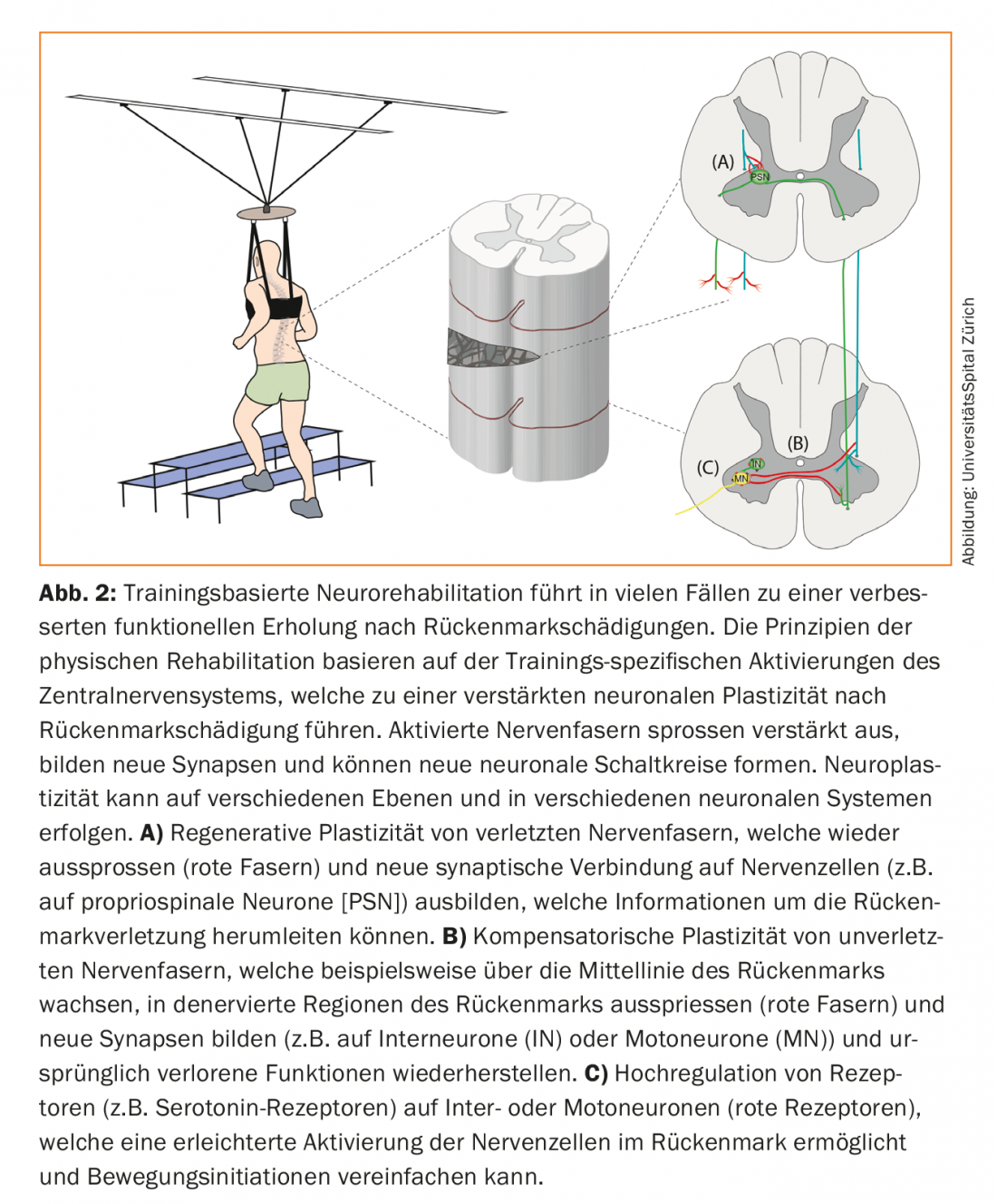
Uno degli obiettivi della ricerca attuale è quello di promuovere e migliorare i meccanismi spontanei descritti del recupero funzionale dopo la lesione del midollo spinale attraverso le terapie. Nonostante i promettenti risultati degli studi preclinici, attualmente non sono disponibili trattamenti farmacologici efficaci per i pazienti con lesioni al midollo spinale. L’allenamento fisico, invece, è parte integrante dell’attuale neuroriabilitazione. Gli studi hanno dimostrato miglioramenti significativi della funzione motoria attraverso l’allenamento nei pazienti con paraplegia incompleta [15]. I principi della neuroriabilitazione basata sull’allenamento si basano sull’attivazione dei circuiti neuronali sopra e sotto la lesione del midollo spinale. I neuroni spinali e sopraspinali possono riorganizzarsi attraverso la formazione e interconnettersi [16] (Fig. 2). L’attivazione delle reti neuronali indotta dall’allenamento aumenta la germinazione spontanea delle fibre nervose ferite e non ferite. Nel processo, le proiezioni legate allo scopo vengono consolidate, mentre le connessioni nervose inutilizzate e ridondanti vengono nuovamente smantellate (potatura neuronale) [17]. I meccanismi molecolari e sinaptici alla base degli effetti dell’addestramento corrispondono presumibilmente a quelli della teoria dell’apprendimento: l’attività simultanea dei sistemi neuronali associati viene stabilizzata, mentre l’attività non sincronizzata porta alla dissoluzione delle connessioni neurali (regola dell’apprendimento di Hebb) [18]. Inoltre, l’allenamento fisico ha un effetto positivo sull’intero sistema muscolo-scheletrico e sul sistema cardiovascolare dei pazienti. L’intensità, il periodo ottimale e il tipo di allenamento, così come il ruolo della motivazione del paziente, sono oggetto di ricerca attuale [19].
Focus clinico nella riabilitazione dei pazienti con lesioni al midollo spinale
L’obiettivo principale della riabilitazione è recuperare l’indipendenza. Una gestione della vescica e dell’intestino il più possibile indipendente è un obiettivo elementare della riabilitazione. Il piano di riabilitazione fisica varia a seconda della gravità e del tipo di lesione spinale. Per i pazienti con lesioni spinali cervicali alte, l’attenzione si concentra sul ripristino della respirazione spontanea e dell’indipendenza (ad esempio, con meccanismi di controllo basati sulla lingua). Mentre le lesioni cervicali più profonde sono addestrate al controllo dei movimenti delle braccia e delle mani, le lesioni spinali toraciche e lombari si concentrano sulla mobilità e sulla locomozione. Il campo della riabilitazione fisica sta diventando sempre più interdisciplinare: i terapisti sono spesso supportati da robot o da apparecchi di allenamento altamente strumentalizzati che consentono un allenamento intensivo e personalizzato (ad esempio, tramite sistemi di alleggerimento del peso, resistenza dinamica alla forza, ecc.) e quindi ottimizzano il recupero funzionale [20,21].
I nuovi approcci terapeutici nel campo della riabilitazione fisica mirano, tra l’altro, ad aumentare la motivazione dei pazienti durante l’addestramento: i programmi di addestramento basati sulla realtà virtuale (VR) proiettano situazioni quotidiane realistiche e variegate in laboratori e sale di addestramento monotoni e possono quindi migliorare l’efficienza dell’addestramento aumentando la motivazione [22,23]. Inoltre, sono state sviluppate apparecchiature di allenamento innovative e strumentate che consentono un esercizio degli arti inferiori mirato e adattato alla rispettiva limitazione del paziente. I pazienti con gravi problemi di deambulazione possono, ad esempio, essere addestrati con il robot di deambulazione (Lokomat®; Hocoma AG, Svizzera). Qui, un esoscheletro e un sistema di alleggerimento dinamico del peso supportano il paziente durante la deambulazione e consentono un allenamento intensivo del passo adattato individualmente. Una nuova generazione di sistemi trasparenti di supporto del peso (ad esempio, FLOAT®, Svizzera) consente di allenare la locomozione per i pazienti con disabilità deambulatorie da moderate a gravi. Questi sistemi dinamici utilizzano un feedback online per regolare in modo permanente l’alleggerimento del peso, consentendo così un allenamento multidimensionale dell’andatura e dell’equilibrio senza resistenza al movimento (ma con protezione dalle cadute). Ciò consente un allenamento intensivo e sicuro di movimenti rilevanti per la vita quotidiana e di movimenti complessi (ad esempio, camminare in curva, salire le scale, superare ostacoli), che può portare a un recupero funzionale migliore rispetto ai metodi di allenamento convenzionali (ad esempio, l’allenamento su tapis roulant) [24]. Un altro dispositivo di addestramento strumentato è il Grail System (MotekForce Link; NL): consente un addestramento alla deambulazione aggravato e giocoso per i pazienti con disturbi della deambulazione da lievi a moderati. Il sistema include un feedback diretto delle prestazioni per i pazienti e un sistema per indurre disturbi inaspettati (movimenti 3D del tapis roulant) durante la camminata [25].
Nuovi approcci terapeutici
Le nuove strategie riabilitative dopo la lesione del midollo spinale includono l’eccitazione elettrica dei neuroni spinali al di sotto della lesione, tramite [26] epidurale o stimolatori transcutanei [27]. Si pensa che l’eccitazione estrinseca dei neuroni spinali al di sotto del livello di danno al midollo spinale consenta alle afferenze periferiche e ai segnali sopraspinali residui di attivare più facilmente il midollo spinale. Questa attivazione facilitata dei neuroni al di sotto della lesione può migliorare la stabilità posturale, la capacità di camminare e la funzione della vescica nei pazienti con paraplegia [26,27]. Gli algoritmi di stimolazione ottimali e il gruppo target appropriato per la stimolazione elettrica del midollo spinale sono attualmente in fase di studio. Altre terapie mirano a stimolare la crescita dei nervi e la neuro-rigenerazione. Studi preclinici nei roditori e nei primati hanno dimostrato che gli anticorpi neutralizzanti contro la proteina Nogo-A che inibisce la crescita (anticorpo anti-Nogo-A), localizzata nella mielina del sistema nervoso centrale, portano a un aumento della plasticità neuronale (compresa la germinazione delle fibre nervose, nuove connessioni tra le fibre nervose) e a un migliore recupero funzionale dopo una lesione incompleta del midollo spinale [11,28]. L’effetto degli anticorpi neutralizzanti anti-Nogo-A sul recupero dei pazienti con lesioni al midollo spinale è attualmente in fase di sperimentazione clinica. Un altro approccio terapeutico per le lesioni del midollo spinale si basa sul trapianto o sull’impianto di cellule staminali o di cellule progenitrici neuronali direttamente nella lesione spinale. Gli studi sui roditori hanno rilevato che le cellule staminali/progenitrici trapiantate possono differenziarsi con successo in cellule gliali e neuroni: Le cellule gliali possono quindi indurre una parziale ri-mielinizzazione e una neuroprotezione, mentre i neuroni appena differenziati possono crescere, stabilire nuove connessioni sinaptiche e portare a un migliore recupero funzionale [29,30]. Nonostante i numerosi dati preclinici, gli effetti del trapianto di cellule nell’uomo sono ancora controversi e devono essere approfonditi in studi più ampi e controllati [31].
Messaggi da portare a casa
- Il danno al midollo spinale spesso porta a disturbi funzionali persistenti per tutta la vita, come paralisi, disturbi sensoriali e disfunzioni urinarie, intestinali e sessuali.
- La riabilitazione fisica è attualmente l’unica terapia consolidata per i pazienti con lesioni al midollo spinale. L’attivazione dei sistemi neuronali durante l’allenamento porta alla plasticità neuronale, che stimola il processo di recupero naturale.
- I nuovi dispositivi di allenamento strumentati consentono un allenamento personalizzato e intensivo del cammino per i pazienti con diversi gradi di disabilità deambulatoria. Le condizioni di allenamento adatte all’uso quotidiano e i sistemi di feedback funzionali promuovono la motivazione del paziente.
- Nuovi approcci terapeutici come la stimolazione elettrica del midollo spinale, la promozione farmacologica della rigenerazione neuronale o i trapianti di cellule staminali hanno già ottenuto risultati promettenti e potrebbero essere utilizzati in futuro come ulteriori opzioni terapeutiche per i pazienti con danni al midollo spinale.
Letteratura:
- Gupta A, Taly AB, et al: Lesioni midollari non traumatiche: epidemiologia, complicazioni, esito neurologico e funzionale della riabilitazione. Midollo spinale 2009; 47(4): 307-311.
- Wyndaele M, Wyndaele JJ: Incidenza, prevalenza ed epidemiologia delle lesioni al midollo spinale: cosa ci insegna un’indagine mondiale della letteratura? Midollo spinale 2006; 44(9): 523-529.
- McKinley W, Santos K, et al: Incidenza ed esiti delle sindromi cliniche da lesione del midollo spinale. J Spinal Cord Med 2007; 30(3): 215-224.
- Simpson LA, Eng JJ, et al: Spinal Cord Injury Rehabilitation Evidence Scire Research T. Le priorità di salute e di vita delle persone con lesioni al midollo spinale: una revisione sistematica. J Neurotrauma 2012; 29(8): 1548-1555.
- Bunge RP, Puckett WR, et al: Osservazioni sulla patologia delle lesioni del midollo spinale umano. Revisione e classificazione di 22 nuovi casi, con dettagli di un caso di compressione cronica del midollo con demielinizzazione focale estesa. Adv Neurol 1993; 59: 75-89.
- Norenberg MD, Smith J, Marcillo A: La patologia delle lesioni del midollo spinale umano: definire i problemi. J Neurotrauma 2004; 21(4): 429-440.
- Bartus K, Galino J, et al. La neuregulina-1 controlla un meccanismo di riparazione endogeno dopo una lesione del midollo spinale. Brain 2016; 139(Pt 5): 1394-1416.
- Filli L, Schwab ME: La riorganizzazione strutturale e funzionale delle connessioni propriospinali promuove il recupero funzionale dopo una lesione del midollo spinale. Neural Regen Res 2015; 10(4): 509-513.
- Murray KC, Nakae A, et al: Il recupero dei motoneuroni e della funzione locomotoria dopo una lesione del midollo spinale dipende dall’attività costitutiva dei recettori 5-HT2C. Nat Med 2010; 16(6): 694-700.
- Asboth L, Friedli L, et al: La riorganizzazione del circuito cortico-reticolo-spinale consente il recupero funzionale dopo una grave contusione del midollo spinale. Nat Neurosci 2018; 21(4): 576-588.
- Wahl AS, Buchler U, et al: La stimolazione optogenetica del tratto corticospinale intatto del ratto dopo un ictus ripristina il controllo motorio attraverso la formazione di circuiti funzionali regionalizzati. Nat Commun 2017; 8(1): 1187.
- Zorner B, Bachmann LC, Filli L, et al: Inseguendo la centrale plasticità del sistema nervoso: il contributo del tronco encefalico al recupero locomotorio nei ratti con lesioni del midollo spinale. Brain 2014; 137(Pt 6): 1716-1732.
- Filli L, Engmann AK, Zorner B, et al.: Colmare il divario: una deviazione reticolo-propriospinale che bypassa una lesione midollare incompleta. J Neurosci 2014; 34(40): 13399-13410.
- Raineteau O, Schwab ME: Plasticità dei sistemi motori dopo una lesione incompleta del midollo spinale. Nat Rev Neurosci 2001; 2(4): 263-273.
- Harvey LA, Glinsky JV, Bowden JL: L’efficacia di 22 interventi di fisioterapia comunemente somministrati alle persone con lesione al midollo spinale: una revisione sistematica. Midollo spinale 2016; 54(11): 914-923.
- Barriere G, Leblond H, et al: Ruolo preminente del generatore centrale di schemi spinali nel recupero della locomozione dopo lesioni parziali del midollo spinale. J Neurosci 2008; 28(15): 3976-3987.
- Maier IC, Schwab ME: Germinazione, rigenerazione e formazione di circuiti nel midollo spinale leso: fattori e attività. Philos Trans R Soc Lond B Biol Sci 2006; 361(1473): 1611-1634.
- Caporale N, Dan Y: Plasticità dipendente dalla tempistica degli spike: una regola di apprendimento Hebbian. Annu Rev Neurosci 2008; 31: 25-46.
- Yang JF, Musselman KE: L’allenamento per raggiungere la deambulazione sopra il suolo dopo una lesione al midollo spinale: una revisione di chi, cosa, quando e come. J Spinal Cord Med 2012; 35(5): 293-304.
- Alcobendas-Maestro M, Esclarin-Ruz A, et al: Allenamento robotico assistito con Lokomat rispetto all’allenamento a terra entro 3-6 mesi dalla lesione midollare incompleta: studio randomizzato controllato. Neurorehabil Neural Repair 2012; 26(9): 1058-1063.
- Fleerkotte BM, Koopman B, et al.: L’effetto dell’addestramento al cammino robotizzato controllato dall’impedenza sulla capacità e sulla qualità della camminata in persone con lesione midollare cronica incompleta: uno studio esplorativo. J Neuroeng Rehabil 2014; 11: 26.
- Villiger M, Liviero J et al: L’allenamento di realtà virtuale aumentata a domicilio migliora la forza muscolare degli arti inferiori, l’equilibrio e la mobilità funzionale dopo una lesione midollare cronica incompleta. Front Neurol 2017; 8: 635.
- Zimmerli L, Jacky M, et al: Aumentare il coinvolgimento del paziente durante la riabilitazione motoria basata sulla realtà virtuale. Arch Phys Med Rehabil 2013; 94(9): 1737-1746.
- Mignardot JB, Le Goff CG, et al.: Un algoritmo di assistenza gravitazionale multidirezionale che migliora il controllo locomotorio nei pazienti con ictus o lesioni del midollo spinale. Sci Transl Med 2017; 9(399).
- Biffi E, Beretta E, Cesareo A, et al: Una piattaforma di realtà virtuale immersiva per migliorare la capacità di camminare dei bambini con lesioni cerebrali acquisite. Methods Inf Med 2017; 56(2): 119-126.
- Harkema S, Gerasimenko Y, et al: Effetto della stimolazione epidurale del midollo spinale lombosacrale sul movimento volontario, sulla posizione eretta e sulla deambulazione assistita dopo una paraplegia completa motoria: un caso di studio. Lancet 2011; 377(9781): 1938-1947.
- Gerasimenko YP, Lu DC, et al: Riattivazione non invasiva del controllo motorio discendente dopo la paralisi. J Neurotrauma 2015; 32(24): 1968-1980.
- Freund P, Schmidlin E, et al.: Il trattamento con anticorpi specifici per il Nogo-A migliora la germinazione e il recupero funzionale dopo una lesione cervicale nei primati adulti. Nat Med 2006; 12(7): 790-792.
- Keirstead HS, Nistor G, et al: Trapianti di cellule progenitrici oligodendrocitarie derivate da cellule staminali embrionali umane per la rimielinizzazione e il ripristino della locomozione dopo una lesione del midollo spinale. J Neurosci 2005; 25(19): 4694-4705.
- Lu P, Woodruff G, Wang Y, et al: Crescita assonale a lunga distanza da cellule staminali pluripotenti indotte umane dopo una lesione del midollo spinale. Neuron 2014; 83(4): 789-796.
- Mothe AJ, Tator CH: I progressi nella terapia con cellule staminali per le lesioni del midollo spinale. J Clin Invest 2012; 122(11): 3824-3834.
InFo NEUROLOGIA & PSICHIATRIA 2018; 16(3): 11-15.