Il primo passo nella prescrizione della terapia inalatoria è la scelta ottimale del dispositivo. Questo deve basarsi sui fattori del paziente (capacità di collaborare, flusso inspiratorio raggiungibile e gravità dell’ostruzione) e sulla conoscenza delle condizioni fisico-tecniche del dispositivo. È importante una buona istruzione e una revisione periodica della terapia inalatoria. Nella BPCO (broncopneumopatia cronica ostruttiva) con ostruzione da moderata a grave, la prima scelta per la terapia inalatoria è un preparato combinato LAMA/LABA, che porta a un miglioramento funzionale e a una riduzione del tasso di esacerbazioni. Gli steroidi topici devono essere presi in considerazione solo in caso di chiara indicazione (componente asmatica) o di risultati insoddisfacenti con LAMA/LABA con FEV1 <50% sotto forma di tripla terapia. La terapia di base per l’asma bronchiale è una combinazione di ICS/LABA con dosi di ICS adattate ai sintomi. Con Symbicort, è possibile anche una terapia secondo il principio SMART (“Symbicort Maintenance and Reliever Therapy”).
Per molto tempo, erano disponibili solo pochi farmaci per il trattamento dell’asma bronchiale e della BPCO, ma in pochi anni il numero di sostanze, combinazioni e forme di dosaggio è aumentato enormemente. Soprattutto nel trattamento della BPCO, gli sviluppi sono stati così rapidi che è difficile per i non specialisti avere una panoramica aggiornata.
Siamo abituati a pensare alla scelta del farmaco, al dosaggio e agli intervalli di somministrazione, nonché alle possibili interazioni. Con la terapia inalatoria, si deve scegliere anche la forma di somministrazione ottimale. È noto che l’aderenza alle terapie inalatorie è spesso scarsa; spesso si commettono errori di applicazione, per cui il trattamento non è efficace [1]. Questa circostanza deve essere presa in considerazione quando si sceglie una terapia.
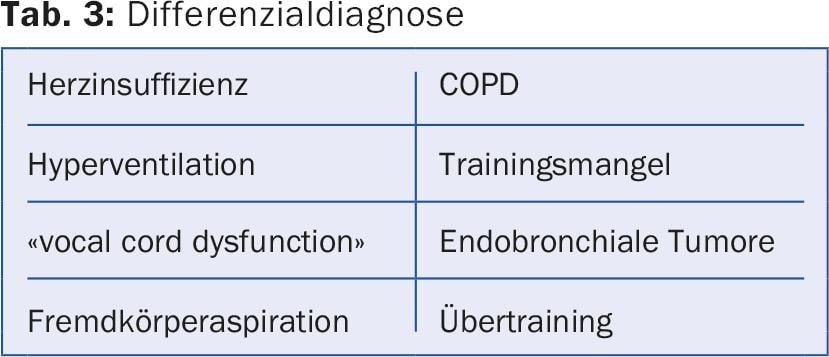
Influenza dei fattori dipendenti dalla particella e dal paziente
La deposizione di un aerosol nelle vie aeree e delle particelle di un inalatore di polvere dipende dalla dimensione delle particelle (“Diametro Aerodinamico Mediano di Massa” [MMAD]) e dal flusso inspiratorio. Le particelle con un MMAD di >5 μm raggiungono solo le vie aeree centrali e non, come desiderato, le vie aeree periferiche. Le particelle con una MMAD di 1-5 μm, la cosiddetta “frazione di particelle fini” (FPF), entrano nelle vie aeree medie e piccole – come desiderato per la terapia con broncodilatatori o steroidi topici – e si depositano qui per sedimentazione. Le particelle molto piccole con un MMAD di <1 μm raggiungono gli alveoli per diffusione o vengono espirate nuovamente (fig. 1). Per garantire una buona sedimentazione delle particelle, il respiro deve essere trattenuto per 5-10 sec al termine dell’inalazione. essere fermato. Per ottimizzare la deposizione di un aerosol a dose dosata (DA) con o senza camera a monte, l’adulto deve essere trattato nell’arco di 4-5 sec. essere inalato. Questo garantisce una portata ottimale di circa 30 l/min. Con un inalatore in polvere, inali il più profondamente e con forza possibile per generare un FPF sufficiente. All’interno del dispositivo deve essere creato un flusso turbolento, che disaggrega le particelle e genera le particelle fini desiderate [2,3]. Inoltre, la presenza di una malattia polmonare influenza il deposito di aerosol. In caso di grave disturbo ostruttivo della ventilazione o di “intasamento di muco”, si deposita un numero significativamente inferiore di particelle a livello periferico. I broncodilatatori sviluppano il loro effetto maggiore nelle vie aeree medie (le cosiddette “vie aeree conduttrici”), mentre i corticosteroidi sono probabilmente meglio distribuiti in modo uniforme alla periferia, poiché i cambiamenti infiammatori si manifestano nelle vie aeree più piccole.
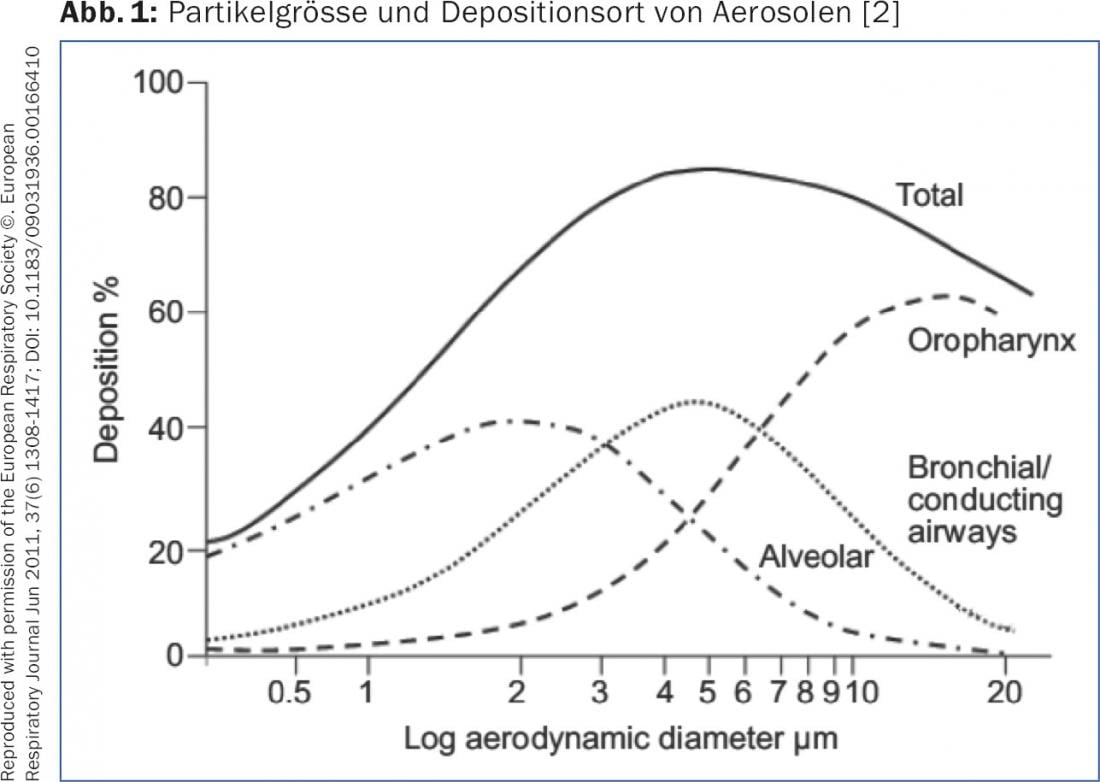
Affinché la terapia inalatoria sia efficace, non solo deve essere eseguita regolarmente, ma anche tecnicamente corretta. Diversi studi hanno dimostrato che solo il 30% circa dei pazienti utilizza l’inalatore MDI o in polvere in modo ottimale, un altro 40% circa lo utilizza in modo accettabile, ma circa il 30% lo utilizza con una tecnica inadeguata [4,5]. Una buona istruzione e il monitoraggio regolare della tecnica di inalazione sono fattori essenziali per il successo della terapia inalatoria. I pazienti anziani, in particolare, spesso non usano correttamente i loro inalatori, nonostante le buone istruzioni. La scelta della terapia inalatoria deve quindi basarsi anche sulle capacità del paziente. Se possibile, non devono essere prescritti contemporaneamente sistemi diversi. La prescrizione di preparati combinati è utile per semplificare la terapia. Una volta che il paziente ha imparato a usare un inalatore, non deve passare a un altro senza una buona ragione.
Sono disponibili dispositivi per l’inalazione
Inalatori a dosaggio dosato (DA): i DA sono stati la via di somministrazione più popolare sin dagli anni ’50. Il contenitore è sotto pressione, il farmaco e il propellente sono in forma liquida. Il clorofluorocarburo (CFC) precedentemente utilizzato come propellente è stato sostituito da idrofluoroalcani (HFA) in tutti i DA dopo il divieto. Rispetto al precedente CFC-DA, la velocità di scarico dell’HFA-DA è leggermente inferiore, la sensazione di freddo (il cosiddetto effetto Freon) è leggermente minore. La velocità di scarico e l’effetto di raffreddamento possono essere ulteriormente ridotti aggiungendo un po’ di alcol, come nel caso di Foradil®, Alvesco® e Qvar®. La maggior parte dei DA sono disponibili in forma di dispersione e devono essere agitati prima dell’uso. Fanno eccezione gli steroidi topici Alvesco® (ciclesonide) e Qvar® (beclometasone diproprionato), dove il farmaco è dissolto nel propellente. Queste DA producono particelle significativamente più piccole di soli 1,2 μm MMAD (“Particelle Extra-Fini”) con una migliore deposizione periferica a una velocità di uscita significativamente inferiore. Per il primo utilizzo e per il mancato utilizzo per diversi giorni, tutti i DA devono essere preparati spruzzando due colpi nell’ambiente. I DA convenzionali devono essere utilizzati con una camera a monte per superare il problema dell’alta velocità di uscita e del difficile coordinamento. Il deposito polmonare può quindi essere aumentato dal 15 a circa il 40%. I DA con farmaco disciolto raggiungono un ottimo deposito, fino al 60%, anche senza una camera a monte. Per ridurre al minimo i problemi di coordinamento, si raccomanda comunque spesso l’uso di una camera a monte. Le precedenti camere di interconnessione di grandi dimensioni sono scomparse; oggi si utilizzano solo camere di interconnessione più piccole e antistatiche, come Aerochamber plus® o Vortex®. Ventolin DA come farmaco d’emergenza per il viaggio può essere utilizzato anche senza precamera come compromesso, ma non nello studio o nel reparto d’emergenza come per testare la reversibilità nella spirometria.
Inalatori a polvere secca ( [DPI]): Negli ultimi anni sono stati introdotti diversi nuovi DPI. Tutti richiedono un flusso di ispirazione diverso da prodotto a prodotto per generare le particelle [6]. Tuttavia, questo valore è sempre più alto rispetto a quello di una DA. La maggior parte dei pazienti è in grado di generare un flusso di ispirazione sufficiente. Nell’iperinflazione grave, la capacità di fornire un volume inspiratorio sufficiente per inalare l’intera quantità di farmaco è un problema maggiore. Questo può essere compensato con i sistemi a capsule, inspirando due volte. Inoltre, i DPI si differenziano per la loro resistenza all’inalazione. Sebbene una resistenza elevata renda difficile ottenere un flusso elevato, la velocità di inalazione inferiore che ne deriva porta ad un deposito più omogeneo. I sistemi di capsule Handyhaler® (per Spiriva) e Breezhaler® (per Onbrez®, Seebri®, Ultibro®) sono piccoli e maneggevoli, ma l’inserimento delle capsule richiede una certa abilità. Il paziente deve essere informato del fatto che le capsule – se inserite correttamente – sviluppano un suono vibrante quando vengono inalate. Un vantaggio di questi sistemi è che è possibile verificare se il paziente ha inalato l’intera quantità di farmaco (capsule aperte con l’Handyhaler®, capsule trasparenti con il Breezhaler®). Oltre ai sistemi a capsule, sono disponibili diversi DPI multidose. Il Turbuhaler® (per Symbicort®, Pulmicort®, Bricanyl) è stato consolidato per anni, è pratico e semplice, ma è un po’ soggetto a errori di manipolazione, soprattutto nei pazienti più anziani. In Svizzera sarà presto disponibile Turbu+®, un accessorio elettronico basato su app che si collega al Turbuhaler e consente di documentare la terapia inalatoria senza soluzione di continuità tramite uno smartphone. L’intuitivo Discus® (per Serevent®, Axotide®, Seretide®) probabilmente verrà sempre più soppiantato dall’Ellipta® (per Anoro®, Relvar®, Incruse®, Arnuity®), ancora più facile da usare, che viene caricato automaticamente all’apertura del tappo. Il Gennuair® (per Eklira®) è l’unico DPI che garantisce un flusso inspiratorio sufficiente, in quanto il dispositivo rilascia la dose solo quando viene raggiunto un flusso inspiratorio sufficiente. I DPI raggiungono un deposito polmonare soddisfacente di circa il 30%.
Inalatore Soft Mist: il sistema di inalazione Soft Mist Respimat® (per Spiolto®, Striverdi® e presto anche Spiriva®), un pratico inalatore multidose, è da poco disponibile in Svizzera. Con l’aiuto di un meccanismo a molla, la soluzione farmacologica viene premuta attraverso due ugelli in silicone e viene prodotto un aerosol molto fine. Questo è caratterizzato da una bassa velocità di scarico e da una nuvola di spruzzo molto stabile (fino a 1,5 sec.). Non è necessario un gas propellente. Il Respimat® consente un’inalazione relativamente lenta e richiede meno coordinazione rispetto alla DA abituale. A differenza del DPI, la dimensione delle particelle è indipendente dal flusso di inspirazione. Si ottiene un ottimo deposito polmonare del 40-50% della dose rilasciata.
Inalazione umida: l’uso di un dispositivo di nebulizzazione oggi dovrebbe essere limitato a casi individuali, se non è possibile ottenere un risultato soddisfacente con i dispositivi sopra elencati, e a situazioni di emergenza nella BPCO e nell’asma. La dimensione delle particelle è determinata dalla testa del nebulizzatore e dal flusso applicato. Si devono combinare solo le teste dei nebulizzatori e i compressori che sono stati convalidati. Quando si utilizza l’aria compressa da una connessione a parete, la portata ottimale per la testata del nebulizzatore (di solito 6-8 l/min.) deve essere osservato. I nebulizzatori con un sistema di valvole che impedisce la perdita di aerosol nell’ambiente (ad esempio, Pari LC Plus) aumentano la dose di farmaco disponibile. Quando possibile, gli adulti dovrebbero inalare con un boccaglio piuttosto che con una maschera facciale, per evitare la funzione filtrante indesiderata del naso. Per l’inalazione umida, solo i broncodilatatori a breve durata d’azione e uno steroide topico (Pulmicort® Respules) sono disponibili.
Scelta del farmaco
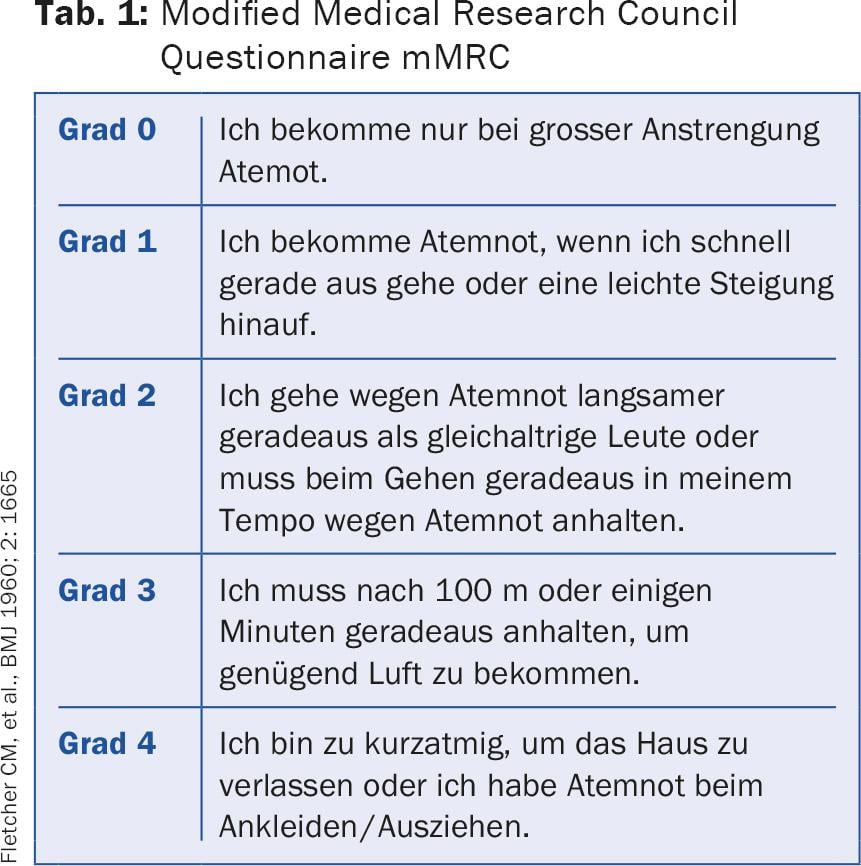
BPCO: l’obiettivo della terapia per la BPCO è migliorare la funzione polmonare, ma soprattutto le prestazioni fisiche e la qualità della vita. Anche la riduzione del tasso di esacerbazione è essenziale. Le esacerbazioni della BPCO sono un fattore prognostico sfavorevole [7]. Sono la causa di costose ospedalizzazioni, sono molto stressanti per i pazienti e compromettono in modo massiccio la loro qualità di vita. Per questo motivo, le attuali raccomandazioni terapeutiche non si basano più solo sulla gravità dell’ostruzione, ma su una classificazione multidimensionale della BPCO, che si basa sulla gravità dell’ostruzione, sulla dispnea, misurata con il semplice “Questionario modificato del Medical Research Council” (mMRC). (Tab. 1) o il test di valutazione della BPCO (CAT), che utilizza otto domande per valutare i sintomi della malattia [8]. Il test dà come risultato un punteggio da 0 a 40. Il questionario CAT è disponibile in molte lingue e può essere consultato online [9]. Il terzo fattore determinante è la frequenza delle esacerbazioni: fino a una esacerbazione/anno senza ricovero è tollerabile, mentre i pazienti con ≥2 esacerbazioni o un ricovero sono considerati in trattamento insoddisfacente. In base a questi fattori, i pazienti con BPCO possono essere suddivisi in quattro gruppi (A-D), sui quali si basa la terapia (Fig. 2).
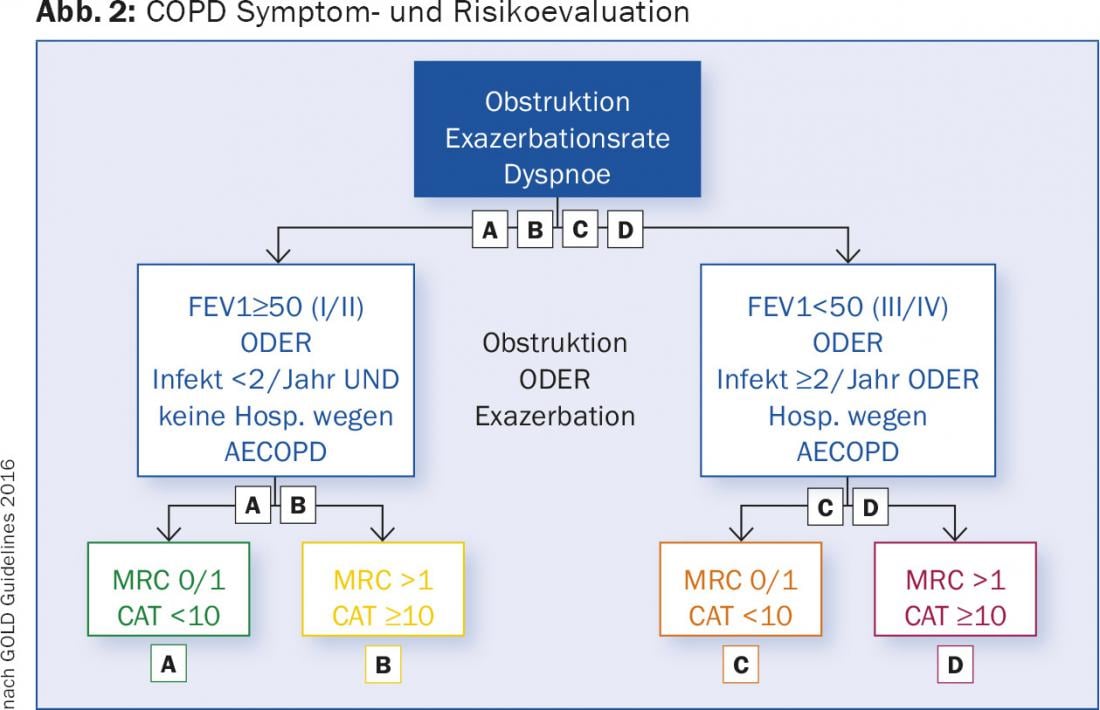
Le linee guida per il trattamento sono presentate sia in modo dettagliato che in forma sintetica sulla homepage dell'”Iniziativa Globale per le Malattie Polmonari Ostruttive” [10]. Vengono utilizzate le seguenti classi di farmaci: betamimetici a breve durata d’azione (SABA), betamimetici a lunga durata d’azione (LABA), antimuscarinici a lunga durata d’azione (LAMA) e steroidi topici (ICS) (Tab. 2 e 3).
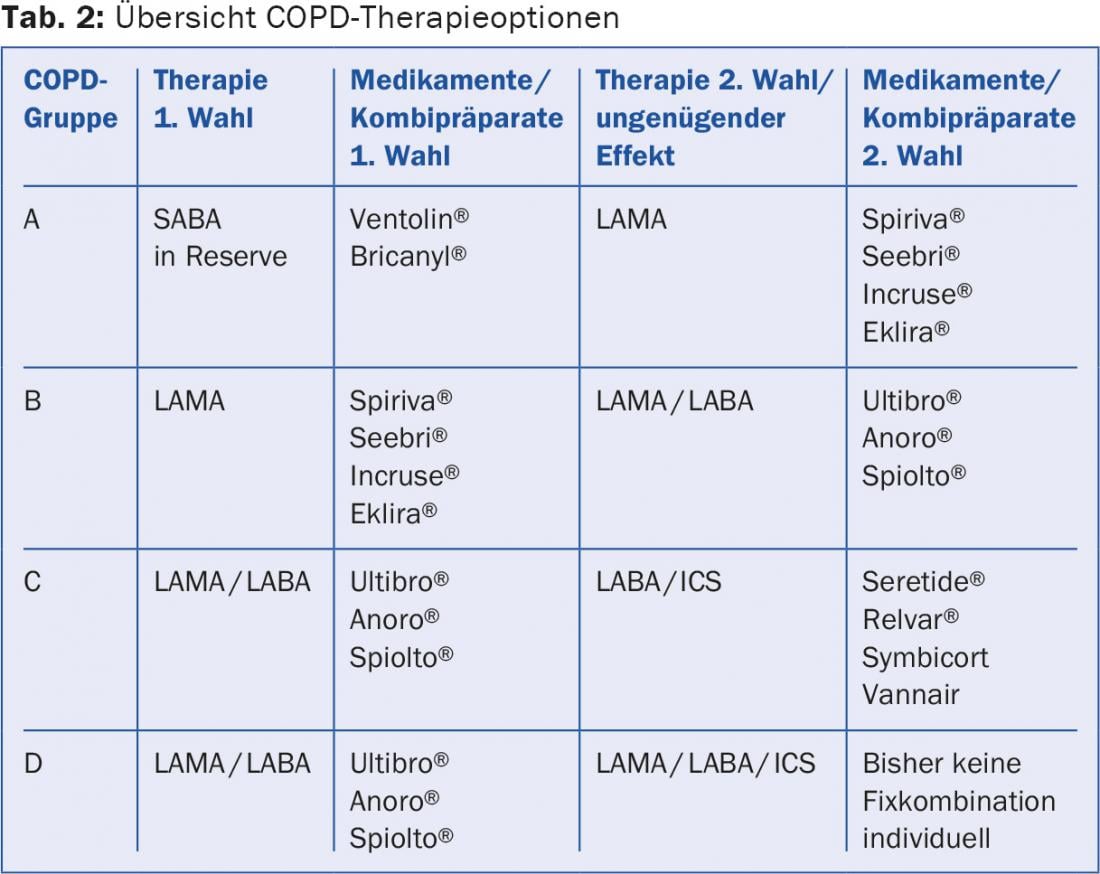
Tutti i pazienti sintomatici devono ricevere un betamimetico a breve durata d’azione (SABA) come farmaco di emergenza. Questo è sufficiente per i pazienti del gruppo A. I pazienti più sintomatici con ostruzione moderata e senza esacerbazioni frequenti (gruppo B) ricevono un LAMA come prima scelta. Se l’effetto è insufficiente o il paziente è molto sintomatico, si utilizza direttamente un preparato combinato LAMA/LABA. Numerosi studi hanno dimostrato che la combinazione di LAMA/LABA è superiore alla monoterapia e alla terapia combinata LABA/ICS in termini di miglioramento della funzione polmonare, della capacità di esercizio e della qualità della vita [11].
L’importanza dell’ICS è chiaramente diminuita negli ultimi anni. In ogni caso, il loro utilizzo è discusso solo in caso di un FEV1 <50 (-60)% dell’obiettivo e di frequenti esacerbazioni. Tutti gli studi di grandi dimensioni con ICS hanno dovuto riportare un tasso di polmonite leggermente aumentato come effetto negativo. Nei pazienti dei gruppi C e D, la riduzione del tasso di esacerbazione è un obiettivo terapeutico importante. La combinazione LABA/ICS può ridurre il tasso di esacerbazione al costo di polmoniti leggermente più frequenti [12]. Ma non solo gli steroidi, anche LAMA e LABA hanno un’influenza favorevole sul numero di esacerbazioni. In un confronto diretto, è stato dimostrato che la combinazione LAMA/LABA (Ultibro®) non solo era equivalente, ma addirittura superiore alla combinazione LABA/ICS (Seretide®) in termini di tasso di esacerbazione [13]. Ciò significa che una combinazione di LAMA/LABA è raccomandata come prima scelta per entrambi i gruppi 3 e 4. L’ICS è indicato se ci sono chiari aspetti di asma bronchiale aggiuntivo (alto grado di reversibilità dell’ostruzione, storia di asma, eosinofilia), una cosiddetta “sindrome di sovrapposizione asma-BPD” (ACOS) o se un broncodilatatore è intollerante. Anche i pazienti con un leggero aumento degli eosinofili nel sangue (>200 o 300/ μl) possono beneficiare della SCI. Nei pazienti del gruppo D gravemente sintomatici, può essere presa in considerazione la tripla terapia LAMA/LABA/ICS, oltre naturalmente alle misure terapeutiche non inalatorie. Mancano in gran parte confronti diretti all’interno delle classi di sostanze, per cui non è possibile formulare preferenze chiare.
Asma bronchiale: A differenza del trattamento della BPCO, il trattamento dell’asma bronchiale non è cambiato in modo significativo negli ultimi anni. L’obiettivo della terapia è quello di ottenere un controllo ottimale dei sintomi, una funzione polmonare il più possibile normale e di evitare le esacerbazioni [14,15]. Un questionario come l'”Asthma-Control Test” (ACT) [16,17] si è dimostrato utile per valutare il controllo dei sintomi.
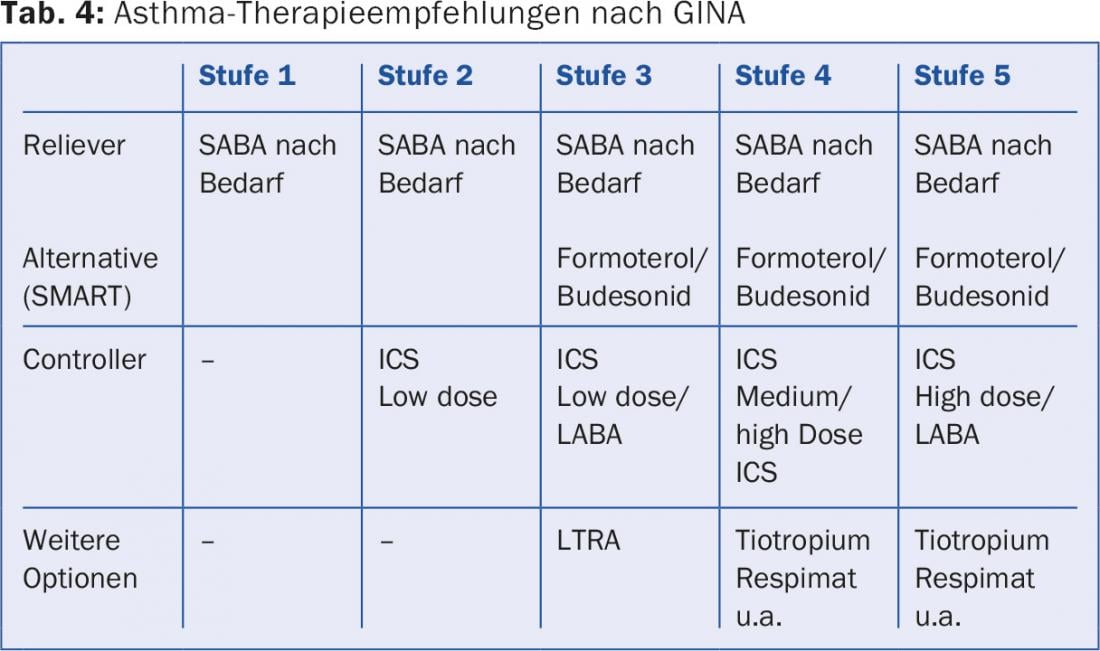
Tutti gli asmatici ricevono un SABA come farmaco d’emergenza (“antidolorifico”). Se non è necessario più di 2 volte alla settimana e gli obiettivi terapeutici sono raggiunti (livello GINA 1), non sono necessari altri farmaci. Se questo non è il caso, gli ICS a basso dosaggio (livello GINA) vengono utilizzati come controllori per il momento. 2) o, in caso di sintomi gravi, come combinazione ICS/LABA (livello GINA 3) con aumento della dose di ICS in caso di effetto insufficiente (livello GINA 4). Dal punto di vista tattico, di solito è più intelligente iniziare con una terapia intensiva per ottenere rapidamente un buon controllo dell’asma e poi ridurre l’intensità della terapia: prima ridurre la dose di ICS e poi omettere il LABA (“step-up/step-down”). Una pratica di prescrizione alternativa dalla fase 3 è il cosiddetto principio SMART (“Symbicort Maintenance and Reliever Therapy”), che è possibile solo con un LABA a rapida insorgenza d’azione come Symbicort® (formoterolo/budesonide). Viene prescritta una dose base relativamente bassa (Symbicort TH 200/6 2×1), con l’istruzione di inalare Symbicort aggiuntivo secondo necessità. In questo modo, la dose di ICS viene regolata automaticamente in base alle esigenze attuali e un controllo identico dell’asma è possibile con una dose di steroidi per lo più moderata. La nuova preparazione combinata Relvar® (fluticasone furoato/vilanterolo) consente il dosaggio singolo. Spiriva®, precedentemente valutato solo per la BPCO, applicato con Respimat®, può essere aggiunto come ulteriore opzione inalatoria (off label) se il controllo dell’asma con LABA/ICS è insufficiente [18] (tab. 4).
Letteratura:
- Braido F, et al: “Provare, ma fallire” – Il ruolo della tecnica di inalazione e del modo di somministrazione nell’aderenza ai farmaci respiratori. J Allerg Clin Immunol Pract 2016; 4: 823-832.
- Laube BL, et al: Cosa deve sapere lo specialista polmonare sulle nuove terapie inalatorie. Eur Respir J 2011; 37: 1308-1331.
- Rothe T: Terapia inalatoria – Parte 1: Fisica e sistemi. Switzerland Med Forum 2014; 14: 402-406.
- Crompton GK, et al: La necessità di migliorare la tecnica di inalazione in Europa: un rapporto del Team per il miglioramento della gestione dei farmaci aerosol. Respir Med 2006; 100: 1479-1494.
- Sanchis J, et al: Revisione sistematica degli errori nell’uso degli inalatori. La tecnica del paziente è migliorata nel tempo? PETTO 2016; 150(2): 394-406.
- Haidl P, et al: Requisiti dei dispositivi di inalazione per le manovre di inalazione del paziente. Medicina respiratoria 2016; 118: 65-75.
- Soler-Cataluna JJ, et al: Esacerbazioni acute gravi e mortalità nei pazienti con broncopneumopatia cronica ostruttiva. Thorax 2005; 60: 925-931.
- Jones PW: Test di valutazione della BPCO – razionale, sviluppo, validazione e prestazioni. J COPD 2013; 10(2): 269-271.
- www.catestonline.org
- www.goldcopd.org
- Vogelmeier CF, et al: Efficacia e sicurezza di QVA149 una volta al giorno rispetto a salmeterolo-fluticasone due volte al giorno nei pazienti con broncopneumopatia cronica ostruttiva (ILLUMINATE): uno studio randomizzato, in doppio cieco, a gruppi paralleli. Lancet Respir Med 2013; 1: 51-60.
- Calverley PMA, et al: Salmeterolo e Fluticasone Propionato e sopravvivenza nella broncopneumopatia cronica ostruttiva. N Engl J Med 2007; 356: 775-789.
- Wedzicha JA, et al: Indacaterolo-glicopirronio rispetto a salmeterolo-fluticasone per la BPCO. N Engl J Med 2016; 374: 2222-2234.
- www.ginasthma.org
- Reddel HK, et al: Una sintesi della strategia nex GINA: una tabella di marcia per il controllo dell’asma. Eur Respi J 2015; 46: 622-639.
- Schatz M, et al.: Test di controllo dell’asma: affidabilità, validità e reattività in pazienti non seguiti in precedenza da specialisti dell’asma. J Allergy Clin Immunol 2006; 117: 549-556.
- www.asthmacontroltest.com/Europe/Switzerland/German
- Rodrigo GJ, et al: Qual è il ruolo del tiotropio nell’asma?: una revisione sistematica con meta-analisi. Chest 2015; 147: 388-396.
PRATICA GP 2016; 11(11): 24-30











