Nonostante il noto sviluppo demografico, attualmente sappiamo troppo poco riguardo ai pazienti anziani o addirittura molto anziani, se e come possiamo adattare e personalizzare la radioterapia (RT), soprattutto se fa parte di un concetto di terapia multimodale. Uno screening come il G8 può essere utile per rilevare la maggiore “vulnerabilità” di un paziente anziano in una fase iniziale. La collaborazione interdisciplinare e lo stretto coinvolgimento del paziente e della sua famiglia nei processi decisionali sono alla base dei concetti di terapia sostenibile. I nuovi sviluppi tecnici nella radio-oncologia aprono ottime opzioni, soprattutto per il gruppo di pazienti anziani e con comorbidità rilevanti, in modo da poter perseguire anche approcci curativi.
Il fenomeno dell’invecchiamento della popolazione si osserva in tutti i Paesi sviluppati: In Svizzera, l’aspettativa di vita media è aumentata di 5,1 anni a 85,2 anni per le donne e di ben 7,6 anni a 81,0 anni per gli uomini tra il 1984 e il 2014. Poiché l’incidenza di molte entità tumorali aumenta con l’età, dobbiamo presumere che in futuro assisteremo a un numero assoluto più elevato di casi di cancro. Negli Stati Uniti, si prevede che il numero di casi di cancro aumenterà del 45% tra il 2010 e il 2030, e questo aumento riguarderà quasi esclusivamente il gruppo di età >65 anni [1]. Ci sono differenze tra i sessi: Per gli uomini, il tasso di malattia nella fascia di età designata in Svizzera è descritto come quasi doppio rispetto alle donne, mentre la situazione è esattamente opposta per i pazienti di <55 anni [2].
Le valutazioni sono utili?
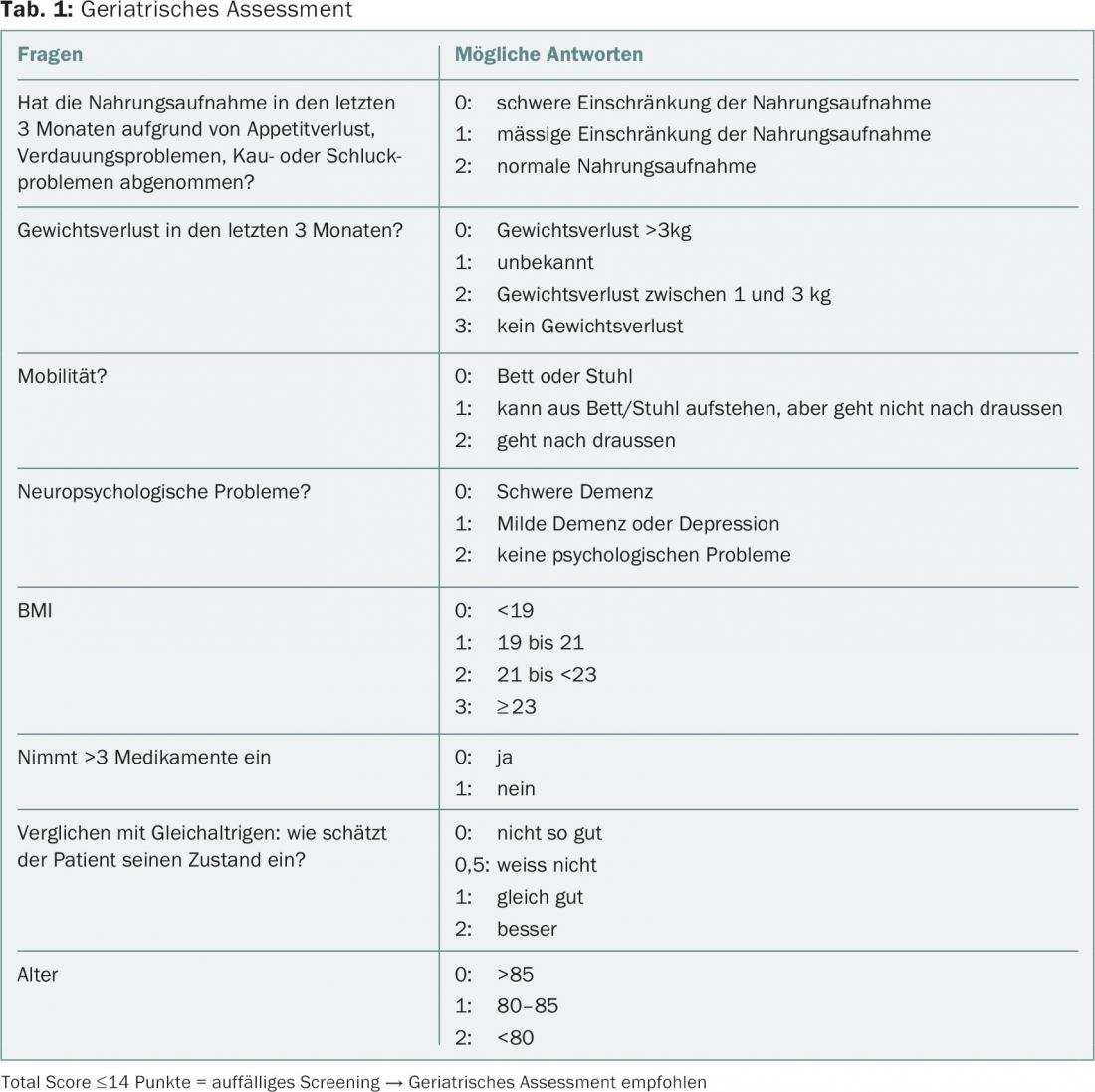
La questione di quando un paziente è un paziente anziano non è ancora stata definita in modo vincolante. I geriatri in genere scelgono il limite di età di 70 anni perché si presume che le persone di questa età abbiano in media una maggiore vulnerabilità. Tuttavia, sappiamo che l’età biologica di una persona può differire in modo significativo dall’età cronologica. Uno studio dello scorso anno ha mostrato una variazione dell’età biologica da 28 a 61 anni nei 38enni [3]. Spesso, quindi, non è facile decidere se un paziente “anziano” debba essere considerato individualmente a rischio maggiore di effetti collaterali rilevanti dovuti alla terapia oncologica. Le valutazioni geriatriche possono aiutare a raccogliere parametri oggettivi e rilevanti sulla funzione e sulla cognizione, ma richiedono molto tempo e quindi non sono adatte all’uso non specifico nella pratica clinica quotidiana per tutti i pazienti in una fascia d’età definita. La Società Internazionale di Oncologia Geriatrica (SIOG) raccomanda pertanto l’uso di strumenti di screening, oltre alla registrazione del performance status e delle co-morbilità, che possono dare indicazioni sul fatto che un paziente possa beneficiare di una valutazione dettagliata. Grazie alla sua elevata sensibilità nel rilevare la fragilità, il G8 (Tab. 1) ha una priorità leggermente superiore rispetto ad altre valutazioni brevi [4].
E le prove?
Un altro problema relativo alle decisioni terapeutiche nei pazienti anziani è la mancanza di prove, perché gli studi di solito escludono sistematicamente questi pazienti. Uno studio del 2015 ha dimostrato che nel 47% di tutti i pazienti di una clinica di radio-oncologia di Seattle, le decisioni sul trattamento dovevano essere prese senza prove di livello I basate su studi randomizzati [5]. L’applicabilità diretta dei risultati di studi generati in popolazioni più giovani a una popolazione di pazienti anziani non è possibile per molte ragioni. Per numerose entità tumorali, è stato possibile dimostrare che l’età dei pazienti e le comorbidità concomitanti hanno un’influenza: 1) la prognosi di sopravvivenza e il decorso naturale della malattia; 2) la tollerabilità della radioterapia o del trattamento multimodale in termini di qualità di vita, morbilità e mortalità; 3) l’efficacia della radioterapia e della terapia multimodale in termini di sopravvivenza e di assenza di recidiva; 4) l’indicazione di noi oncologi e radio-oncologi [9 –11]. Di seguito, per le quattro malattie tumorali più comuni, vengono forniti esempi di come l’età giochi un ruolo nelle attuali decisioni cliniche.
Carcinoma mammario
Nel carcinoma mammario, la radioterapia della mammella rimanente, compresa la saturazione locale del letto tumorale (boost), riduce significativamente il tasso di recidiva locale, indipendentemente dall’età, sebbene anche il rischio assoluto di recidiva locale diminuisca con l’aumentare dell’età. Pertanto, con l’aumento dell’età e dei parametri favorevoli di prognosi del tumore (ad esempio, dimensioni del tumore, grading), l’influenza del controllo locale e quindi della radioterapia locale sulla sopravvivenza si riduce. Pertanto, le radiazioni dovrebbero essere esaminate criticamente nei pazienti anziani senza fattori di rischio specifici per il tumore e malattie concomitanti rilevanti allo stesso tempo. La radioterapia dovrebbe essere ipo-frazionata in sole 20 sessioni di trattamento, anziché 25. Allo stesso modo, nei pazienti anziani senza fattori di rischio, si può rinunciare alla saturazione del letto tumorale. Un altro approccio per questo gruppo a rischio potrebbe essere l’irradiazione parziale del seno; tuttavia, i risultati a lungo termine su questa questione sono ancora in sospeso [12].
Carcinoma della prostata
I pazienti anziani con comorbilità da moderata a grave muoiono molto raramente a causa del cancro alla prostata, se questo viene rilevato senza fattori di rischio (alto valore di PSA, alto punteggio di Gleason, crescita oltre la capsula) [13]. In questo caso, ha senso una strategia di “sorveglianza attiva”. D’altra parte, le pazienti più anziane con poche comorbidità e uno stadio tumorale intermedio o ad alto rischio beneficiano della radioterapia in combinazione con una terapia ormonale (HT) a breve termine. Per la comorbilità grave, il vantaggio dell’HT nei gruppi a rischio intermedio e alto scompare [14].
Carcinoma del bronco
Nei pazienti anziani con carcinoma polmonare non a piccole cellule localmente avanzato, la RT ha un’alta priorità, poiché questi pazienti sono spesso inoperabili. La radioterapia e la chemioterapia simultanee migliorano la sopravvivenza globale, ma sono associate a un aumento significativo della tossicità acuta. In pazienti selezionati, la RT può ancora essere combinata con una chemioterapia concomitante a basso dosaggio [15]. In uno studio giapponese, l’aspettativa di vita è stata significativamente migliorata dal trattamento combinato, senza un aumento della mortalità correlata alla terapia.
Cancro rettale
Nel tumore del retto, la radioterapia preoperatoria migliora il tasso di recidiva locoregionale, indipendentemente dallo stadio del tumore e dall’età. Nei pazienti anziani con un ottimo performance status, la terapia multimodale non dovrebbe quindi essere abbandonata senza una buona ragione [16]. Tuttavia, in presenza di comorbidità rilevanti, si dovrebbe scegliere una procedura differenziata, che potrebbe consentire di rinunciare alla resezione rettale in caso di remissione clinicamente completa dopo la radio(chemio)terapia nella risonanza magnetica e nella rettoscopia. In clinica, la radiochemioterapia combinata (45-50 Gy in frazioni da 1,8 Gy in combinazione con capecitabina p.o.) viene utilizzata per i tumori localmente avanzati o, in alternativa, il regime breve composto da 5 sessioni di 5 Gy ciascuna, che dovrebbe essere preferito nei pazienti anziani con lo stesso risultato oncologico e una qualità di vita comparabile [17].
Importanza della radioterapia di precisione nei pazienti anziani
Oggi, gli sviluppi tecnici e metodologici della radio-oncologia consentono di concentrare la dose di radiazioni sul tumore, risparmiando il tessuto normale circostante. La radioterapia stereotassica nell’area del tronco corporeo (SBRT) unisce questi progressi tecnici e consente un’irradiazione tumorale altamente precisa in poche sedute di trattamento. Tale terapia è particolarmente indicata per i pazienti anziani, grazie al profilo di tossicità favorevole, alla mancanza di invasività e alla breve terapia ambulatoriale.
Nel NSCLC in stadio I, la SBRT ha già un posto fisso nelle linee guida internazionali (ESMO, NCCN) quando la resezione chirurgica del lembo non è possibile in modo sicuro a causa dell’età e delle comorbidità. La SBRT può essere utilizzata in modo sicuro ed efficace anche nei pazienti di età >80 anni: In >300 pazienti con un’età media di 79-85 anni, non si è verificata una sola tossicità di grado V indotta dalla SBRT e le tossicità di grado III-IV sono state osservate in <3% dei pazienti. L’ottima tollerabilità combinata con un elevato controllo locale del tumore ha portato a un miglioramento significativo della prognosi di questi pazienti con la SBRT, nonostante l’età avanzata o le comorbidità [18]. In un’analisi altamente pubblicata di due studi di fase III, la SBRT è stata addirittura definita come una possibile alternativa alla chirurgia nella situazione operabile. È anche significativo che questi eccellenti risultati della SBRT siano stati confermati al di fuori di studi prospettici nei Paesi di lingua tedesca su 582 pazienti [19].
Anche se un’evidenza così elevata è finora disponibile solo per il NSCLC in stadio precoce, questa esperienza può certamente essere estrapolata se la terapia locale è generalmente indicata sulla base della valutazione oncologica. Nel contesto delle cosiddette oligometastasi, la SBRT rappresenta una terapia delicata, non invasiva e localmente molto efficace, che è stata utilizzata con successo per le metastasi polmonari, epatiche, surrenali e linfonodali [20]. Ulteriori indicazioni, come la radiazione stereotassica primaria del carcinoma prostatico, i tumori primari del fegato e i piccoli carcinomi a cellule renali con inoperabilità, sono attualmente in fase di valutazione scientifica.
Letteratura:
- Smith BD, et al: Il futuro dell’incidenza del cancro negli Stati Uniti: gli oneri di una nazione che invecchia e cambia. J Clin Oncol 2009; 27(17): 2758-2765.
- Ufficio federale di statistica (UST), Istituto nazionale di epidemiologia e registrazione del cancro (NICER), Registro svizzero del cancro infantile (SCRC). Rapporto svizzero sul cancro 2015. Stato e sviluppi. Neuchâtel 2016.
- Belsky DW, et al: Quantificazione dell’invecchiamento biologico nei giovani adulti. Proc. Natl. Acad. Sci. U.S.A 2015; 112 (30): E4104-E4110.
- Decoster L, et al: Strumenti di screening per i problemi di salute multidimensionali che giustificano una valutazione geriatrica nei pazienti oncologici anziani: un aggiornamento delle raccomandazioni SIOG. Ann Oncol 2015; 26: 288-300.
- Apisarnthanarax S, et al: Applicabilità degli studi randomizzati in radioterapia alla pratica clinica standard. Cancro 2013; 119(16): 3092-3099.
- Poortmans PM, et al: Irradiazione mammaria interna e sopraclaveare mediale nel cancro al seno. N Engl J Med 2015; 373(4): 317-327.
- Whelan TJ, et al: Irradiazione nodale regionale nel cancro al seno in fase iniziale. N Engl J Med 2015; 373(4): 307-316.
- Bradley JD, et al: Radioterapia conformale a dose standard rispetto a quella ad alta dose con carboplatino concomitante e di consolidamento più paclitaxel con o senza cetuximab per i pazienti con carcinoma polmonare non a piccole cellule in stadio IIIA o IIIB (RTOG 0617): uno studio di fase 3 randomizzato, fattoriale due a due. Lancet Oncol 2015; 16(2): 187-199.
- Elomrani F, et al: Gestione del cancro al seno precoce nelle donne anziane: dallo screening al trattamento. Breast Cancer (Dove Med Press) 2015; 7: 165-171.
- Blanco R, et al: Una revisione della gestione dei pazienti anziani con carcinoma polmonare non a piccole cellule. Ann Oncol 2015; 26(3): 451-463.
- Droz JP, et al: Gestione del cancro alla prostata nei pazienti anziani: raccomandazioni aggiornate di un gruppo di lavoro della Società Internazionale di Oncologia Geriatrica. The Lancet Oncology 2014; 15(9): e404-414.
- Vaidya JS, et al: Radioterapia intraoperatoria mirata adattata al rischio rispetto alla radioterapia del seno intero per il cancro al seno: risultati a 5 anni per il controllo locale e la sopravvivenza globale dallo studio randomizzato TARGIT-A. Lancet 2014; 383(9917): 603-613.
- Daskivich TJ, et al: Sovratrattamento di uomini con cancro alla prostata a basso rischio e comorbilità significativa. Cancro 2011; 117(10): 2058-2066.
- Nguyen PL, et al: Radiazione con o senza 6 mesi di terapia di soppressione degli androgeni nel carcinoma prostatico localizzato clinicamente a rischio intermedio e alto: un’analisi postrandomizzazione per gruppo di rischio. Int J Radiat Oncol Biol Phys 2010; 77(4): 1046-1052.
- Atagi S, et al: Radioterapia toracica con o senza carboplatino giornaliero a basso dosaggio in pazienti anziani con carcinoma polmonare non a piccole cellule: uno studio randomizzato, controllato, di fase 3 del Japan Clinical Oncology Group (JCOG0301). Lancet Oncol 2012; 13(7): 671-678.
- Bhangu A, et al: Esito di sopravvivenza dei pazienti anziani operati e non operati con cancro del retto: un’analisi di Surveillance, Epidemiology, and End Results. European journal of surgical oncology : la rivista della Società Europea di Oncologia Chirurgica e dell’Associazione Britannica di Oncologia Chirurgica 2014; 40(11): 1510-1516.
- Guckenberger M, et al.: Confronto tra radioterapia preoperatoria di breve durata e radiochemioterapia di lunga durata per il cancro del retto localmente avanzato. Strahlentherapie und Onkologie : Organ der Deutschen Röntgengesellschaft [et al] 2012; 188(7): 551-557.
- Haasbeek CJ, et al: Cancro polmonare in fase iniziale nei pazienti anziani: uno studio basato sulla popolazione dei cambiamenti nei modelli di trattamento e nella sopravvivenza nei Paesi Bassi. Ann Oncol 2012; 23(10): 2743-2747.
- Guckenberger M, et al.: Sicurezza ed efficacia della radioterapia stereotassica del corpo per il carcinoma polmonare non a piccole cellule in stadio I nella pratica clinica di routine: un’analisi dei modelli di cura e degli esiti. J Thorac Oncol 2013; 8(8): 1050-1058.
- Widder J, et al: Oligometastasi polmonari: metastasectomia o radioterapia stereotassica ablativa? Radiother Oncol 2013; 107(3): 409-413.
InFo ONCOLOGIA & EMATOLOGIA 2016; 4(7-8): 6-10