Tradizionalmente, l’uretrite infettiva si divide in due gruppi: L’uretrite gonococcica (GU) e la cosiddetta uretrite non gonococcica (NGU). Questa classificazione è nata storicamente per distinguere la NGU – un gruppo di infezioni dalla sintomatologia simile con un’eziologia, all’epoca, poco chiara, eterogenea e difficile da determinare – dall’uretrite gonorroica, molto più studiata e grave. La NGU, un tempo chiamata uretrite non specifica, era relativamente rara insieme alla gonorrea, ma oggi supera di gran lunga la sua incidenza. Il seguente articolo tratta della NGU, del suo spettro patogeno, delle fasi di chiarimento necessarie e delle misure terapeutiche.
In linea di principio, quando si diagnostica l’uretrite, si deve innanzitutto escludere un’infezione del tratto urinario, che a volte può offrire difficoltà diagnostiche differenziali. Se l’uretrite con la clinica tipica dell’alguria e della fluorina con >5 Leucociti in cinque campi visivi (o >10 leucociti in cinque campi visivi nel primo flusso urinario) è confermata, bisogna distinguere tra una forma non infettiva e una infettiva (Tab. 1). Le cause tipiche di uretriti non infettive sono cause meccaniche-traumatiche, come l’inserimento di corpi estranei, i rapporti sessuali eccessivi, alcune pratiche sadomaso, nonché lo stripping ricorrente del pene per l’autocontrollo al fluoro. Anche le cause chimiche (ad esempio, disinfettanti, saponi) o locali, come le anomalie congenite, la fimosi e la neoplasia, possono essere accompagnate da uretrite non infettiva. Di seguito, tuttavia, verrà discussa solo l’uretrite infettiva.

Clamidia
La Chlamydia trachomatis comprende un totale di 15 sierotipi definiti da diversi antigeni proteici, designati dalle lettere A-C, D-K e L1-L3, che causano diverse malattie.
La C. trachomatis si trova nel 15-41% di tutti i casi di uretrite negli uomini. Tuttavia, nella letteratura degli ultimi dieci anni, la frequenza della clamidia come agente patogeno non è riportata in modo coerente. In Svizzera, si può ipotizzare una prevalenza del 3-4% per le donne tra i 16 e i 30 anni. La trasmissione avviene attraverso contatti sessuali non protetti, con l’età inferiore ai 20 anni, la promiscuità e il mancato o errato uso del preservativo come fattori di rischio. Si raccomanda uno screening annuale per le pazienti sessualmente attive di età inferiore ai 25 anni, nonché per le donne di età superiore ai 25 anni con fattori di rischio (partner multipli, nuovi partner).
L’infezione da clamidia negli uomini si nota dopo un periodo di incubazione da sette giorni a tre settimane, con perdite sierose. Inoltre, sono state segnalate una sensazione di bruciore e alguria. All’esame, a parte un discreto arrossamento dell’orifizio uretrale e l’adesione dell’orifizio uretrale, di solito non ci sono altri reperti. Nel 30-50% di tutti gli uomini infetti, l’infezione è asintomatica. Il sito più comune di infezione da clamidia nelle donne è la cervice, con un’infezione asintomatica fino al 70%. Le manifestazioni cliniche sono perdite genitali biancastre-giallastre con prurito e bruciore all’introito vaginale.
Diagnosi: nelle donne, gli agenti patogeni vengono rilevati mediante esami dello striscio della cervice o della vagina o analisi delle urine (un po’ meno sensibili) utilizzando la PCR. Negli uomini, può essere eseguito anche un esame delle urine o uno striscio dell’uretra.
A causa delle loro dimensioni ridotte e della bassa affinità per i coloranti, le clamidie non possono essere viste in modo nativo o tramite colorazione. Essendo batteri intracellulari obbligati, anche la coltivazione è difficile.
Terapia: le infezioni urogenitali non complicate possono essere trattate con doxiciclina 2×100 mg per sette giorni o azitromicina 1 g una volta. L’efficacia dei due antibiotici è quasi equivalente, con una risposta leggermente migliore della doxiciclina, ma con una migliore compliance dell’azitromicina. Come documentato di recente, i tassi di guarigione sembrano essere in calo con queste terapie standard. Sulla base dei dati attuali, l’azitromicina, come l’eritromicina, può essere considerata sicura in gravidanza. In alternativa, l’amoxicillina 3×500 mg/d può essere somministrata per sette giorni durante la gravidanza.
Micoplasma
I micoplasmi sono batteri gram-negativi immobili. Si distinguono dagli altri batteri per le dimensioni ridotte delle cellule, il genoma piccolo e la mancanza di parete cellulare. Su terreni di coltura speciali, si possono distinguere gli ureaplasmi (Ureaplasma urealyticum) e i non-ureaplasmi (Mycoplasma hominis).
L’importanza dei micoplasmi genitali per lo sviluppo delle malattie a trasmissione sessuale è controversa. M. hominis non sembra essere responsabile della NGU nei maschi, nonostante il rilevamento nel tratto urogenitale. Allo stesso modo, U. urealyticum può essere spesso isolato dal tratto genitale di donne e uomini sani, ma sono state ipotizzate possibili manifestazioni cliniche in presenza di concentrazioni batteriche elevate, con il sierotipo specifico Biovar 2 e con l’infezione iniziale. Per M. genitalium, tuttavia, il potenziale patogeno è stato documentato più volte. Le infezioni da micoplasma possono causare i sintomi clinici dell’uretrite negli uomini, oltre a corsi silenziosi. Le infezioni da U. urealyticum e M. genitalium, in particolare, si manifestano sotto forma di uretrite acuta, ma anche cronica, con disuria e fluoro. Sebbene ci siano pochi dati sull’importanza delle infezioni da M. genitalium nelle donne, i risultati di singoli studi indicano una forte associazione di M. genitalium con cervicite, endometrite acuta, ulcere genitali e forse un’infezione del tratto genitale superiore (PID).
Diagnostica: a causa delle loro dimensioni e della bassa affinità con i coloranti, non è possibile rilevare i micoplasmi nei preparati Gram. U. urealyticum e M. hominis vengono rilevati tramite coltura (o PCR), M. genitalium tramite PCR. I test sierologici non sono significativi per la diagnosi delle infezioni da micoplasmi nella pratica clinica quotidiana.
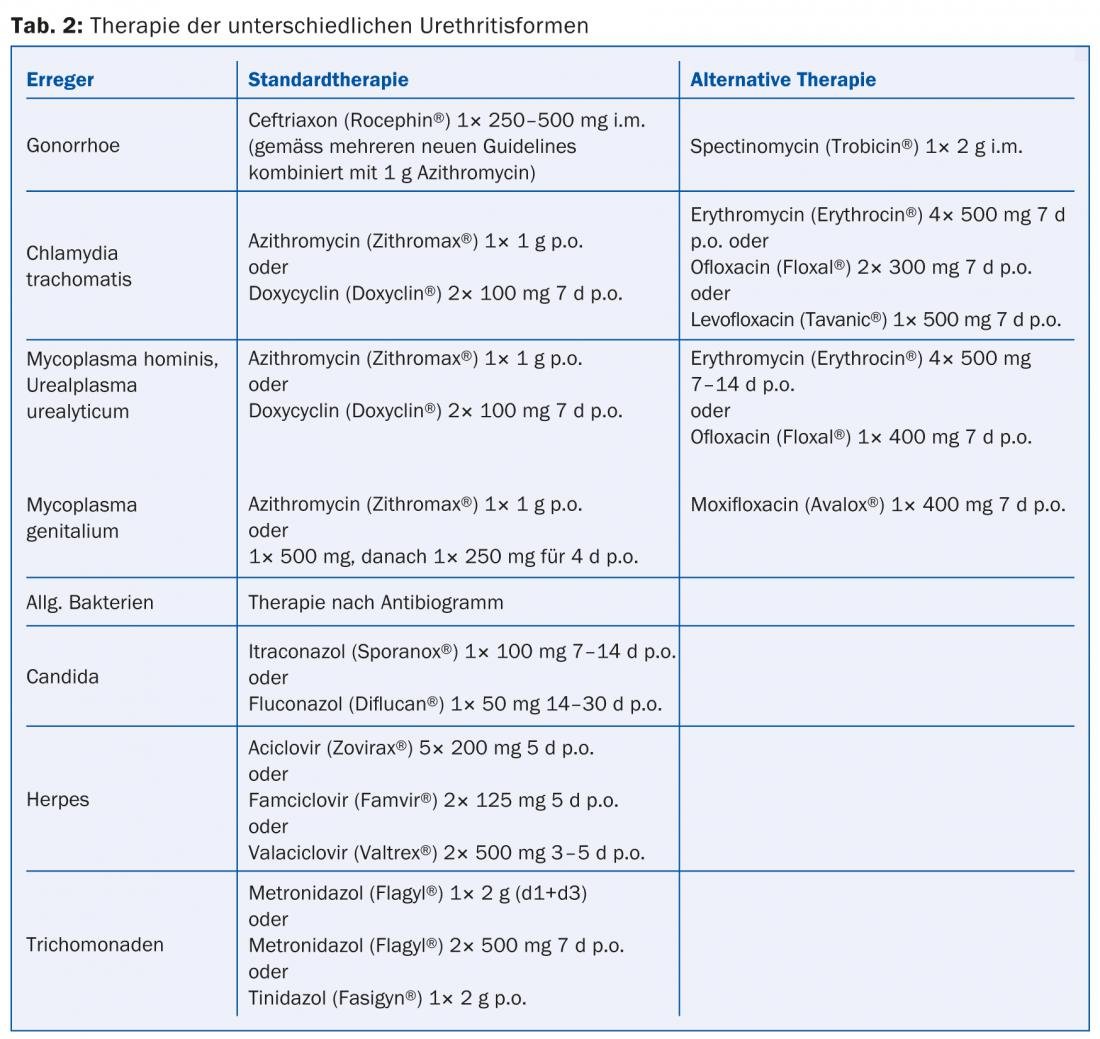
Terapia: le tetracicline, gli antibiotici macrolidi e i chinoloni sono i farmaci di scelta. La doxiciclina 2×100 mg/d per sette giorni o l’azitromicina 1× 1 g sono considerate la terapia standard per M. hominis e U. urealyticum (Tab. 2). Per le forme croniche di uretrite, può essere necessaria una durata più lunga della terapia. L’azitromicina è consigliata per il trattamento dell’uretrite da M. genitalium, in quanto ha un effetto chiaramente superiore alle tetracicline. Di recente sono stati osservati sempre più fallimenti del trattamento, motivo per cui un trattamento di più giorni (1×500 mg il primo giorno, seguito da 1×250 mg in quattro giorni) è favorito in caso di mancata risposta a 1 g di azitromicina (Tab. 2). La moxifoxacina è considerata il farmaco di riserva assoluta.
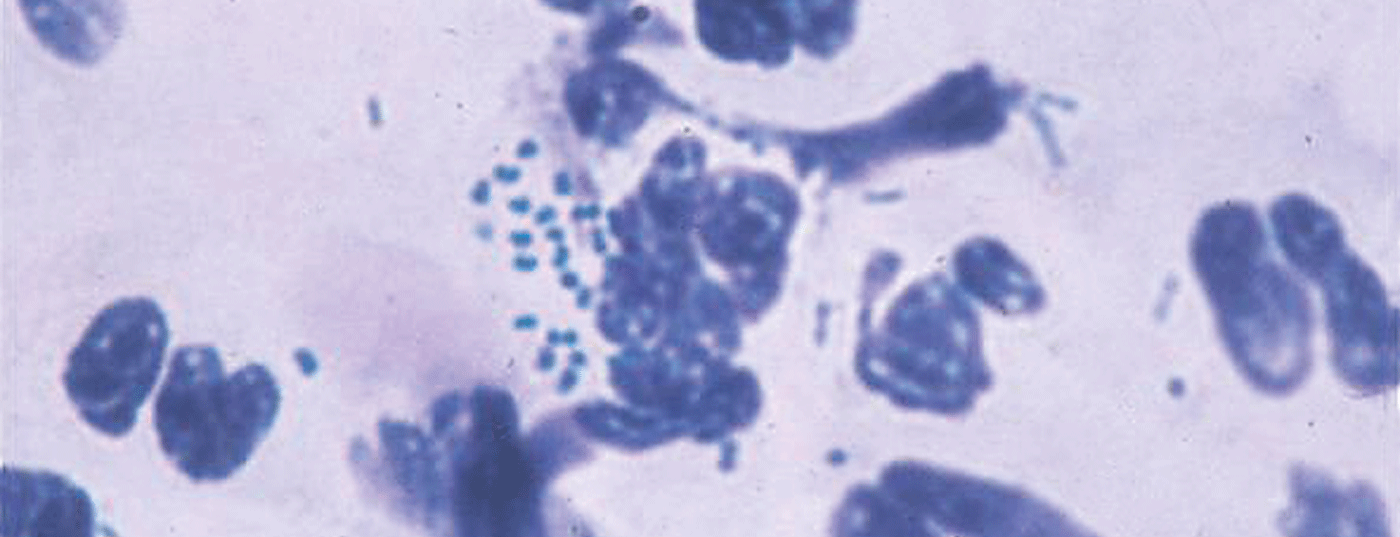
Batteri della flora orale e anale
Gli uretriti possono essere causati da numerosi altri batteri. Lo stafilococco aureo può causare uretrite, cistite o prostatite, soprattutto nei pazienti con cateteri uretrali. Anche gli streptococchi e soprattutto gli enterococchi possono causare l’uretrite. L’E. coli può raramente causare uretrite, cistite, prostatite o epididimite e pielonefrite negli uomini dopo un rapporto anale.
Gli agenti patogeni della flora orale, come l’Haemophilus influenzae, possono spesso essere causali, soprattutto perché il sesso orale è oggi considerato da molti come non problematico per quanto riguarda la trasmissione di infezioni e di conseguenza vengono utilizzati pochi preservativi durante il sesso orale.
Diagnosi: per stabilire la diagnosi, si deve sempre cercare l’evidenza batteriologica dell’agente patogeno mediante una coltura.
Terapia: la terapia dipende dall’agente patogeno e dall’antibiogramma.
Candida
La Candida albicans può portare all’uretrite secondaria alla balanite o alla vulvovaginite, soprattutto in presenza di diabete mellito o immunodeficienza.
Diagnostica: il rilevamento viene effettuato nella preparazione diretta e tramite coltura micologica.
Terapia: per la terapia si utilizzano derivati dell’imidazolo come l’itraconazolo 100 mg/d per 7-14 giorni o il fluconazolo 50 mg/d per 14-30 giorni (Tab. 2).
I virus
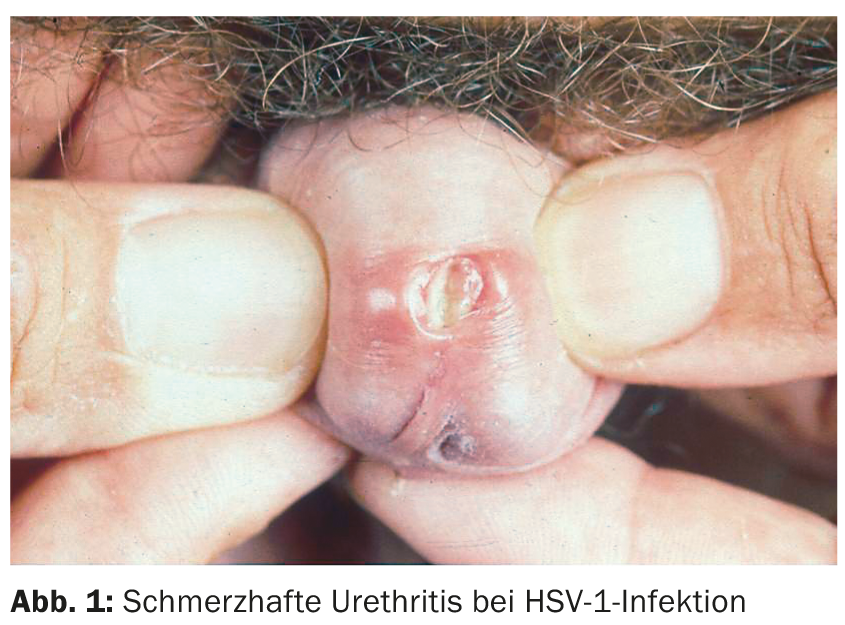
L’uretrite virale deve essere sospettata se i chiarimenti batteriologici sono stati improduttivi. Nell’uretrite da herpes, si riscontra uno scarico doloroso e sieroso, spesso accompagnato da eruzioni erpetiformi sui genitali esterni. Più raramente, si verifica un’infezione da herpes simplex esclusivamente intrauretrale. Studi recenti hanno dimostrato che l’herpes simplex di tipo 1 (Fig. 1) causa più frequentemente la NGU rispetto all’herpes simplex di tipo 2.
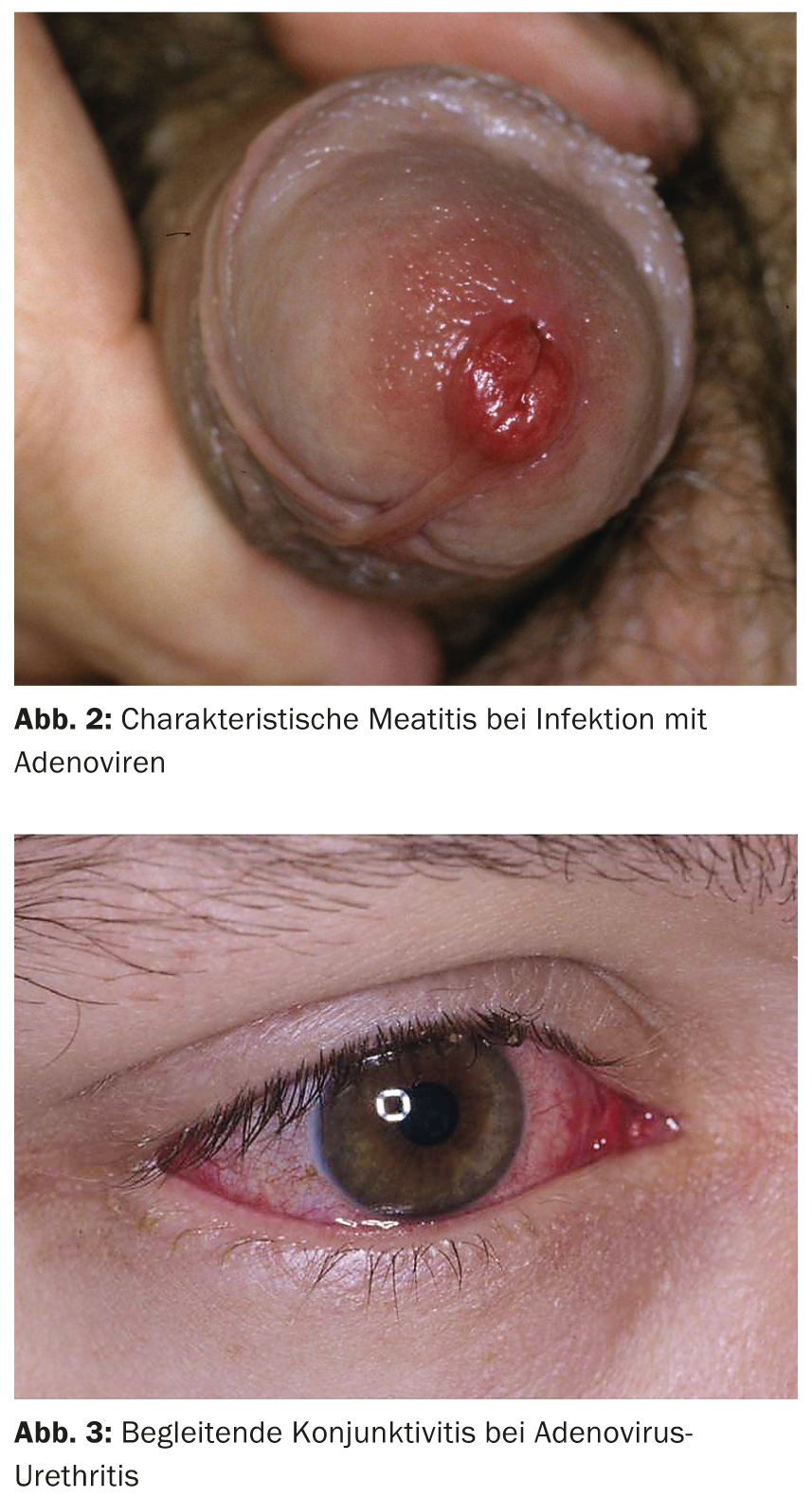
Anche gli adenovirus possono causare l’uretrite. Di solito è caratterizzata da una marcata meatite e dolore (Fig. 2), e la maggior parte è accompagnata da una congiuntivite altamente contagiosa (Fig. 3) . Soprattutto dopo un contatto orale non protetto, i virus dell’adeno- e dell’herpes di tipo 1 devono essere considerati come la causa in assenza di rilevamento del patogeno, soprattutto negli omosessuali.
Diagnostica: nel caso di infezioni da herpes, si raccomanda un test di striscio. La rilevazione culturale dell’HSV richiede circa 48 ore. I virus possono essere ottenuti solo da lesioni fresche per la coltivazione. Il materiale dello striscio può essere analizzato entro poche ore mediante PCR. La coltura, come la PCR, può essere effettuata anche dall’urina. Anche la rilevazione dell’antigene mediante immunofluorescenza è adatta alla diagnosi. Gli adenovirus possono essere rilevati anche dall’urina.
Terapia: la terapia dell’uretrite erpetica viene effettuata con analoghi nucleosidici, se necessario.
Trichomonadi
Il Trichomonas vaginalis è un flagellato di forma ovale con quattro flagelli e una membrana ondulata. La tricomoniasi è un’infezione a trasmissione sessuale che si verifica in tutto il mondo e la sua prevalenza dipende dal comportamento sessuale a rischio. Nelle statistiche, ci sono notevoli differenze nei tassi di infezione tra i singoli gruppi di popolazione e tra i Paesi industrializzati e quelli in via di sviluppo. Il picco di età corrisponde a quello della massima attività sessuale e si correla con l’insorgenza di altre IST che dovrebbero essere escluse.
La trasmissione della T. vaginalis avviene principalmente attraverso il contatto sessuale e solo raramente attraverso la contaminazione, poiché il tempo di sopravvivenza al di fuori di un ambiente umido è breve. Le donne sono colpite più spesso degli uomini. I sintomi possono includere vaginite, prematurità e rottura prematura delle membrane. Circa un quarto delle donne infette è asintomatico. Negli uomini, la tricomoniasi è poco studiata, ma gli studi suggeriscono che causa fino al 20% dei casi di NGU negli uomini in alcune regioni.
Diagnosi: la migliore procedura diagnostica consiste nell’esame microscopico della volta vaginale, della cervice e dell’uretra in una preparazione nativa con 0,9% NaCl. Nelle donne, circa il 75% delle infezioni può essere diagnosticato in questo modo. La polarizzazione o la microscopia in campo oscuro aumentano il tasso di successo.
Lo striscio è solitamente ricco di neutrofili e di cellule epiteliali mucose, quindi i flagellati sono meglio identificati dal loro movimento. A causa del tasso di rilevamento più basso negli uomini, può essere necessario un esame del sedimento urinario del mattino.
Sono disponibili diversi terreni di coltura adatti con una sensibilità di circa il 95%. La coltura viene offerta solo in pochissimi laboratori. Anche la PCR non è molto diffusa. La risposta sierica degli anticorpi all’infezione da trichomonad è variabile e inaffidabile, quindi i test sierologici di routine non sono raccomandati.
Terapia: la tricomoniasi può essere trattata con metronidazolo 1× 2 g con eventuale ripetizione dopo due giorni o con 2×500 mg/d per sette giorni, ma si noti l’effetto antabuse-like. Anche il tinidazolo 1× 2 g può essere utilizzato come opzione di trattamento. Il tinidazolo ha un’emivita più lunga, minori effetti collaterali e un tasso di guarigione leggermente superiore.
Gestione
Un esempio di un possibile approccio all’uretrite è riportato nella Tabella 3.

Letteratura dell’autore
Prof. Dr. med. Stephan Lautenschlager
PRATICA DERMATOLOGICA 2013; 23(6): 7-11