La sindrome dell’intestino irritabile è il disturbo funzionale più comune del tratto gastrointestinale. L’articolo fornisce un aggiornamento sulla fisiopatologia, la diagnosi e la terapia di questo complesso di sintomi.
La sindrome dell’intestino irritabile (IBS) è il disturbo funzionale più comune del tratto gastrointestinale, con una prevalenza stimata del 7-30% in Europa [1]. La malattia rappresenta un complesso di sintomi descritto dai criteri di Roma IV (Tab. 1) [2]. Vengono descritti tre sottotipi in base alla consistenza delle feci: IBS di tipo diarrea (IBS-D/IBS-D), IBS di tipo costipazione (IBS-O/IBS-C) – IBS di tipo misto (IBS-M/IBS-M).

La diagnosi viene fatta di solito prima dei 50 anni, e le donne sono colpite più spesso degli uomini (2:1). Solo un quarto di tutti i pazienti si rivolge a un medico, il che significa che il numero di casi non segnalati è elevato. I pazienti con IBS hanno una qualità di vita significativamente ridotta rispetto alla popolazione normale, che causa notevoli costi diretti (visite mediche, farmaci, malattie concomitanti) e indiretti (assenze dal lavoro, prestazioni ridotte). Tra le comorbilità, i disturbi psichiatrici, in particolare la depressione, sono più comuni nei pazienti con IBS, con un massimo del 30% rispetto al 18% della popolazione normale [3]. Esiste anche un’elevata associazione con malattie come la fibromialgia, l’emicrania e la sindrome da stanchezza cronica.
Fisiopatologia
L’IBS è una complessa malattia multifattoriale che, nonostante le numerose nuove scoperte degli ultimi anni, è ancora lontana dall’essere compresa (Fig. 1) . L’asse cervello-intestino coinvolge l’interazione dei sistemi autonomico, neuroendocrino e neuroimmunologico con il sistema nervoso centrale. Il tratto gastrointestinale è altamente innervato e una moltitudine di fibre nervose afferenti genera informazioni sul contenuto intestinale e sui processi di regolazione della digestione, dell’assorbimento e della difesa immunitaria [4]. Nella sindrome dell’intestino irritabile, è dimostrato che sia l’elaborazione centrale di queste informazioni che la risposta ai segnali intestinali sono disturbate [5]. La caratteristica comune delle malattie funzionali del tratto gastrointestinale è l’ipersensibilità viscerale. I pazienti affetti da IBS hanno una soglia percettiva e dolorifica più bassa rispetto agli stimoli intestinali, il che può promuovere ulteriormente la sensibilizzazione nervosa centrale [6]. La causa di questa sensibilizzazione è in definitiva poco chiara. Nella sindrome dell’intestino irritabile, sono noti anche sottili disturbi della motilità gastrointestinale, forse come effettore dell’ipersensibilità viscerale, che possono portare a un tempo di transito prolungato o accelerato, a seconda della gravità.
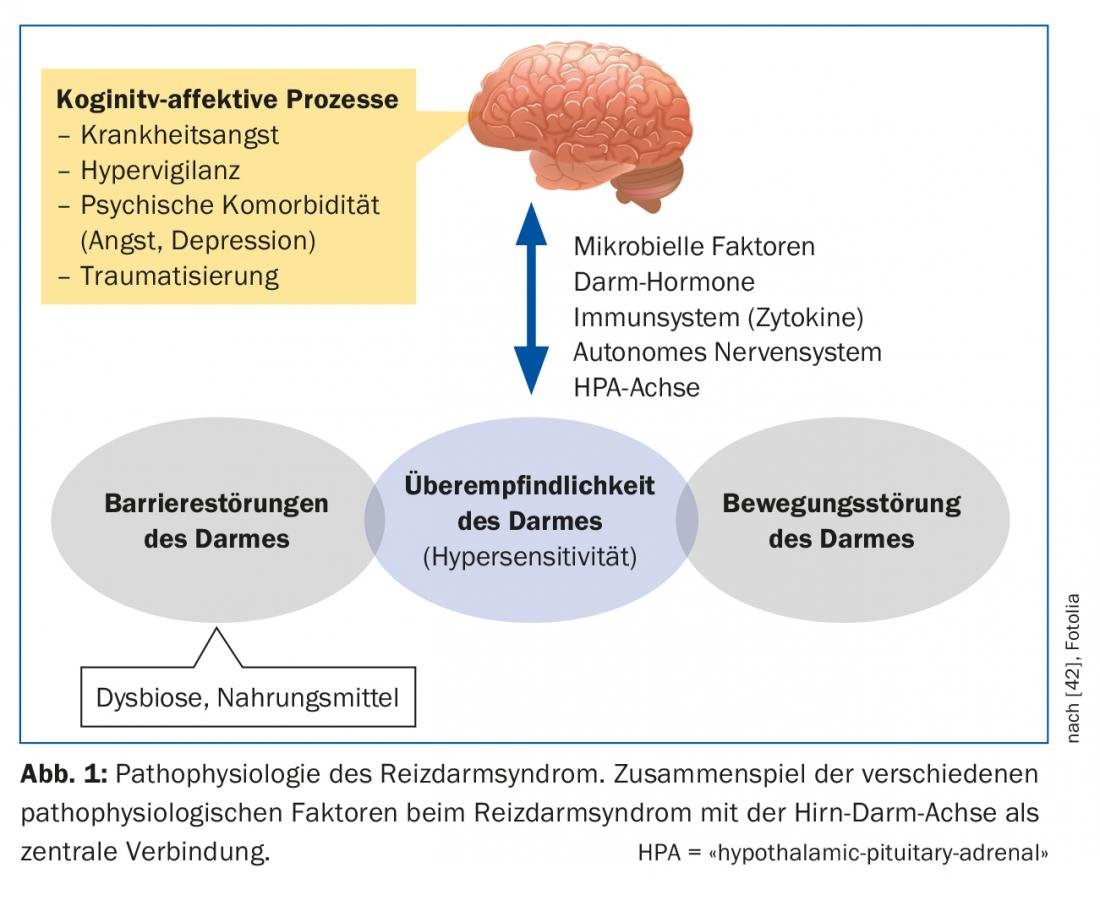
La mucosa dell’intestino ha un’enorme superficie con la quale siamo in contatto quotidiano con il mondo esterno. Questa interazione può essere alterata in diversi modi nei pazienti con IBS. La cosiddetta barriera intestinale è costituita da un singolare strato di connessioni cellulari (“giunzioni strette”). Se non funzionano correttamente, possono aumentare la permeabilità intestinale (“leaky gut”). Così, gli antigeni possono penetrare nell’epitelio e innescare e mantenere i processi immunologici o infiammatori [7]. Anche il microbioma intestinale svolge un ruolo in questo senso. È composto da un gran numero di specie batteriche diverse ed è parte integrante di molti processi nella zona della barriera intestinale. Se l’equilibrio naturale è disturbato, si verifica una disbiosi intestinale, che può verificarsi per vari motivi (ad esempio, terapia antibiotica). Ci sono prove che i pazienti con IBS presentano una disbiosi quantitativa e qualitativa, che può influenzare la funzione dell’asse intestino-cervello. Si discute anche se l’infiammazione persistente di basso grado della mucosa, ad esempio dopo infezioni gastrointestinali acute, possa alterare la permeabilità intestinale. In singoli studi, è stato riscontrato un aumento delle cellule infiammatorie nella mucosa dei pazienti con IBS [8].
Il ruolo dello stress cronico, soprattutto dopo esperienze traumatiche nell’infanzia, può favorire la probabilità di una reazione eccessiva al dolore in età adulta [9]. Lo stress può anche influenzare l’asse ipotalamico del cortisolo e quindi influenzare i processi infiammatori nella mucosa.
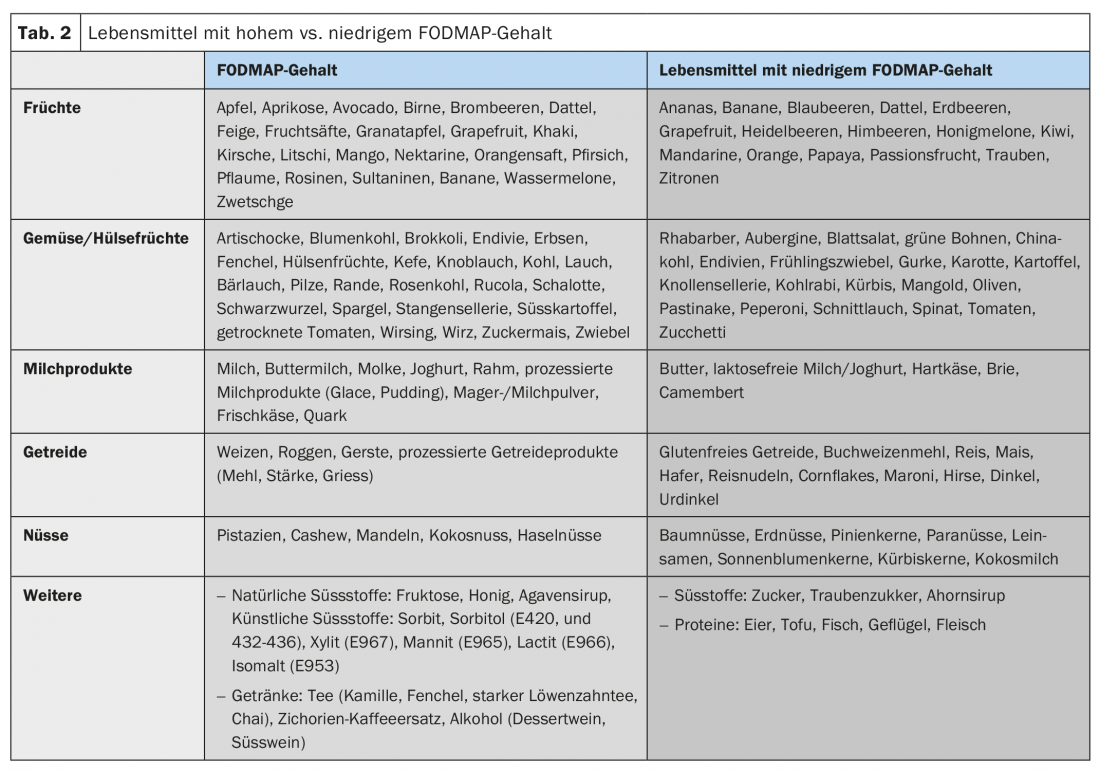
La maggior parte dei pazienti descrive un aumento dei sintomi dopo i pasti e la maggior parte dei pazienti sa quali alimenti evitare [10]. A causa degli effetti osmotici e della fermentazione batterica, in particolare i componenti alimentari scarsamente assorbibili, compresi i cosiddetti FODMAP (oligo-, di- e monosaccaridi fermentabili e polioli), possono esacerbare i disturbi addominali legati alla IBS (Tab. 2). Tuttavia, la fermentazione di questi FODMAP dipende anche dalla composizione del microbioma intestinale. Inoltre, si sospettano interazioni bioattive dirette con la mucosa e attivazioni immunitarie da parte degli alimenti. Anche i fattori cognitivi (l’anticipazione del dolore dopo i pasti) giocano un ruolo in questo caso.
L’IBS è diffusa nelle famiglie, il che suggerisce un background genetico oltre ai fattori sociali. I gemelli monozigoti hanno più probabilità di essere affetti da IBS rispetto ai gemelli dizigoti (33% contro 13%) e un’anamnesi familiare positiva è più comune nell’IBS rispetto alla popolazione normale (33% contro 2%) [11].
Diagnostica
L’IBS non è una diagnosi di esclusione, ma può essere stabilita con l’aiuto dei criteri di Roma IV e di un numero limitato di esami. Se non sono presenti segni di allarme – età >50 anni, perdita di peso, febbre, perdite di sangue dall’ano, disfagia, vomito, febbre, anemia, anamnesi familiare positiva per tumori del colon-retto, malattia infiammatoria intestinale e celiachia – la sindrome dell’intestino irritabile può essere diagnosticata con buona certezza se sono soddisfatti i criteri di Roma [12]. Solo nel 5% di tutti i pazienti con IBS viene riscontrata una malattia organica durante il decorso della malattia, ma soprattutto nel primo anno dopo l’insorgenza dei sintomi dell’IBS è importante escludere le malattie sistemiche rilevanti [13]. Dopo i 50 anni, la probabilità di cancro al colon a seguito di una (presunta) diagnosi di IBS è dell’1%, una percentuale significativamente più alta rispetto alla popolazione normale. Nelle donne, il cancro ovarico deve essere sempre preso in considerazione, poiché i sintomi simili alla sindrome dell’intestino irritabile spesso si presentano come primo sintomo [14].
Nei pazienti con RDS-D, si raccomanda di escludere sierologicamente la celiachia e di determinare gli anticorpi IgA transglutaminasi e IgA totali. La prevalenza della carenza di IgA nella celiachia è dell’1,7-3%, significativamente più alta rispetto alla popolazione generale (0,2%). HLA-DQ2 e -DQ8 non devono essere utilizzati come test di screening.
diventare.
Fino al 40% dei pazienti con malattia infiammatoria intestinale soddisfa anche i criteri per l’IBS, quindi l’infiammazione intestinale dovrebbe essere esclusa con la determinazione non invasiva ed economica della calprotectina fecale. Il rischio di malattia infiammatoria intestinale con una calprotectina <40 ug/g è inferiore all’1% [15]. Lo svantaggio è che la calprotectina non è molto specifica, motivo per cui è necessario effettuare ulteriori chiarimenti se i valori sono elevati.
In presenza di sintomi tipici dell’IBS senza segni di allarme, la probabilità di cancro al colon o di malattia infiammatoria intestinale è di circa l’1%, per cui le linee guida americane raccomandano la colonscopia solo nei pazienti di età superiore ai 50 anni [16]. Le linee guida europee raccomandano la colonscopia per la RDS-D anche prima dei 50 anni, soprattutto per escludere la colite microscopica [17].
Nei casi che rimangono poco chiari, possono essere utili indagini di laboratorio più approfondite: Marcatori infiammatori sistemici (CRP, emocromo differenziato), parametri di malassorbimento (stato del ferro, vitamine, albumina), TSH, elastasi pancreatica nelle feci, breath test al lattosio H2, parassitologia delle feci).
Un esame ecografico nella valutazione iniziale dei disturbi addominali per escludere una patologia grossolana viene solitamente eseguito perché è facilmente disponibile e poco costoso. Tuttavia, non ci sono prove positive sul beneficio nella diagnosi dell’IBS.
In sintesi, la diagnosi di IBS si basa su quattro fattori: anamnesi, esame fisico, un numero limitato di esami di laboratorio e l’endoscopia in casi selezionati. Inoltre, occorre menzionare l’esame ginecologico nelle donne.
Terapia
Nel trattamento dell’IBS, si raccomanda un approccio graduale, tenendo conto della gravità dei sintomi descritti (Fig. 2) . La maggior parte dei pazienti può essere gestita con successo nello studio del medico di famiglia. Solo una piccola percentuale di pazienti con un decorso difficile e refrattario della malattia beneficia dell’assistenza di un consulto gastroenterologico specializzato.
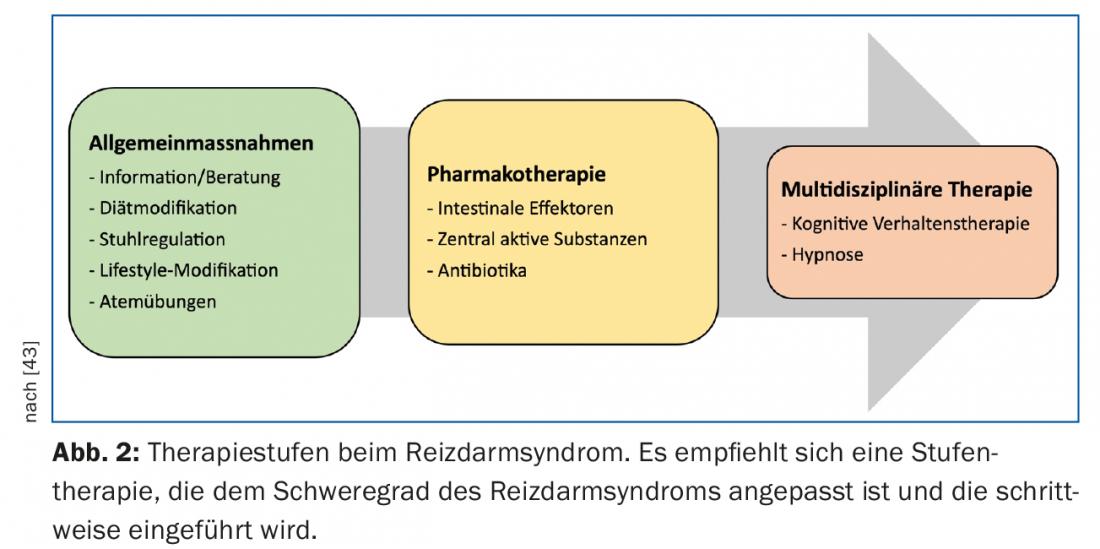
Una componente centrale nel trattamento dell’IBS è una relazione medico-paziente stabile e intatta. I pazienti affetti da IBS spesso lamentano una mancanza di empatia e di comprensione per i sintomi che descrivono, il che, oltre ai reclami persistenti, porta anche a ripetute consultazioni, a richieste di ulteriori chiarimenti e, non di rado, anche a regolari cambi di medico. La terapia di base consiste in una diagnosi dettagliata con una spiegazione orientata al paziente e comprensibile della fisiopatologia e delle opzioni terapeutiche, senza terminologia medica. L’autenticità dei reclami deve essere presa in considerazione in modo credibile dal paziente e i timori devono essere presi sul serio. È particolarmente importante chiedere la comprensione della malattia e le aspettative, ma allo stesso tempo è necessario fissare obiettivi realistici (“la certezza diagnostica al 100% non è possibile”). I pazienti devono essere coinvolti nelle decisioni terapeutiche, in modo da influenzare positivamente la soddisfazione/qualità della vita e la progressione della malattia.
Modifica della dieta: la maggior parte dei pazienti riferisce di aver già fatto autoanalisi con diete di esclusione in passato durante la consultazione iniziale, tuttavia un aggiustamento strutturato della dieta è spesso il primo passo nel trattamento dei sintomi dell’IBS. I componenti alimentari scarsamente assorbibili e osmoticamente attivi, soprattutto i cosiddetti FODMAP, svolgono un ruolo in questo senso. L’efficacia di una dieta a basso contenuto di FODMAP nell’IBS è stata dimostrata in diversi studi (circa il 70% di risposta clinica), motivo per cui le modifiche della dieta dovrebbero sempre essere uno dei primi passi terapeutici nell’IBS [18]. In base ai dati attuali, non è possibile raccomandare una dieta priva di glutine da sola.
Terapia analgesica: gli spasmolitici anticolinergici sono molto spesso utilizzati nella SII, anche se le prove sull’effetto di questi farmaci sono scarse [19]. In Svizzera, vengono utilizzate principalmente le seguenti sostanze: Butilscopalamina (Buscopan®), Mebeverina (Duspatalin®), Pinaverina bromuro (Dicetel®), Trimebutine (Debridat®) e Metixen (Spasmocanulase®). I possibili effetti collaterali possono includere secchezza delle fauci e disturbi visivi.
I fitoterapici sono ben accettati dai pazienti; il più usato in Svizzera è Iberogast®, una miscela a base di alcol di nove estratti di piante. Uno studio randomizzato, controllato con placebo, ha mostrato un miglioramento significativo del dolore addominale associato all’IBS [20]. Una riduzione significativa dei sintomi dell’IBS è stata dimostrata anche per le capsule di olio di menta piperita (Colpermin®), utilizzate di frequente [21,22]. In questo caso, l’effetto è probabilmente multifattoriale, compresi gli effetti antagonisti sui canali del calcio (rilassamento muscolare) e gli effetti agonisti sui recettori oppioidi. Un’altra preparazione è il concentrato di carciofo Hepa-S®, ma in questo caso i dati limitati non mostrano alcun beneficio definitivo [23].
Gli antidepressivi come gli inibitori della ricaptazione della serotonina (SSRI) e gli antidepressivi triciclici mirano a correggere un deficit serotoninergico con un effetto sull’asse intestino-cervello. In una revisione Cochrane [24], sono stati ottenuti effetti positivi sia sul benessere generale che, nello specifico, sui disturbi addominali (numero necessario per trattare (NNT) = 4 resp. 5). Tuttavia, i pazienti con IBS senza depressione come comorbidità non sembrano trarre beneficio dalla terapia con SSRI.
Trattamento della sindrome dell’intestino irritabile con costipazione: l’uso di agenti di riempimento come la sterculia (Colosan®, Normacol®) e i semi di psillio/flax (Metamucil®, Mucilar®, Linomed®) o di lassativi isoosmotici a base di polietilenglicole (Transipeg®, Movicol®) può migliorare la frequenza e la consistenza delle feci, ma questi preparati non hanno alcun effetto sul dolore addominale associato alla sindrome dell’intestino irritabile o sulla flatulenza [19]. I lassativi stimolanti dovrebbero essere evitati a causa della scarsa tolleranza.
Il linaclotide (Constella®) è un agonista della guanilato ciclasi che agisce localmente nell’intestino ed è approvato per il trattamento dell’IBS con costipazione. L’azione del recettore locale porta all’attivazione dei canali ionici nell’intestino e quindi alla secrezione di cloruro, bicarbonato e acqua nel lume intestinale. Inoltre, c’è anche un effetto analgesico sui nocicettori dell’intestino. La linaclotide aumenta significativamente il numero di defecazioni complete e riduce il numero e la gravità del dolore addominale [25,26].
Il lubiprostone (Amitiza®) è un attivatore del canale del cloruro che agisce localmente nell’intestino ed è approvato in Svizzera per il trattamento della stipsi cronica idiopatica e della stipsi indotta da oppioidi. A dosi più basse, il farmaco è approvato anche negli Stati Uniti e in Giappone per l’IBS-O, dove ha mostrato buoni risultati per i sintomi dell’IBS (dolore, gonfiore) [27].
La prucalopride (Resolor®) è un agonista selettivo del recettore della serotonina (5-HT4) ad alta affinità, approvato in Svizzera per il trattamento della stipsi cronica idiopatica. Ci sono dati relativi all’uso nella SII-O che hanno mostrato un effetto positivo sui sintomi della SII [28].
Trattamento dell’IBS con diarrea: la loperamide (Imodium®) è spesso utilizzata nell’IBS-D per regolare le feci, ma non ha alcun effetto sui sintomi del dolore. In combinazione con un agente gonfiante, l’effetto antidiarroico può essere migliorato. Per il trattamento della diarrea, può essere utilizzato in via sperimentale anche il legante degli acidi biliari colestiramina (Quantalan®), poiché circa il 25% di tutti i pazienti affetti da IBS-D mostra evidenza di una sindrome da perdita di acidi biliari [29]. In studi non randomizzati, è stato dimostrato che la colestiramina riduce la frequenza delle feci e il disagio addominale [30].
L’eluxadolina (Truberzi®) è un agonista dei recettori μ-opioidi e κ-opioidi e un antagonista dei recettori δ-opioidi che agiscono localmente nell’intestino e quindi ha proprietà antidiarroiche e analgesiche. Nel febbraio 2018, il farmaco è stato approvato da Swissmedic per il trattamento dell’IBS-D, ma non è ancora disponibile in Svizzera. In uno studio randomizzato, Truberzi ha dimostrato un migliore controllo del dolore e della diarrea rispetto al placebo dopo 12 settimane di terapia nel successivo periodo di 1 anno [31]. Questo vale anche per i pazienti che erano stati trattati in precedenza con la loperamide per i recettori μ-opioidi [32].
L’ondansetron (Zofran®) è un antagonista del recettore della serotonina (5-HT3) approvato in Svizzera per il trattamento della nausea associata alla chemioterapia. Nei pazienti con IBS-D, sono stati osservati anche un rallentamento della peristalsi intestinale e una riduzione dell’ipersensibilità viscerale e del dolore addominale [33]. Sono previsti ulteriori studi per confermare questi risultati promettenti.
La Rifaximina (Xifaxan®) è un antibiotico specifico per l’intestino, approvato in Svizzera per la prevenzione delle recidive nell’encefalopatia epatica. Negli Stati Uniti, il farmaco può essere utilizzato anche per il trattamento dell’IBS-D. È stato dimostrato che la Rifaximina ha un effetto positivo sui sintomi dell’IBS per le dieci settimane successive a due settimane di terapia (8-10% in più rispetto al placebo) [34]. La terapia antibiotica sembra portare a un cambiamento positivo del microbioma intestinale, ma i meccanismi esatti non sono chiari. Se necessario, il ciclo di terapia può essere ripetuto come desiderato. Le preoccupazioni iniziali sullo sviluppo della resistenza non sono state confermate e il profilo degli effetti collaterali è basso.
Le prove a favore dell’uso dei probiotici nell’IBS non sono conclusive, gli studi sono eterogenei, con risultati positivi nella maggior parte degli studi più piccoli. I lattobacilli, i bifidobatteri e il Saccharomyces boulardii sembrano avere i risultati migliori. In una recente revisione sistematica, è stato dimostrato che i probiotici sono efficaci in alcuni pazienti con sindrome dell’intestino irritabile. [35].
Terapie non farmacologiche: Sembra che la terapia cognitivo-comportamentale e l’ipnosi abbiano un certo beneficio nel trattamento dell’IBS, ma non è chiaro se il miglioramento dei sintomi dell’IBS sia legato a un’effettiva riduzione del dolore viscerale o semplicemente rifletta una migliore elaborazione del dolore. In due analisi Cochrane del 2009, l’effetto di queste terapie è stato valutato con cautela [36,37]. In una recente revisione sistematica, l’effetto di queste terapie è stato valutato positivamente, ma la forma di contatto, la durata del trattamento e il tipo di comunicazione non sono ancora chiaramente definiti [38].
Trattamento dell’IBS con sintomi di gonfiore: Il gonfiore, con o senza un aumento visibile della circonferenza addominale, è una caratteristica di varie malattie funzionali del tratto gastrointestinale e spesso risulta molto fastidioso per i pazienti. A parte le modifiche della dieta (dieta a basso contenuto di FODMAP) e l’uso di rifaximina, ci sono poche opzioni terapeutiche. Non ci sono prove a favore dell’uso di sostanze antischiuma come il simeticone (Flatulex®) o il dimeticone (Spasmocanulase®) per i disturbi funzionali della flatulenza. La loro utilità è per lo più deludente. Diversi studi eleganti hanno dimostrato che la flatulenza nei pazienti con IBS non è causata da un aumento del volume del gas intestinale, ma da spostamenti caudo-ventrali del contenuto intra-addominale. Piuttosto, a causa di un riflesso viscero-somatico, si verifica una reazione muscolare anomala del diaframma (contrazione) e dei muscoli addominali inferiori (rilassamento), con conseguente protrusione dell’addome [39]. Lo stesso gruppo di ricerca è stato poi in grado di ottenere una riduzione significativa dei sintomi e anche della circonferenza addominale nei pazienti affetti da IBS con sintomi di gonfiore acuto, con l’aiuto della terapia di respirazione specifica assistita da biofeedback [40]. In un successivo studio randomizzato, i sintomi della flatulenza hanno continuato a diminuire con l’esercizio fisico regolare durante un periodo di osservazione di sei mesi [41].
Sommario
La sindrome dell’intestino irritabile rimane un complesso di sintomi che sta iniziando a essere compreso e le opzioni di trattamento sono ancora limitate. Con la crescente comprensione della fisiopatologia, sarà probabilmente possibile caratterizzare ulteriori sottotipi nel panorama attualmente molto eterogeneo delle malattie funzionali intestinali. Non sulla base dei sintomi clinici, come tentano di fare oggi i criteri di Roma IV, ma con l’aiuto di biomarcatori che, nel migliore dei casi, consentiranno in futuro una diagnosi positiva di questo quadro clinico. Una migliore comprensione della fisiopatologia porterebbe inevitabilmente allo sviluppo di nuovi approcci terapeutici che vanno oltre l’attuale trattamento puramente orientato ai sintomi.
Messaggi da portare a casa
- La sindrome dell’intestino irritabile non è una diagnosi di esclusione, ma può essere stabilita con l’aiuto dei criteri di Roma IV e di un numero limitato di esami.
- Il trattamento dell’IBS si basa su un approccio graduale che tiene conto della gravità.
- Le modifiche della dieta, in particolare una dieta FODMAP (oligo-, di- e monosaccaridi fermentabili), e una dieta a basso contenuto di polioli dovrebbero essere uno dei primi passi terapeutici.
- I sintomi della flatulenza funzionale possono essere alleviati con la fisioterapia e la terapia respiratoria.
Letteratura:
- Saha L: Sindrome dell’intestino irritabile: patogenesi, diagnosi, trattamento e medicina basata sull’evidenza. World J Gastroenterol 2014; 20(22): 6759-6773.
- Lacy BE, et al: Disturbi intestinali. Gastroenterologia 2016; 150(6): 1393-1407e5.
- Grundmann O, Yoon SL: Sindrome dell’intestino irritabile: epidemiologia, diagnosi e trattamento: un aggiornamento per gli operatori sanitari. J Gastroenterol Hepatol 2010; 25(4): 691-699.
- Brookes SJH, Spencer NJ, Costa M, Zagorodnyuk VP: Segnalazione primaria afferente estrinseca nell’intestino. Nat Rev Gastroenterol Hepatol 2013; 10(5): 286-296.
- Lee YJ, Park KS: Sindrome dell’intestino irritabile: paradigma emergente nella fisiopatologia. World J Gastroenterol 2014; 20(10): 2456-2469.
- Soares RLS: Sindrome dell’intestino irritabile: una revisione clinica. World J Gastroenterol 2014; 20(34): 12144-12160.
- Matricon J, et al.: Articolo di revisione: Associazioni tra attivazione immunitaria, permeabilità intestinale e sindrome dell’intestino irritabile. Aliment Pharmacol Ther 2012; 36(11-12): 1009-1031.
- Katiraei P, Bultron G: Necessità di un approccio medico completo alla neuro-immuno-gastroenterologia della sindrome dell’intestino irritabile. World J Gastroenterol 2011; 17(23): 2791-27800.
- Larauche M, Mulak A, Taché Y: Alterazioni della sensazione viscerale legate allo stress: modelli animali per lo studio della sindrome dell’intestino irritabile. J Neurogastroenterol Motil 2011; 17(3): 213-234.
- Heizer WD, Southern S, McGovern S: Il ruolo della dieta nei sintomi della sindrome dell’intestino irritabile negli adulti: una revisione narrativa. J Am Diet Assoc 2009; 109(7): 1204-1214.
- El-Salhy M: Sindrome dell’intestino irritabile: diagnosi e patogenesi. World J Gastroenterol 2012; 18(37): 5151-5163.
- Whitehead WE, Palsson OS, Simrén M: Sindrome dell’intestino irritabile: cosa significano le nuove linee guida diagnostiche di Roma IV per la gestione dei pazienti? Expert Rev Gastroenterol Hepatol 2017; 11(4): 281-283.
- El-Serag HB, Pilgrim P, Schoenfeld P: Revisione sistematica: Storia naturale della sindrome dell’intestino irritabile. Aliment Pharmacol Ther 2004; 19(8): 861-870.
- Hamilton W, Peters TJ, Bankhead C, Sharp D: Rischio di cancro ovarico nelle donne con sintomi nell’assistenza primaria: studio caso-controllo basato sulla popolazione. BMJ 2009; 339(7721): 616.
- Menees SB, et al: Una meta-analisi dell’utilità della proteina C-reattiva, della velocità di sedimentazione eritrocitaria, della calprotectina fecale e della lattoferrina fecale per escludere la malattia infiammatoria intestinale negli adulti con IBS. Am J Gastroenterol 2015; 110(3): 444-454.
- AGA: Dichiarazione di posizione medica dell’Associazione Gastroenterologica Americana: Sindrome dell’intestino irritabile. Gastroenerologia 2002; 123(6): 2105-2107.
- Layer P, et al.: Sindrome dell’intestino irritabile S3-Leitlinie: definizione, fisiopatologia, diagnosi e terapia. Linea guida congiunta della Società tedesca per le malattie digestive e metaboliche (DGVS) e della Società tedesca di neurogastroenterologia e motilità. Journal of Gastroenterol 2011; 49(2): 237-293.
- Halmos EP, et al: Una dieta a basso contenuto di FODMAP riduce i sintomi della sindrome dell’intestino irritabile. Gastroenterologia 2014; 146(1): 67-75.
- Ruepert L, et al.: Agenti di riempimento, antispastici e farmaci antidepressivi per il trattamento della sindrome dell’intestino irritabile. Cochrane Database Syst Rev 2011; (8): CD003460.
- Madisch A, Holtmann G, Plein K, Hotz J: Trattamento della sindrome dell’intestino irritabile con preparati a base di erbe: risultati di uno studio multicentrico in doppio cieco, randomizzato e controllato con placebo. Aliment Pharmacol Ther 2004; 19(3): 271-279.
- Merat S, et al.: L’effetto dell’olio di menta piperita con rivestimento enterico e a rilascio ritardato sulla sindrome dell’intestino irritabile. Dig Dis Sci 2010; 55(5): 1385-1390.
- Khanna R, MacDonald JK, Levesque BG: Olio di menta piperita per il trattamento della sindrome dell’intestino irritabile: una revisione sistematica e una meta-analisi. J Clin Gastroenterol 2014; 48(6): 505-512.
- Liu J, et al: Farmaci a base di erbe per il trattamento della sindrome dell’intestino irritabile (revisione). Cochrane Database Syst Rev 2006; (1): CD004116.
- Kaminski A, et al: Antidepressivi per il trattamento dei disturbi funzionali gastrointestinali legati al dolore addominale nei bambini e negli adolescenti. Cochrane Database Syst Rev 2011; (7): CD008013.
- Chey WD, et al: Linaclotide per la sindrome dell’intestino irritabile con costipazione: uno studio di 26 settimane, randomizzato, in doppio cieco, controllato con placebo per valutare l’efficacia e la sicurezza. Am J Gastroenterol 2012; 107(11): 1702-1712.
- Rao S, et al: Uno studio randomizzato e controllato di 12 settimane con un periodo di sospensione randomizzato di 4 settimane per valutare l’efficacia e la sicurezza del linaclotide nella sindrome dell’intestino irritabile con costipazione. Am J Gastroenterol 2012; 107(11): 1714-1724.
- Drossman DA, et al: Studio clinico: Lubiprostone nei pazienti con sindrome dell’intestino irritabile associata a costipazione – Risultati di due studi randomizzati, controllati con placebo. Aliment Pharmacol Ther 2009; 29(3): 329-341.
- Malagelada C, et al.: Effetto della prucalopride sulla tolleranza ai gas intestinali nei pazienti con disturbi funzionali intestinali e costipazione. J Gastroenterol Hepatol 2017; 32(8): 1457-1462.
- Wedlake L, et al: Revisione sistematica: La prevalenza del malassorbimento idiopatico degli acidi biliari, diagnosticato dalla scansione SeHCAT, nei pazienti con sindrome dell’intestino irritabile a predominanza di diarrea. Aliment Pharmacol Ther 2009; 30(7): 707-717.
- Camilleri M: Opzioni di gestione della sindrome dell’intestino irritabile. Mayo Clin Proc 2018; 93(12): 1858-1872.
- Lembo AJ, et al: Eluxadolina per la sindrome dell’intestino irritabile con diarrea. N Engl J Med 2016; 374(3): 242-253.
- Lacy BE, et al: Efficacia di Eluxadoline nei pazienti con IBS-D che riferiscono un precedente uso di Loperamide. Am J Gastroenterol 2017; 112(6): 924-932.
- Garsed K, et al: Uno studio randomizzato sull’ondansetron per il trattamento della sindrome dell’intestino irritabile con diarrea. Gut 2014; 63(10): 1617-1625.
- Pimentel M, et al: Terapia con Rifaximina per i pazienti con sindrome dell’intestino irritabile senza costipazione. N Engl J Med 2011; 364(1): 22-32.
- Hungin APS, et al: Revisione sistematica: i probiotici nella gestione dei sintomi gastrointestinali inferiori nella pratica clinica – una guida internazionale basata sull’evidenza. Aliment Pharmacol Ther 2013; 38(8): 864-886.
- Webb AN, Kukuruzovic RH, Catto-Smith AG, Sawyer SM: Ipnoterapia per il trattamento della sindrome dell’intestino irritabile. Database Cochrane Syst Rev 2007; (4): CD005110.
- Zijdenbos IL, et al: Trattamenti psicologici per la gestione della sindrome dell’intestino irritabile. Cochrane Database Syst Rev 2009; (1): CD006442.
- Radziwon CD, Lackner JM: Terapia cognitivo-comportamentale per l’IBS: quanto è utile, quanto spesso e come funziona? Curr Gastroenterol 2017; 19(10): 49.
- Accarino A, et al: La distensione addominale deriva dalla ridistribuzione caudo-ventrale del contenuto. Gastroenterologia 2009; 136(5): 1544-1551.
- Barba E, et al: Meccanismi addominotoracici della distensione addominale funzionale e correzione mediante biofeedback. Gastroenterologia 2015; 148(4): 732-739.
- Barba E, Accarino A, Azpiroz F: Correzione della distensione addominale mediante il controllo guidato dal biofeedback dell’attività muscolare addominale e toracica in uno studio randomizzato, controllato con placebo. Clin Gastroenterol Hepatol 2017; 15(12): 1922-1929.
- Van Oudenhove LV, et al: Aspetti biopsicosociali dei disturbi gastrointestinali funzionali: come i processi centrali e ambientali contribuiscono allo sviluppo e all’espressione dei disturbi gastrointestinali funzionali. Gastroenterologia 2016; 150(6): 1355-1367.e2.
- Jaynk GS, Gyawali CP: Sindrome dell’intestino irritabile: concetti moderni e opzioni di gestione. The American journal of Medicine 2015; 128(8): 817-827.
PRATICA GP 2019; 14(1): 11-18











