Caso clinico: nel 2009, la paziente, allora 32enne, è stata sottoposta alla prima operazione di tumore al cervello (glioblastoma WHO °IV, DD: astrocitoma anaplastico WHO °III, Mib-1 10%). Il trattamento adiuvante raccomandato [1] è stato rifiutato a causa di una gravidanza in corso. Nel 2011, è stata eseguita una chirurgia di recidiva con radiazione adiuvante (dose totale 60 Gy). Istologicamente, la classificazione del tumore non era ancora chiara. L’indicazione per la chemioterapia è stata discussa e raccomandata dal team interdisciplinare, ma non è stata effettuata su richiesta del paziente. Un altro intervento è stato eseguito per una nuova recidiva nel dicembre 2014 (glioblastoma secondario WHO °IV, IDH1 positivo, MGMT metilato, Mib-1 70%). È stata pianificata una radio-chemioterapia adiuvante con volume di radiazioni adattato, ma è stata interrotta dopo tre irradiazioni (dose totale 6 Gy) su richiesta della paziente; anche la chemioterapia è stata nuovamente rifiutata.
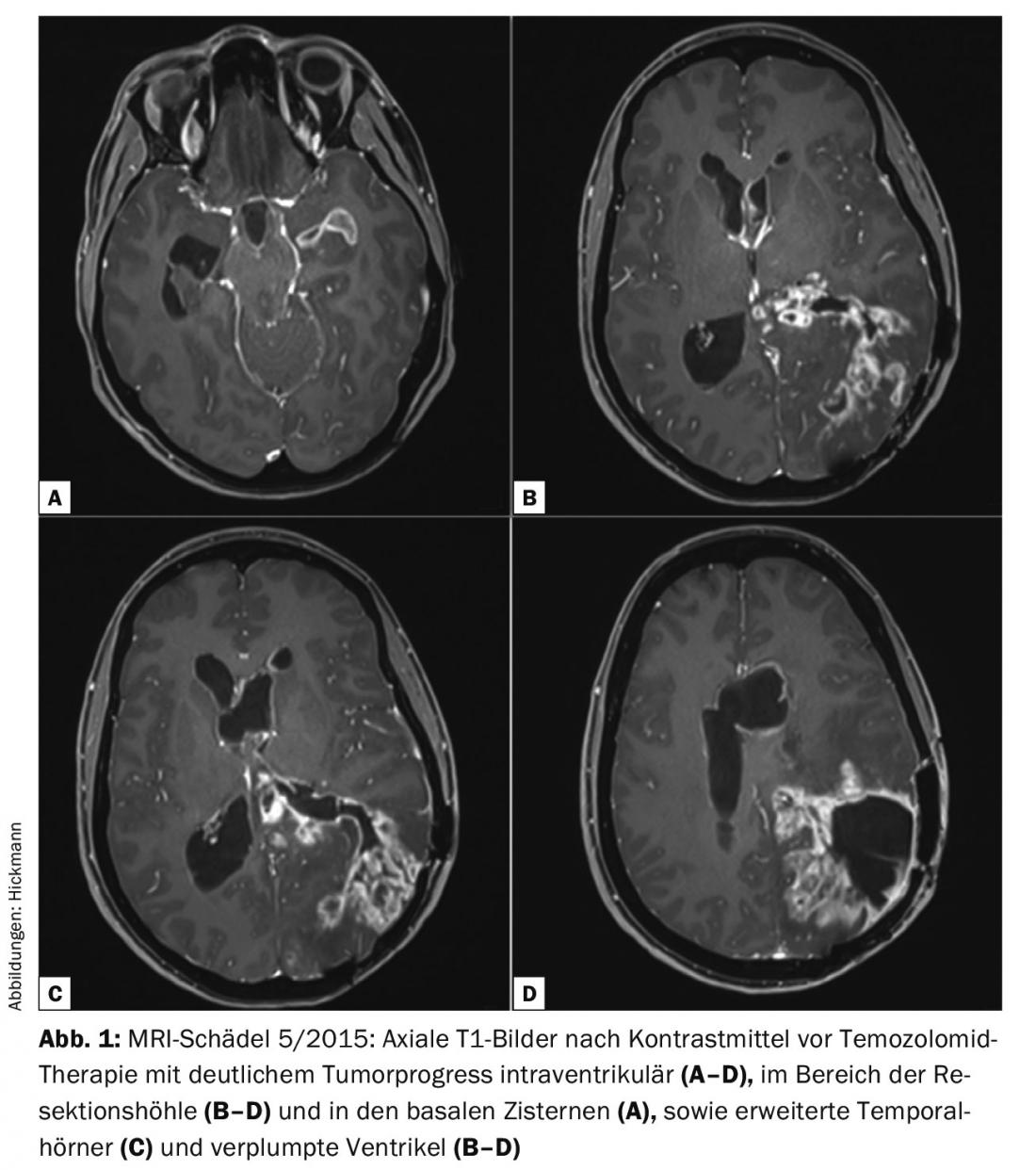
Nel maggio 2015, il paziente sonnolento con una chiara progressione del tumore e una manifestazione tumorale intraventricolare con consecutivo idrocefalo occluso è stato ricoverato come caso di emergenza (Fig. 1).
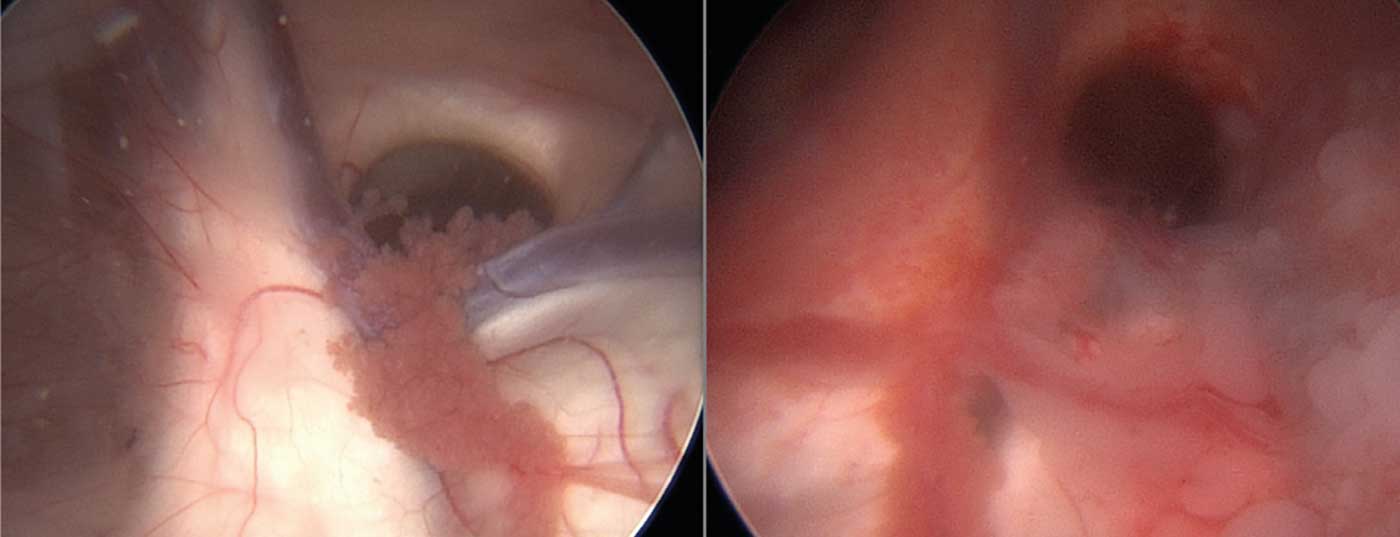
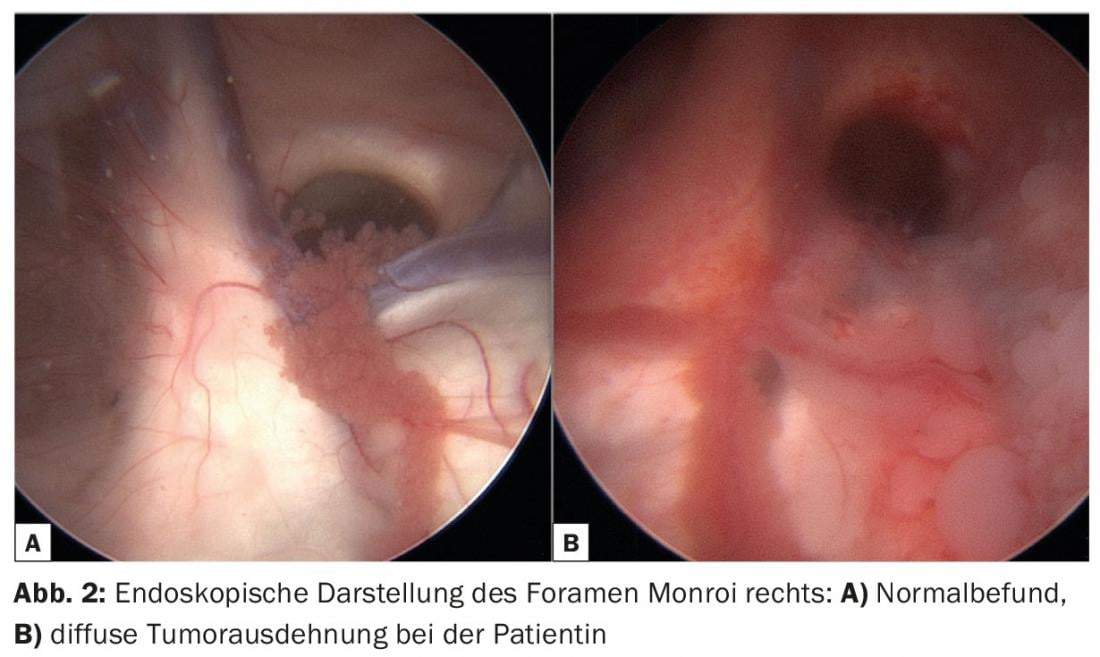
In caso di sintomi di pressione intracranica progressiva, è stata eseguita una ventricolo-cisternostomia palliativa per alleviare l’idrocefalo (Fig. 2). Si trattava di aprire il pavimento del terzo ventricolo con una tecnica endoscopica e di ottenere un passaggio libero del liquido cerebrospinale verso gli spazi subaracnoidei. Dopo l’intervento, c’è stato un rapido recupero clinico, quindi si è ipotizzato che la sintomatologia preoperatoria non fosse dovuta esclusivamente alla progressione del tumore.
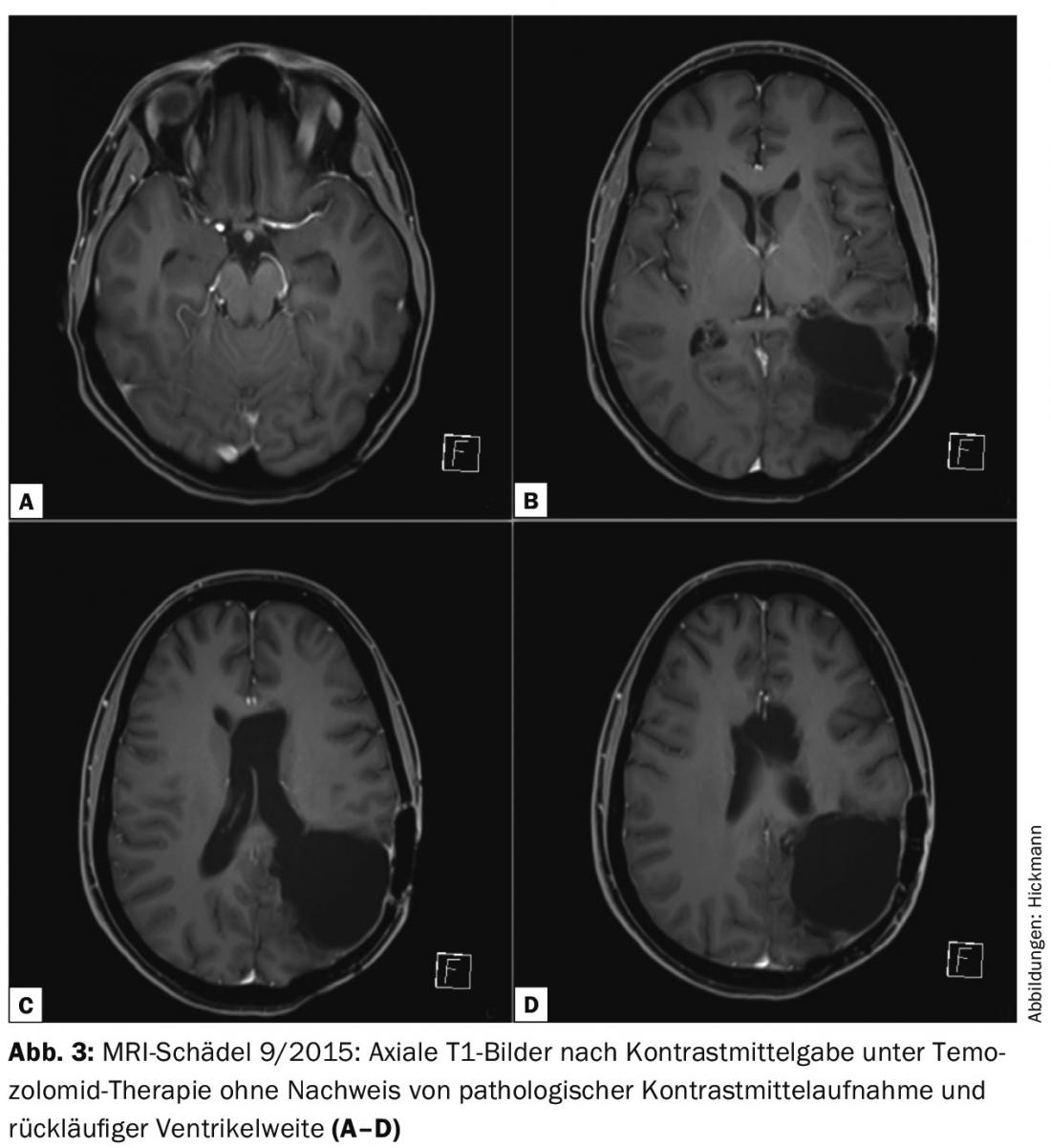
Nonostante la situazione generale infausta, è stata quindi iniziata la chemioterapia con temozolomide (6 cicli, regime 5/28). Sotto terapia, le condizioni cliniche del paziente hanno continuato a migliorare. Senza nuovi deficit neurologici, il punteggio di performance Karnofsky è del 90%. In termini di morfologia dell’immagine, l’ultimo follow-up a settembre 2015, dopo quattro cicli di temozolomide, ha mostrato un’impressionante regressione del tumore senza evidenza di tessuto tumorale che assorbe l’agente di contrasto (Fig. 3).
Discussione: Il decorso clinico e i risultati istologici del 2014 suggeriscono la presenza di un glioblastoma maligno secondario WHO °IV, che nel 2009 era piuttosto un tumore di grado III. Nel complesso, il tumore presenta marcatori genetici molecolari favorevoli dal punto di vista prognostico e terapeutico (IDH1 positivo [sekundäre Malignisierung], MGMT metilato) [2,3]. A causa della disomogeneità dei tumori, sono possibili casi con risultati istologici a volte difficili da interpretare e decorsi clinici notevoli.
La particolarità di questo caso, tuttavia, è il decorso dal maggio 2015. Non ci si aspettava una risposta così buona alla chemioterapia. Nei pazienti con progressione del tumore intraventricolare e deterioramento in termini di idrocefalo acuto (corna temporali visibili, Fig. 1C) , si deve prendere in considerazione una terapia di congestione acuta. In questo modo, si può valutare in che misura i sintomi sono dovuti alla progressione o alla congestione del tumore, soprattutto se – come in questo caso – non sono state esaurite tutte le opzioni di terapia adiuvante e il tumore ha un profilo genetico molecolare predittivamente favorevole. L’ottima risposta del tumore ricorrente alla chemioterapia è probabilmente dovuta all’ingenuità alla temozolomide, oltre che a fattori genetici molecolari (MGMT-metilato) [2]. Inoltre, la barriera emato-encefalica è stata ampiamente disturbata, per cui è possibile che ci sia anche una permeabilità particolarmente buona del SNC per la temozolomide. Anche se si tratta di un caso individuale impressionante, questo corso conferma la nostra idea che approcci terapeutici piuttosto controversi dovrebbero essere presi in considerazione anche per i pazienti con tumori cerebrali maligni non completamente trattati.
Letteratura:
- Stupp R, et al: Radioterapia più temozolomide concomitante e adiuvante per il glioblastoma. N Engl J Med 2005; 352(10): 987-996.
- Stupp R, et al: Glioma di alto grado: Linee guida di pratica clinica ESMO per la diagnosi, il trattamento e il follow-up. Ann Oncol 2014; 25(Suppl 3): iii93-101.
- Wen PY, Kesari S: Gliomi maligni negli adulti. N Engl J Med 2008; 359(5): 492-507.
InFo NEUROLOGIA & PSICHIATRIA 2015; 13(6): 34-35