I sistemi AID (Automated Insulin Delivery) sono sempre più utilizzati per il dosaggio automatizzato o semi-automatizzato dell’insulina nel trattamento del diabete di tipo 1. Grazie alla tecnologia dei microinfusori e dei sensori collegata agli algoritmi di controllo, i sistemi AID possono aiutare a raggiungere uno stato metabolico stabile e normoglicemico, a ridurre il rischio di gravi deragliamenti metabolici acuti e a migliorare significativamente la gestione del glucosio nel diabete di tipo 1.
Un buon esempio di sistema AID semi-automatico è fornito dal progetto di ricerca “KidsApp” per bambini fino a sette anni. Allo stesso tempo, colma una lacuna terapeutica. I microinfusori automatici che regolano la somministrazione di insulina nel diabete di tipo 1 sono stati finora disponibili soprattutto per i bambini e gli adolescenti più grandi. Diversi centri di studio europei, tra cui l’Università di Cambridge, le Università di Medicina di Innsbruck, Graz e Vienna (A) hanno collaborato a questo progetto. Il sistema a circuito chiuso (AID), che è stato testato su 74 bambini di età compresa tra 1 e 7 anni, funziona attraverso CamAPS FX, un’applicazione sviluppata presso l’Università di Cambridge, collegata a un sensore di glucosio per la misurazione continua del glucosio e a una pompa di insulina come un pancreas artificiale. In base ai valori di glucosio registrati e previsti, la quantità di insulina erogata viene regolata automaticamente. I bambini piccoli con diabete di tipo 1 hanno spesso marcate fluttuazioni di glucosio nel sangue e sono quindi ad alto rischio di livelli pericolosamente bassi di glucosio nel sangue (ipoglicemia), che possono portare a perdita di coscienza e convulsioni, così come di livelli pericolosamente alti di glucosio nel sangue (iperglicemia), che aumentano il rischio di gravi deragliamenti metabolici acuti e lo sviluppo di chetoacidosi diabetica. La glicemia dei bambini deve essere misurata più volte durante il giorno. Per garantire che i requisiti di glucosio e insulina siano regolati in modo sicuro e senza lacune, l’insulina viene somministrata ai bambini durante i pasti dagli assistenti. Il resto del tempo, l’algoritmo assicura che il valore target di glucosio programmato (di solito 100 mg/dl) venga raggiunto e rimanga stabile. Questo fornirà un sollievo significativo alle famiglie.
Per testare la sicurezza e l’efficacia del sistema AID ibrido, è stato confrontato con la terapia con pompa di insulina assistita da sensori in uno studio. I bambini partecipanti hanno utilizzato prima il sistema controllato dall’app per 16 settimane e poi la terapia convenzionale con pompa di insulina assistita da sensore per 16 settimane. L’analisi dei dati ha mostrato che il tempo nell’intervallo di glucosio target (70-180 mg/dl) poteva essere aumentato in modo significativo con il sistema AID semi-automatico. I livelli di glucosio dei bambini sono rimasti nel range target per altri 125 minuti al giorno. Questo ha portato a una riduzione del valore di HbA1c dello 0,7% nei pazienti giovani che erano già ben controllati. Inoltre, il tempo con livelli elevati di glucosio nel sangue è stato ridotto di 9 punti percentuali. Il miglioramento del controllo del glucosio si è verificato senza un aumento dell’ipoglicemia.
I sistemi AID stanno per entrare nella terapia standard
Si stima che tra poco meno di 9 anni il 50% dei pazienti con diabete di tipo 1 utilizzerà un sistema AID, e tra circa 17 anni addirittura il 90%, ha spiegato il dottor Jens Kröger, diabetologo di Amburgo e presidente di diabetesDE – Deutsche Diabeteshilfe. Anche i bambini molto piccoli, di età inferiore ai sette anni, possono essere aiutati da sistemi come CamAPS FX. Tuttavia, le prove sono più elevate per gli adulti e per i bambini e gli adolescenti di età superiore ai sette anni.

In linea di principio, i sistemi AID dovrebbero essere offerti a tutti i pazienti con diabete di tipo 1, ma soprattutto alle persone con un controllo del glucosio non ottimale, ipoglicemia problematica e/o una significativa variabilità del glucosio e una ridotta qualità di vita (Tabella 1). I sistemi erano adatti anche alle persone con livelli da moderati a elevati di ipoglicemia grave e di inconsapevolezza ipoglicemica (Tabella 2).
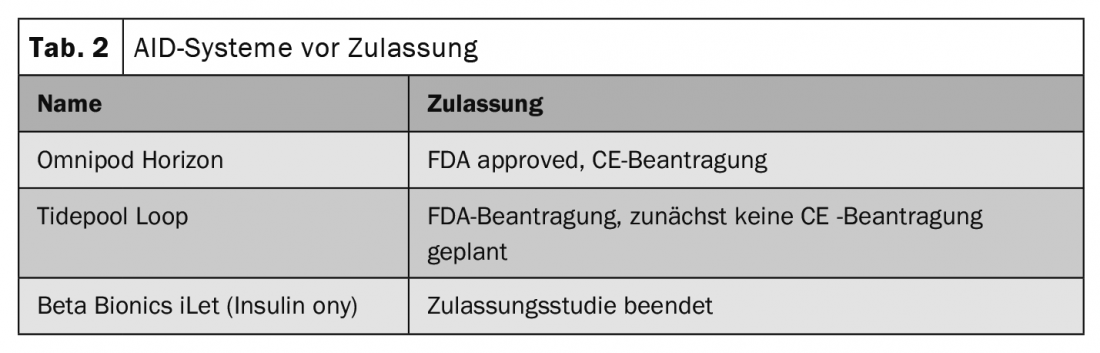
I singoli sistemi differiscono in termini di vita utile per sensore e di tipo di algoritmo. Non tutti hanno un’uscita di bolo di correzione. I sistemi AID possono avere un impatto favorevole sulla prognosi perché funzionano per la maggior parte delle persone con diabete di tipo 1, anche se non possono ancora prevedere l’efficacia. Inoltre, non ci sono chiare differenze tra individui con un controllo glicemico ottimale/subottimale in termini di effetto. Tuttavia, una durata più breve del diabete e un livello di istruzione più elevato sono vantaggiosi per la prognosi. Inoltre, il successo dipende dalla configurazione personalizzata e anche dall’assistenza al paziente.
I sistemi AID non sono privi di formazione
Da parte degli operatori sanitari, secondo Kröger, devono essere riconosciuti e superati i pregiudizi sociali e/o razziali eventualmente esistenti in relazione alle caratteristiche individuali, familiari e psicologiche necessarie per un uso efficace dei sistemi di aiuto. Questo è l’unico modo per garantire un accesso giusto ed equo ai sistemi AID. I pazienti hanno bisogno di un pre-training sull’autogestione generale del diabete, di una conoscenza di base del microinfusore di insulina e della terapia rtCGM, di un’introduzione tecnica personalizzata al sistema e di un’assistenza di follow-up. Questo è importante, tra l’altro, perché le difficoltà di gestione del sistema AID sono spesso alla base dell’interruzione della terapia. Questi includono, per citarne solo alcuni, problemi di calibrazione del sensore, troppi allarmi, interferenze del sistema durante la notte, troppo tempo impiegato. Anche le idee sul successo della terapia sono diverse. Il predicato “successo” potrebbe riferirsi a un TIR >70%, al valore di HbA1c, all’evitamento di eventi ipoglicemici gravi o anche a un funzionamento psicosociale positivo. Secondo Kröger, il successo in questo caso non dovrebbe essere definito solo dai parametri clinici.
Congresso: DDG 2022
CARDIOVASC 2022; 21(3): 28-29