La sindrome dell’intestino corto (SBS) è una forma di insufficienza intestinale che si verifica dopo un intervento chirurgico di resezione intestinale estesa o a causa di altre limitazioni funzionali dei segmenti intestinali. A seconda dell’entità della restrizione, sono indicate altre forme di integrazione nutrizionale. Con l’aiuto di una terapia nutrizionale specifica, alcuni pazienti possono avere l’opportunità di alimentarsi nuovamente in modo autonomo per via orale.
La sindrome dell’intestino corto è una malattia rara, potenzialmente pericolosa per la vita, la cui prevalenza in Germania è stimata a 34 per milione di abitanti [1]. L’attuale linea guida S3 della Società Tedesca di Medicina Nutrizionale (DGEM) definisce l’insufficienza intestinale come l’incapacità di mantenere l’equilibrio di proteine, energia, liquidi e micronutrienti a causa di una limitata capacità di assorbimento dell’intestino (ostruzione, dismotilità, malattia congenita, assorbimento ridotto associato alla malattia) [2]. La sindrome dell’intestino corto è una forma di insufficienza intestinale che si verifica dopo un intervento chirurgico di resezione intestinale estesa o a causa di altre limitazioni funzionali dei segmenti intestinali. Le cause più comuni includono il carcinoma, l’infarto mesenterico, la malattia di Crohn e l’emorragia post-operatoria [3].
La KDS è clinicamente indicata non appena la lunghezza dell’intestino rimanente è inferiore a 200 cm [4]. L’entità della malnutrizione e i sintomi individuali dipendono da quale sezione dell’intestino è colpita e in che misura, soprattutto perché le sostanze vengono assorbite in modo diverso a seconda della sezione. Anche i processi adattativi, la malattia di base e la comorbilità hanno un’influenza [5].
Tipizzazione e integrazione nutrizionale
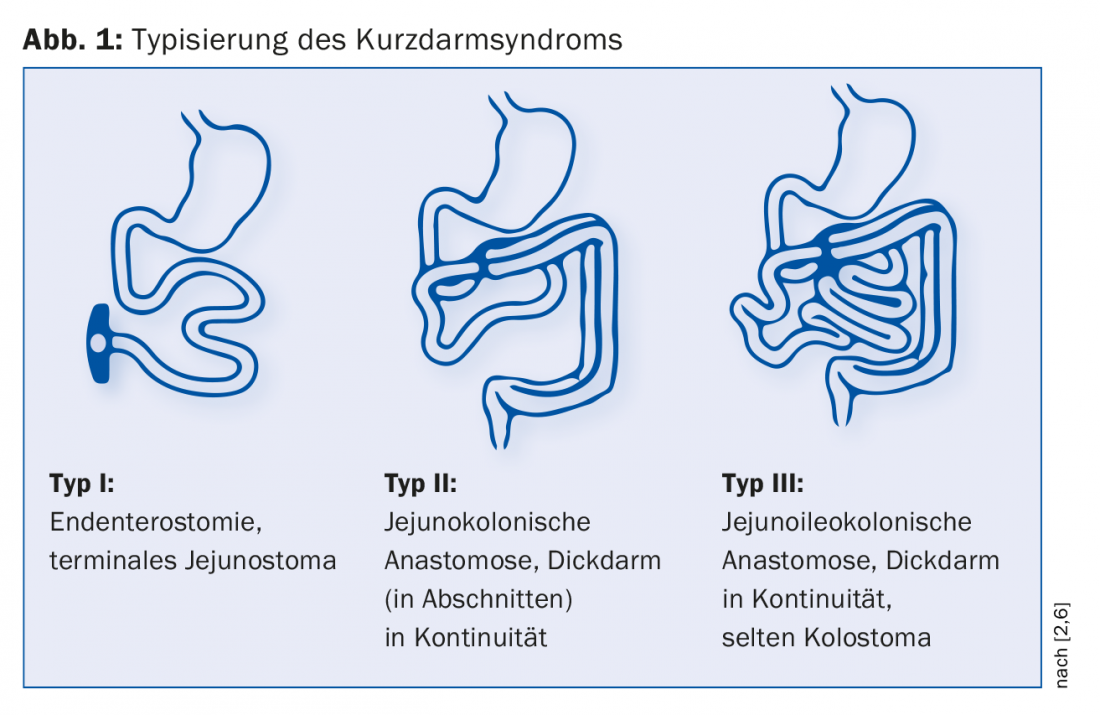
Secondo Messing, si distinguono tre tipi di KDS post-operatorio (Fig. 1) [6]. L’endenterostomia rappresenta il caso più difficile a causa dell’assenza dell’ileo e del colon. “Ci sono grandi problemi, come la disidratazione con un’elevata uscita dallo stoma”, spiega il dottor Krieger-Grübel. Quale tipo è presente influenza in modo significativo il decorso della malattia: “Se c’è meno di un metro di intestino tenue residuo con uno stoma intestinale terminale, i pazienti dipendono dalla nutrizione parenterale e dalle soluzioni saline. Se invece hanno a disposizione più di un metro di intestino tenue e il colon è presente in continuità, probabilmente non hanno bisogno di un trattamento nutrizionale di supporto a lungo termine”. L’influenza della lunghezza dell’intestino rimanente sulla mortalità è stata dimostrata in uno studio: Dopo cinque anni, la probabilità di sopravvivenza dei pazienti con colon in continuità era superiore del 30% rispetto a quella dei pazienti con endenterostomia [6].
Terapia nutrizionale specifica per la fase
L’obiettivo principale è garantire l’equilibrio dei fluidi e dei nutrienti e la profilassi delle complicanze. A seconda delle condizioni del tratto gastrointestinale, i pazienti dovrebbero anche essere messi in grado di alimentarsi di nuovo autonomamente per via orale con una terapia appropriata [7].
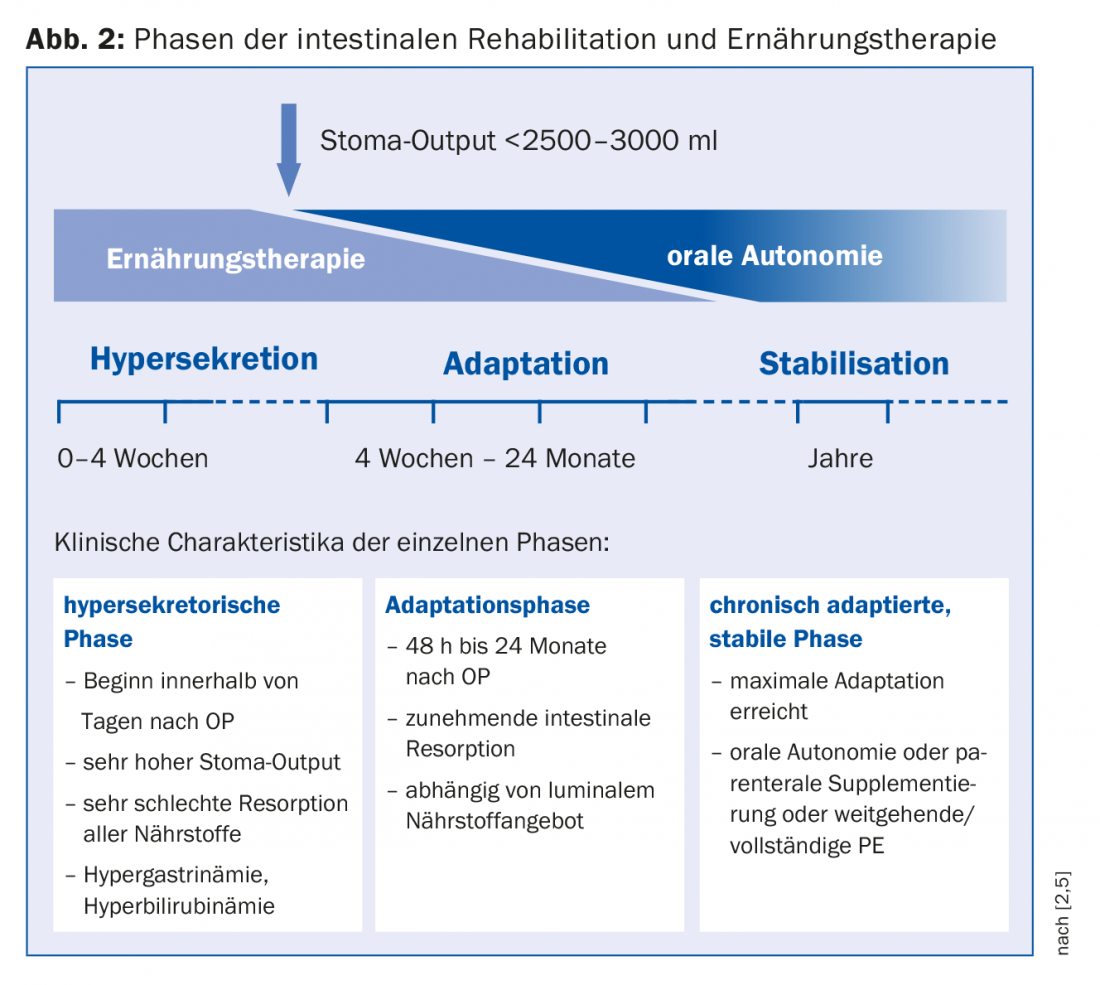
Per la pianificazione della terapia, è adatta una divisione in fase di ipersecrezione, fase di adattamento e fase di stabilizzazione, in cui queste fasi si fondono l’una nell’altra (Fig. 2) [1]. Ogni fase richiede una strategia nutrizionale specifica. Subito dopo l’intervento chirurgico, si verifica un’ipersecrezione sotto forma di stoma ad alto rendimento e diarrea. In questo caso, la nutrizione parenterale (PE) è inevitabile a causa del malassorbimento di tutti i nutrienti. Il monitoraggio dell’omeostasi dei fluidi è centrale. Per verificare lo stato di idratazione (sono necessari 15 ml di liquidi/kg di peso corporeo per espellere le sostanze urinarie), il sodio è adatto come parametro sensibile, per cui una quantità di >20 mmol/l è considerata sufficiente. Quando l’uscita dallo stoma può essere ridotta (<2500-3000 ml), si può iniziare l’alimentazione orale. “La nutrizione enterale è l’effettivo innesco della proliferazione cellulare”, sottolinea il dottor Krieger-Grübel. Porta alla crescita delle cellule, all’aumento dei villi e, grazie all’incremento del flusso sanguigno intestinale, a una migliore capacità di assorbimento. Tuttavia, dato che in linea di principio ci si deve aspettare una maggiore richiesta di energia, la PE non deve essere interrotta in una fase iniziale [8]. Le raccomandazioni per la terapia nutrizionale orale nella fase di adattamento sono riassunte nella Tabella 1. “Per la reidratazione, la combinazione di sodio e glucosio è estremamente importante, perché l’assorbimento del glucosio nella cellula è accoppiato al sodio”. I liquidi devono quindi essere salati. Per un succo di mela diluito 1:3, ci sarebbero poco meno di 5 g di sale (1 cucchiaino), che corrisponde a circa 100 mmol. In caso di malassorbimento dei grassi, la somministrazione di acidi grassi a catena media è indicata se il colon è conservato. Ulteriori complicazioni con un colon conservato, come i calcoli renali, possono essere prevenute con un aumento dell’assunzione di calcio, che è responsabile di legare l’ossalato, oltre che con una riduzione di principio degli alimenti contenenti ossalato.

Farmaci
L’obiettivo delle misure farmaceutiche è ridurre la secrezione e rallentare la motilità. Effetto antisecretorio, per esempio. Inibitori della pompa protonica, che inibiscono la H+/K+-ATPasi nella cellula vestibolare, o analoghi della somatostatina. L’Octreotide, ad esempio, inibisce vari peptidi, ormoni e la secrezione pancreatica, ma determina anche una riduzione del flusso sanguigno e dell’assorbimento del cibo.
La loperamide viene utilizzata per prima cosa contro l’aumento della motilità. Se l’effetto è troppo limitato, si può somministrare successivamente la tintura di oppio. La loperamide e la tintura di oppio ottengono il loro effetto stimolando i recettori oppioidi gastrointestinali. La motilità propulsiva viene bloccata, con conseguente aumento del riassorbimento di liquidi, diminuzione della secrezione e aumento del tono dello sfintere anale [9]. Altre opzioni farmacologiche includono la colestiramina (diarrea cologenica in continuità colonica), gli enzimi pancreatici nella steatorrea e le fibre solubili per legare ulteriormente il liquido intestinale. Un nuovo studio mostra un effetto di teduglutide nei pazienti senza colon e con stoma: in questo gruppo di pazienti, l’assunzione di liquidi parenterali è stata ridotta del 40%, mentre il gruppo placebo ha ottenuto solo una riduzione del 19%; al contrario, non c’è stato alcun effetto nei pazienti con colon in continuità [11].
Fonte: Congresso di primavera della SGAIM, 30 maggio-1 giugno 2018, Basilea.
Letteratura:
- Websky MW, et al: La sindrome dell’intestino corto in Germania. Stima della prevalenza e situazione assistenziale. Chirurg 2014; 85(5): 433-439.
- Lamprecht G, et al.: S3-Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin e.V. in Zusammenarbeit mit der AKE, der GESKES und der DGVS. Nutrizione clinica in gastroenterologia (parte 3) – Insufficienza intestinale cronica. Current Nutritional Medicine 2014; 39(2): e57-e71.
- Krafft T, et al: Esito a lungo termine nell’insufficienza intestinale cronica: caratteristiche, prognosi e complicanze. Z Gastroenterol 2013; 51: K285.
- Pironi L, et al: Linee guida ESPEN sull’insufficienza intestinale cronica negli adulti. Nutrizione clinica 2016; 35(2): 247-307.
- Karber M, et al: Insufficienza intestinale cronica e sindrome dell’intestino corto. Compendio Nutrizione Parenterale Domiciliare (HPE). Linee guida KDS Charité Berlino. 2015.
- Messing B, et al.: Sopravvivenza a lungo termine e dipendenza dalla nutrizione parenterale nei pazienti adulti con la sindrome dell’intestino corto. Gastroenterol 1999; 117(5): 1043-1050.
- O’Keefe SJ, et al: Sindrome dell’intestino corto e insufficienza intestinale: definizioni di consenso e panoramica. Clin Gastroenterol Hepatol 2006; 4: 6-10.
- Leuenberger M, et al: La sindrome dell’intestino corto: una sfida interdisciplinare. Medicina nutrizionale attuale 2006; 31: 235-242.
- Dorfschmid M, Sinik-Agan C: Insufficienza intestinale – terapia nutrizionale nella sindrome dell’intestino corto. Schw Z Ernährungsmed 2017; 1: 10-18.
- Jeppesen PB, et al: Fattori associati alla risposta al teduglutide nei pazienti con sindrome dell’intestino corto e insufficienza intestinale. Gastroenterol 2018; 154(4): 874-885.
- Matarese LE: Ottimizzazione della nutrizione e dei liquidi per i pazienti con sindrome dell’intestino corto. JPEN 2013; 37(2): 161-170.
HAUSARZT PRAXIS 2018; 13(7) – pubblicato il 8.6.18 (anticipato).











