L’uso dei quattro test multigene MammaPrint, Oncotype DX, EndoPredict e Prosigna può essere utile per decidere la chemioterapia adiuvante. In quali pazienti in particolare dovrebbero essere utilizzati?
Fortunatamente, il tasso di mortalità per il carcinoma mammario è diminuito negli ultimi decenni. I motivi sono la diagnosi più precoce dei carcinomi mammari, le nuove sostanze e anche il frequente utilizzo della chemioterapia adiuvante. Si pone ora la questione se la terapia possa essere de-escalata in alcuni pazienti [1].
Decisione basata su fattori di rischio clinici e patologici
La decisione su quale paziente dovesse ricevere la chemioterapia adiuvante e quale no, veniva presa in precedenza sulla base di fattori di rischio clinici e patologici, come le dimensioni del tumore, lo stato linfonodale, il grado del tumore, il tasso di proliferazione, l’espressione del recettore ormonale e lo stato Her2.
Per i carcinomi triplenegativi (“basal-like”) e per i tumori Her2-positivi, è indiscusso che si debba somministrare la chemioterapia adiuvante. Di solito hanno un alto tasso di proliferazione e tendono a crescere in modo più aggressivo. Entrambi i gruppi di solito rispondono bene alla chemioterapia.
La decisione è un po’ più difficile nel caso dei tumori luminali A ben differenziati, positivi al recettore degli estrogeni (ER), e dei tumori luminali B scarsamente differenziati, che sono più difficili da distinguere l’uno dall’altro. Finora, per la differenziazione è stato utilizzato il tasso di proliferazione, determinato con l’aiuto di un’immunocolorazione KI-67 non sempre affidabile.
Test di espressione multigenica
Per poter determinare con maggiore certezza quale paziente debba ricevere la chemioterapia in aggiunta alla terapia antiormonale nel grande gruppo di carcinomi mammari positivi ai recettori ormonali, è necessario poter prevedere meglio e in modo più individuale il rischio.
Ad esempio, lo sviluppo dei microarray di cDNA è iniziato circa 20 anni fa, per studiare l’espressione genica dei tumori in modo più dettagliato. Con questi array, è stato possibile determinare simultaneamente l’espressione di circa 500 geni. Si è scoperto che i tipi di carcinoma mammario biologicamente diversi possono anche essere distinti l’uno dall’altro sulla base del modello di espressione genica.
Sulla base di questi studi, sono stati sviluppati test di espressione multigenica per l’uso clinico di routine, che si limitano ai geni più importanti, necessari per distinguere tra tipi di tumore prognosticamente diversi e consentire di prendere decisioni terapeutiche individuali.
Quattro di questi test di espressione multigenica sono ora disponibili in Svizzera (Tab. 1) [2–4]:
- MammaPrint: il test viene eseguito centralmente su materiale tumorale congelato o fissato in formalina ed esamina l’espressione genica di 70 geni. MammaPrint distingue il rischio prognostico basso da quello alto.
- Oncotype DX: il test viene eseguito centralmente negli Stati Uniti su materiale incluso in paraffina ed esamina l’espressione di 21 geni. È prognostico per il rischio di recidiva nei primi cinque anni e fornisce un valore numerico tra 0 e 100 (“punteggio di recidiva”) come misura del rischio di recidiva. Sulla base di Oncotype DX, sono possibili anche affermazioni sull’efficacia delle chemioterapie [2,3].
- EndoPredict: il test viene eseguito a livello decentrato, sempre in Svizzera, su tessuto fissato in formalina o incluso in paraffina, analizza l’espressione mRNA di 12 geni e include parametri clinicopatologici (dimensioni del tumore, numero di linfonodi ascellari interessati). Quindi non si tratta di un test genetico puro. L’importanza prognostica per la previsione delle metastasi precoci e tardive è stata convalidata.
- Prosigna: il test esamina l’espressione di 50 geni e può essere eseguito anche localmente con le attrezzature di laboratorio appropriate. È stato sviluppato per determinare il sottotipo biologico, ma può essere utilizzato anche a livello prognostico, stimando il rischio individuale di ricaduta del paziente.
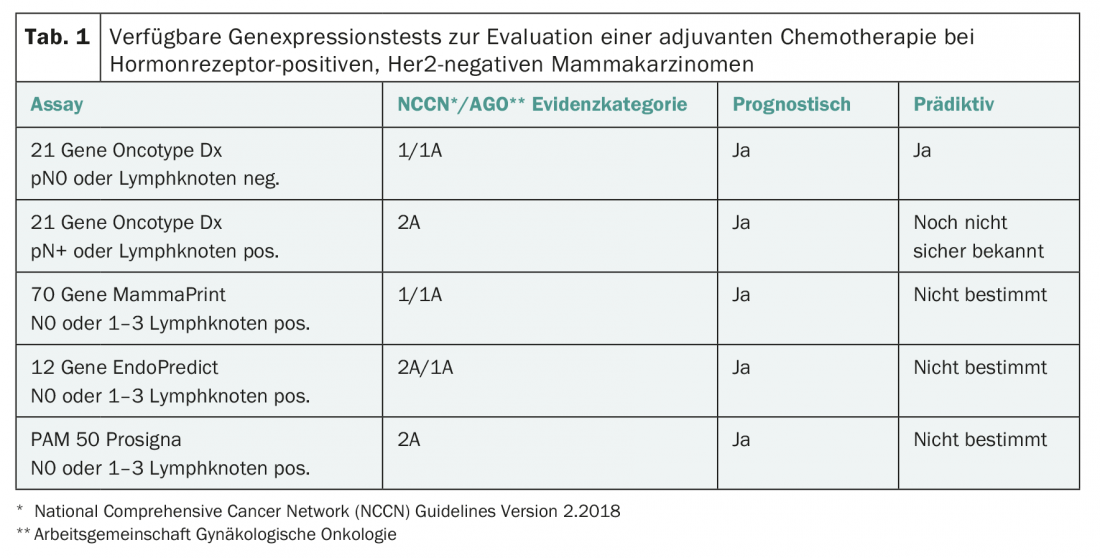
L’importanza prognostica di tutti e quattro i test è stata dimostrata in studi retrospettivi. Ora ci sono anche dati prospettici per Oncotype DX e MammaPrint (TAILORx, Mindact [5,6]). Tutti e quattro i test sono raccomandati dalle linee guida internazionali (ASCO, linee guida ESMO, AGO, Consenso di San Gallo [1]) come test prognostici e sono ora rimborsati dalle compagnie di assicurazione sanitaria. Tuttavia, non è detto che i risultati dei diversi test siano correlati al 100%. Ad esempio, un confronto tra EndoPredict e Oncotype DX ha rilevato un accordo significativo ma piuttosto moderato dei risultati, pari al 76% [7].
Quando è utile la chemioterapia?
Si pone ora la questione di quale sia il gruppo di rischio definito da questo test di espressione genica, per il quale ha senso la chemioterapia adiuvante. Questa domanda è in corso di approfondimento negli studi TAILORx e Mindact, attualmente pubblicati.
Lo studio TAILORx [5] è uno studio prospettico condotto con il test a 21 geni, Oncotype DX. Sono state incluse 10 273 donne con carcinoma mammario positivo al recettore ormonale, Her2-negativo, senza coinvolgimento linfonodale. Il risultato del test fornisce un “punteggio di recidiva” (RS) compreso tra 1 e 100, dove un valore compreso tra 1 e 11 predice un basso rischio di recidiva per il quale non è indicata la chemioterapia, e un valore >25 indica un rischio elevato per il quale la chemioterapia sembra essere consigliabile. C’era ambiguità tra le donne con un rischio mediano tra 11 e 25, che riguardava la maggior parte delle pazienti (69%). Questo gruppo di 9719 donne è stato randomizzato in due bracci di studio con e senza chemioterapia. Tutte le pazienti hanno ricevuto una terapia anti-ormonale adiuvante. Il periodo medio di osservazione è stato di nove anni. Dopo questo periodo, entrambi i gruppi di trattamento avevano tassi simili di sopravvivenza libera da malattia, ossia l’83,3% nel gruppo trattato esclusivamente con ormoni e l’84,3% nel gruppo che aveva ricevuto anche la chemioterapia. Non c’è stata alcuna differenza nella sopravvivenza globale (93,9% vs. 93,8%), soprattutto nelle donne di età superiore ai 50 anni. Nei pazienti di età superiore ai 50 anni e con un RS di 0-25, si può quindi ritenere che la chemioterapia non apporti alcun beneficio aggiuntivo. Tra i pazienti più giovani, soprattutto quelli con un RS di 21-25, circa il 6,5% ha beneficiato della chemioterapia.
Lo studio Mindact [6] è stato condotto con la firma di 70 geni MammaPrint. Questo test distingue i tumori a basso rischio genetico da quelli ad alto rischio genetico per la comparsa di metastasi a distanza dopo cinque e dieci anni. Mindact è uno studio di fase III che studia l’utilità di un microarray (MammaPrint) come informazione aggiuntiva ai fattori di rischio clinici nella decisione individuale sull’uso della chemioterapia adiuvante. In 6693 donne, il rischio genetico è stato determinato con MammaPrint e il rischio clinico è stato determinato con l’aiuto di “Adjuvant Online”, tenendo conto dei fattori di rischio classici. Quando il rischio clinico e genetico corrispondevano, il trattamento era chiaro: i pazienti con basso rischio genetico e basso rischio clinico non ricevevano alcuna chemioterapia, mentre i pazienti con alto rischio genetico e alto rischio clinico ricevevano la chemioterapia. Le pazienti con rischio discordante, cioè alto genetico e basso clinico o viceversa, sono state randomizzate in due gruppi di trattamento con e senza chemioterapia in aggiunta alla terapia antiormonale. Si è scoperto che la somministrazione della chemioterapia non ha fatto una differenza significativa nella sopravvivenza libera da malattia nei gruppi discordanti. Esaminando il gruppo di 1550 pazienti con alto rischio clinico e basso rischio genetico, c’è solo una differenza dell’1,5% nella sopravvivenza libera da recidiva a distanza (DRFS) dopo cinque anni a favore della chemioterapia. I pazienti con basso rischio clinico e alto rischio genetico non hanno beneficiato della chemioterapia in termini di DRFS. Pertanto, da questo studio si può trarre la conclusione che si dovrebbe offrire il test genetico solo ai pazienti con un rischio clinico elevato e si può quindi risparmiare la chemioterapia ai pazienti con un rischio genetico basso, a meno che i pazienti non insistano sulla chemioterapia per ridurre il rischio di ricaduta di un altro 1,5%. Tuttavia, questi pazienti non hanno bisogno di un test genetico.
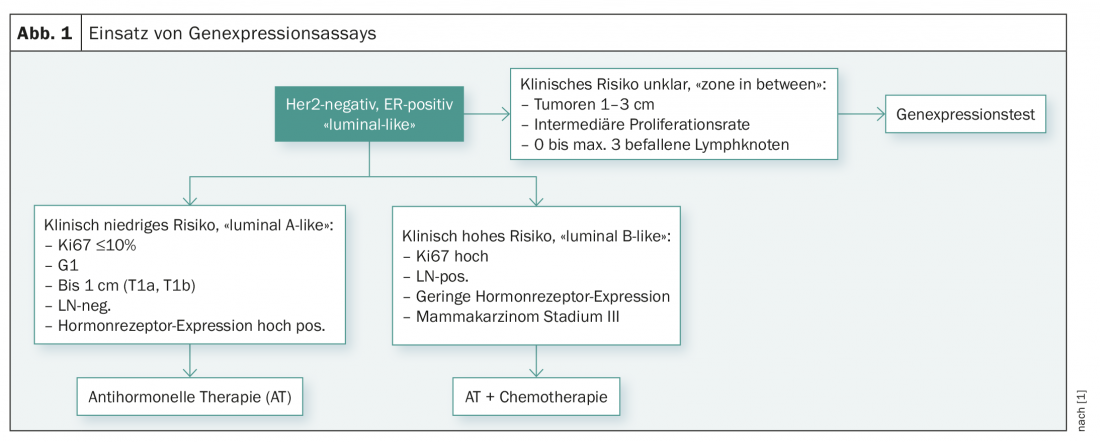
Riunione di consenso di San Gallo 2017
Alla Riunione di Consenso di San Gallo del 2017 a Vienna, sono stati discussi anche questi studi e l’uso di test multigenici [1]. Gli esperti attualmente vedono l’indicazione dei test genetici solo per rispondere alla domanda se un paziente ha bisogno o meno della chemioterapia adiuvante. Secondo l’attuale raccomandazione di consenso, il test genetico non dovrebbe essere eseguito nei casi di basso rischio clinico (pT1a/b, G1, ER elevato, N0, basso tasso di proliferazione) e nei casi di rischio clinico chiaramente elevato (bassa espressione del recettore ormonale, G3, alto tasso di proliferazione, coinvolgimento di molti linfonodi o stadio III). Il gruppo di esperti ha ritenuto utile il test genetico solo nelle pazienti con un profilo di rischio clinico non del tutto chiaro (dimensioni del tumore 1-3 cm, coinvolgimento di 0-3 linfonodi ascellari e tasso di proliferazione intermedio) (Fig. 1).
Letteratura:
- Curigliano G, et al: De-escalation e escalation dei trattamenti per il cancro al seno in fase iniziale: la St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Annals of Oncology 2017; 28: 1700-1712.
- Paik S, et al: Un test multigenico per predire la recidiva del cancro al seno trattato con tamoxifene e con nodo negativo. N Engl J Med 2004; 351(27): 2817-2826.
- Paik S, et al: Espressione genica e beneficio della chemioterapia nelle donne con cancro al seno nodo-negativo, positivo al recettore degli estrogeni. J Clin Oncol 2006; 24: 3726-3734.
- Markopoulos C, et al: Evidenze cliniche a sostegno dei test genomici nel cancro al seno precoce: tutti i test genomici forniscono le stesse informazioni? EJSO 2017; 43: 909-920.
- Sparano JA, et al: Chemioterapia adiuvante guidata da un test di espressione di 21 geni nel cancro al seno. N Engl J Med 2018; 379: 111-121.
- Cardoso F, et al: La firma dei 70 geni come aiuto alle decisioni terapeutiche nel cancro al seno in fase iniziale. N Engl J Med 2016; 375(8): 717-729.
- Varga Z, et al: Confronto tra i risultati dei test EndoPredict e Oncotype DX nel cancro al seno invasivo positivo ai recettori ormonali. PLOS ONE 2013; 8(3): e58483.
- Lux MP, et al.: Analisi dell’impatto economico dei test di espressione genica per aiutare le decisioni terapeutiche delle pazienti con cancro al seno in Germania. Il Seno 2018; 37: 89-98.
Ulteriori letture:
- Sørlie T, et al.: I modelli di espressione genica dei carcinomi mammari distinguono le sottoclassi tumorali con implicazioni cliniche. PNAS 2001; 98(19): 10869-10874.
InFo ONcOLOGIA & EMATOLOGIA 2018; 6(6): 26-29.











