Le terapie oncologiche sono in rapido sviluppo, il che significa che è disponibile un gran numero di nuove sostanze che devono essere identificate non solo in termini di potenziali utilizzi, ma anche in termini di effetti avversi prevedibili. In linea con la natura di molte chemioterapie classiche in oncologia, sono soprattutto i tessuti in rapida divisione a subire gli effetti negativi. Negli ultimi anni, tuttavia, è stato possibile rendere il sistema immunitario terapeuticamente utile contro le cellule maligne. Questo comporta un nuovo spettro di effetti collaterali che differisce chiaramente nello sviluppo e nella presentazione clinica dalla chemioterapia classica.
Alopecia
L’alopecia è l’effetto collaterale più comune della chemioterapia, che si verifica in circa la metà delle terapie. In questo caso, l’efluvium distrofico anagen si verifica più frequentemente a causa della brusca interruzione del ciclo del follicolo pilifero, come risultato dell’effetto tossico sui cheratinociti in rapida divisione nella matrice epiteliale del bulbo pilifero. La gravità dell’alopecia dipende dalla dose del farmaco, dall’emivita del principio attivo e dalla durata dell’intera terapia. Le cause principali sono gli alchilanti, le antracicline, gli antibiotici tumorali e gli inibitori della topo-isomerasi [1]. Poiché le cellule staminali si dividono lentamente, di solito non vengono colpite e l’alopecia è solitamente reversibile. Le eccezioni possono essere le terapie ad alte dosi con Endoxan e Busulfan in combinazione con l’irradiazione totale del corpo in preparazione di un trapianto di midollo osseo.
Il raffreddamento del cuoio capelluto è un possibile intervento preventivo [2]. Nell’ambito di uno studio di fattibilità presso il Breast Centre di Zurigo, è stato studiato il raffreddamento controllato del cuoio capelluto con un sistema di cuffia di raffreddamento (Sysmex DigniCap®) durante la somministrazione di farmaci citostatici (Fig. 1).
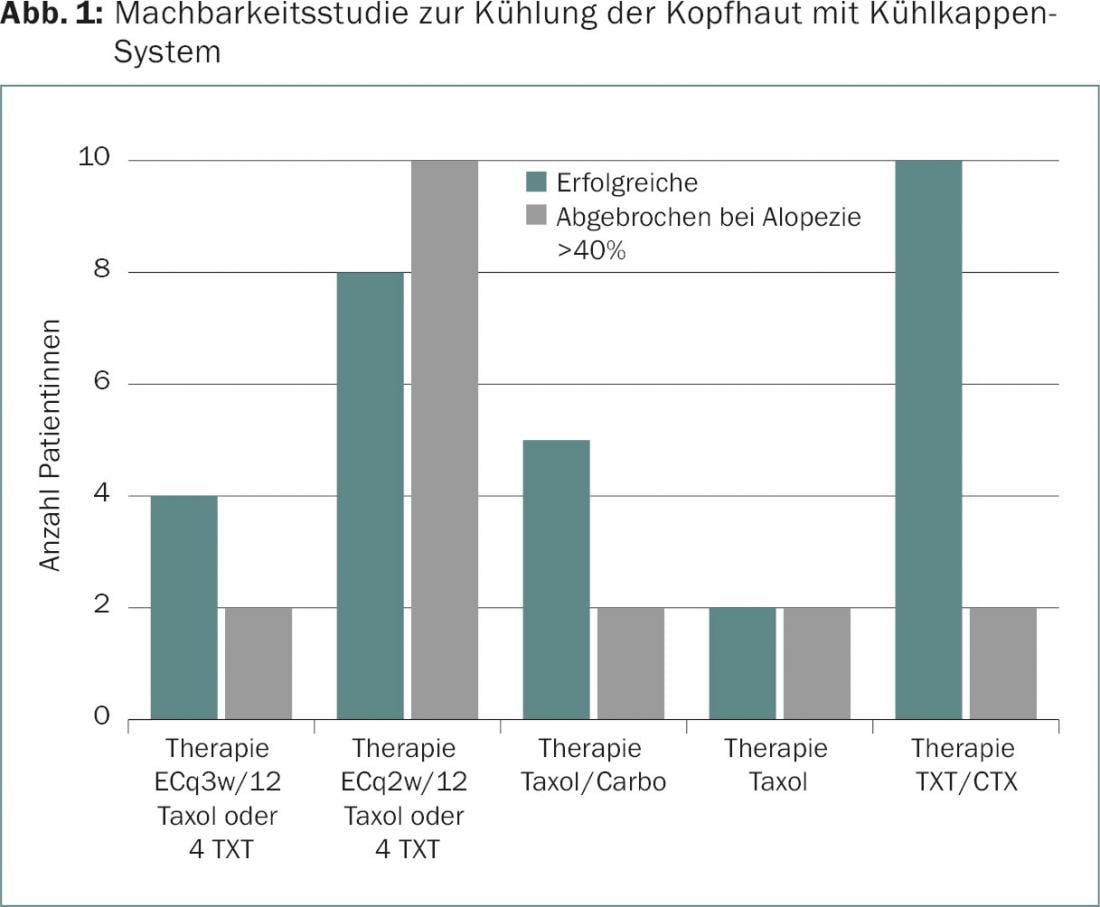
La modalità d’azione si basa da un lato sulla costrizione dei vasi sanguigni del cuoio capelluto e sulla riduzione associata della quantità di farmaco che raggiunge le radici dei capelli. Inoltre, l’assorbimento di sostanze tossiche nelle cellule pilifere viene ridotto dalle basse temperature. In un’analisi intermedia, i pazienti non hanno mostrato effetti collaterali rilevanti o solo transitori, come mal di testa, sensazione di freddo, pesantezza della testa, dolore al collo e arrossamento della pelle. Secondo gli studi disponibili, il timore che le metastasi del cuoio capelluto si verifichino più frequentemente in seguito al trattamento di raffreddamento del cuoio capelluto non è giustificato, in quanto le metastasi non si sono verificate più frequentemente nei periodi di osservazione specificati rispetto alla chemioterapia senza raffreddamento del cuoio capelluto [3]. A seconda della composizione della chemioterapia, i capelli del cuoio capelluto potevano essere conservati con successo e in modo estetico in più della metà dei pazienti.
Tossicità per la pelle e le mucose
Farmaci citostatici: Soprattutto gli antimetaboliti (5-FU, MTX, Pemetrexed) e gli antibiotici tumorali (DOX, IDA, EPR, BLE), ma anche i taxani causano una stomatite dose-dipendente. Di solito guarisce spontaneamente, anche se l’aplasia può portare a infezioni complicate. Ulteriori fattori di rischio sono la malattia parodontale, la carie, lo scarso stato nutrizionale e la xerostomia come conseguenza della radioterapia. Altre sostanze tossiche per la mucosa possono provocare cistite (ciclofosfamide, ifosfamide, raramente etopofos) o enterite (5-FU, capecitabina, irinotecan, metotrexato, raltitrexet, raramente epifillotossina, citosina arabinoside e cisplatino). Sostanze come l’antifolato pemetrexed (Alimta®), utilizzato in terapie mono o combinate, producono effetti collaterali mucocutanei (esantema 30%, mucosite e diarrea 5%) [4]. Sebbene gli effetti collaterali cutanei siano spesso segnalati in modo non specifico come “rash cutanei”, si possono osservare risultati e diagnosi specifiche. Si verificano quindi alopecia, vasculite orticaria, pustolosi esantematica acuta generalizzata, necrolisi epidermica tossica, dermatite di richiamo da radiazioni e pitiriasi lichenoide. I cambiamenti cutanei di solito compaiono poco dopo l’inizio della terapia [5].
Inibitori dell’EGFR: gli inibitori dell’EGFR come erlotinib, gefitinib, cetuximab o panitumumab sono stati utilizzati con successo per diversi tumori solidi per diversi anni. L’esantema papulo-pustoloso caratteristico, la paronichia, lo xeroderma, il prurito e l’alopecia si verificano nel 50-100% dei pazienti [6,7]. La combinazione di lapatinib (Tyverb®; pan-HER TKI) e capecitabina (antifolato) porta regolarmente a cambiamenti lievi e talvolta gravi della pelle e delle membrane mucose. Questo include eruzione cutanea (47%), prurito, paronichia e stomatite, ma anche pustole, sindrome mano-piede (54%), vesciche, nonché diarrea (grado 3-4, fino al 20%) e polmonite interstiziale, e richiede una gestione proattiva nonché un consulto dermatologico con chiarimenti sull’allergia ai farmaci [8].
Inibitori CDK4/6: un’altra classe di sostanze promettenti sono gli inibitori CDK4/6 (chinasi ciclina-dipendente), che vengono utilizzati nel tumore al seno in combinazione con gli anti-ormoni, come gli inibitori dell’aromatasi, e sono anche utilizzati per un sottotipo di liposarcoma [9]. Tra la prima generazione di questi inibitori, il flavopiridolo è la sostanza meglio studiata. Le tossicità corrispondono a quelle dei farmaci citostatici classici, con infiammazione nel sito di infusione, effetti collaterali gastrointestinali e neutropenia grave.
Un inibitore più recente in fase di studio clinico è, ad esempio, palbociclib, che ha ottenuto l’approvazione della FDA dal febbraio 2015 come terapia di prima linea per il tumore al seno ER+/Her2-negativo avanzato, in postmenopausa, in combinazione con letrozolo. Gli effetti collaterali sono stati da lievi a moderati, con la mielosoppressione che più spesso limitava la dose.
Inibitore m-TOR: l’uso dell’inibitore mTOR everolimus insieme al letrozolo (inibitore dell’aromatasi) è stato studiato anche nelle pazienti con cancro al seno, ad esempio nello studio Bolero 2 [10]. Formando un complesso con la proteina mTOR (“mammalian target of rapamycin”), questa viene inattivata. L’mTOR fa parte dei due complessi proteici mTORC1 e mTORC2, che, attraverso diverse vie di trasduzione del segnale, guidano, tra l’altro, la trascrizione e la traduzione di varie proteine e quindi la proliferazione delle cellule tumorali, ma anche dei linfociti T. L’inibizione di mTOR impedisce quindi sia l’attivazione che la progressione delle cellule T dalla fase G1 alla fase S del ciclo cellulare. La sopravvivenza libera da progressione dei pazienti, come endpoint primario, ha mostrato un chiaro vantaggio per la combinazione di entrambe le sostanze rispetto alla monoterapia con letrozolo. Tuttavia, è emerso uno spettro di effetti collaterali gravi. Nello studio BOLERO, la stomatite (56%), la diarrea (30%), l’eruzione cutanea (36%) e la polmonite non infettiva (12%) hanno dovuto essere trattate frequentemente e talvolta hanno portato all’interruzione della terapia. I pazienti devono quindi prestare attenzione all’igiene orale e utilizzare profilatticamente un collutorio e segnalare immediatamente i problemi respiratori.
Immunoterapia – inibitori del checkpoint: con il prolungamento della sopravvivenza globale nel melanoma metastatico grazie al trattamento con l’inibitore del checkpoint immunitario ipilimumab (anti-CTLA4, Yervoy®), nel 2010 è stato dato il segnale di partenza per la classe di sostanze degli inibitori del checkpoint, cioè gli anticorpi che bloccano i checkpoint CTLA-4, PD-1 e PD-1L (Fig. 2).
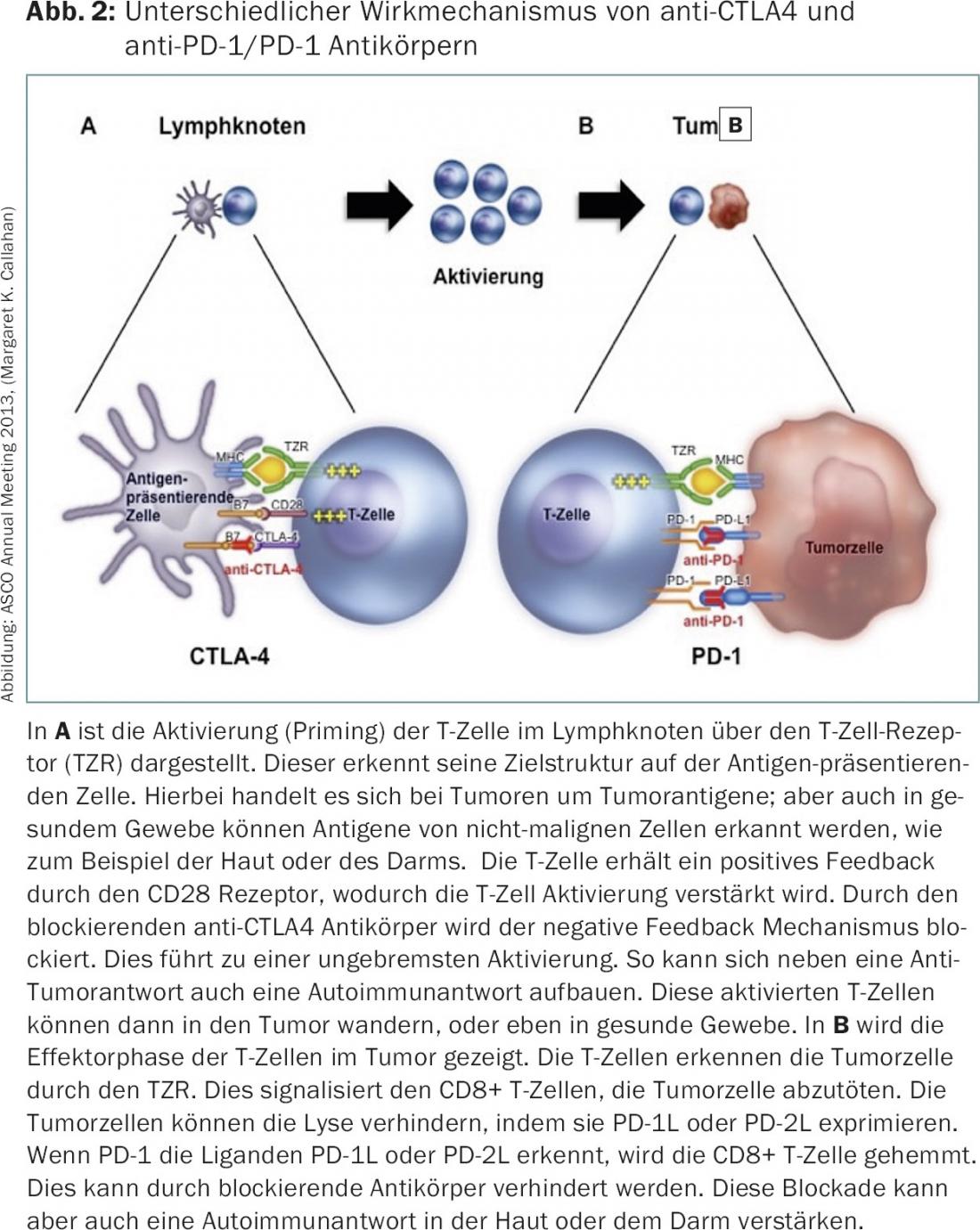
Gli inibitori del checkpoint sono stati finora utilizzati per diversi tumori, come i carcinomi bronchiali [11], i carcinomi a cellule renali [12], i melanomi [13], i tumori della testa e del collo [14] e i carcinomi della vescica [15]. Tuttavia, lo sviluppo iniziale è stato fortemente influenzato dai nuovi effetti collaterali degli inibitori del checkpoint e ha quasi impedito la loro storia di successo. In circa il 5-15% dei pazienti si sono verificati effetti collaterali gravi, che possono essere spiegati da un’attivazione del sistema immunitario contro i tessuti sani. In questo modo, si sviluppa un’autoimmunità indotta iatrogena, che colpisce in particolare la pelle e il tratto gastrointestinale. Entrambi i sistemi di organi sono caratterizzati anche in condizioni fisiologiche dal fatto che esiste un’intensa interazione tra il sistema immunitario e il sistema di organi. Per evitare che si sviluppi l’autoimmunità, i checkpoint sono di grande importanza in condizioni fisiologiche. Non sorprende quindi che il blocco dei checkpoint porti a effetti collaterali, soprattutto in questo caso.
Le alterazioni immunologiche della pelle nei pazienti con inibitori del checkpoint [16] comprendono prurito fino al 30%, esantema morbilliforme (10-50%) e depigmentazione simile alla vitiligine. L’esantema lieve può essere trattato con misure locali di cura della pelle e steroidi locali. Tuttavia, se si verificano esantemi maculo-papulari estesi ed eventualmente vesciche, soprattutto sulle membrane mucose, gli inibitori del checkpoint devono essere interrotti immediatamente e deve essere iniziata una terapia sistemica con steroidi. In caso di gravi effetti collaterali muco-cutanei, gli inibitori del checkpoint non devono essere reintrodotti. La riduzione della dose non è una misura per migliorare la tollerabilità, poiché non esiste una chiara relazione dose-risposta nella classe di sostanze degli inibitori del checkpoint. Questo vale in particolare per un sistema immunitario già attivato dagli inibitori del checkpoint. Per questo motivo, in caso di effetti collaterali gravi, l’inibitore del checkpoint deve essere sospeso fino a quando gli effetti collaterali non si sono attenuati. Dopodiché, si deve valutare attentamente un riavvio. Le lesioni cutanee meno comuni includono prurigo nodulare, esantema lichenoide, eruzioni papulo-pustolose, ulcere, fotosensibilità e richiamo da radiazioni [17].
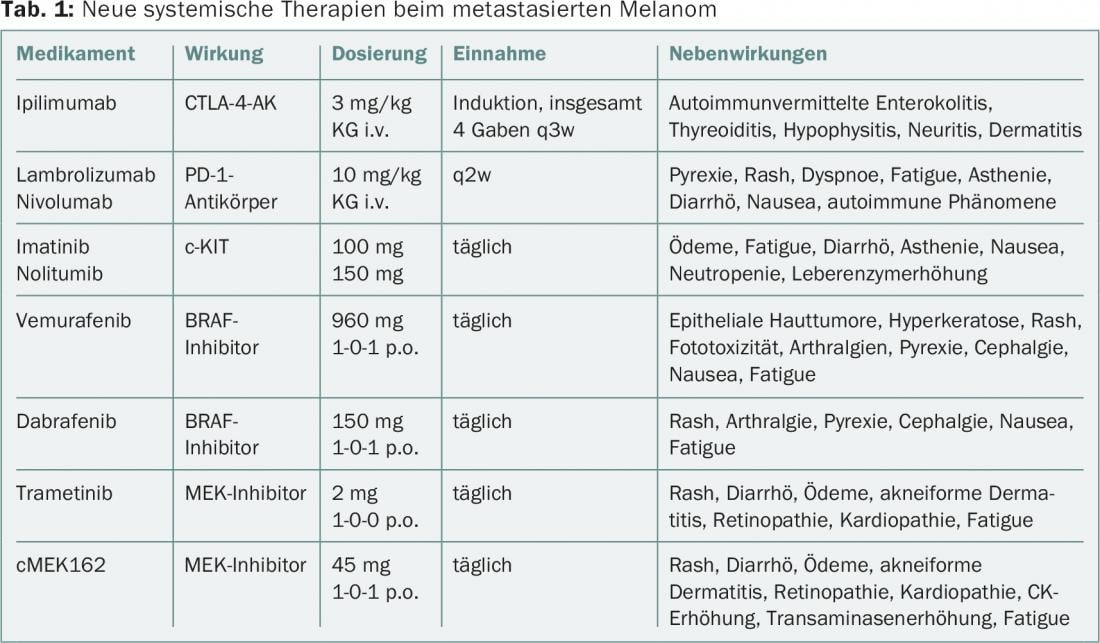
Nel melanoma, l’uso di terapie cosiddette “mirate” è stato rapidamente avanzato, tanto che oltre agli inibitori del checkpoint, ora si stanno testando anche terapie di combinazione [18]. Una panoramica delle terapie sistemiche, degli effetti e degli effetti collaterali, compresi quelli sulla pelle e sulle membrane mucose, è riportata nella tabella 1. Oltre alla cosiddetta eruzione cutanea, gli effetti collaterali cutanei possono includere anche dermatosi infiammatorie, cheratosi e neoplasie squamose benigne e maligne.
In conclusione, in caso di dubbio sull’insorgenza di tossicità mucocutanea da inibitori del checkpoint, la dose successiva deve essere saltata. Il decorso clinico determina poi quali misure devono essere avviate. Se c’è qualcosa di poco chiaro, è necessario contattare rapidamente l’oncologo curante. In futuro, potrebbe essere utile una registrazione tempestiva dei sintomi mediante sistemi elettronici e legati al paziente (APP) [19].
Letteratura:
- Chon SY, et al: Alopecia indotta dalla chemioterapia. J Am Acad Dermatol. 2012; 67: e37-47.
- Young A, et al: L’uso del raffreddamento del cuoio capelluto per la perdita di capelli indotta dalla chemioterapia. Br J Nurs. 2016; 25: S22.
- van den Hurk CJ, et al: Raffreddamento del cuoio capelluto per la conservazione dei capelli e caratteristiche associate in 1411 pazienti sottoposti a chemioterapia – risultati del Registro olandese di raffreddamento del cuoio capelluto. Acta Oncol. 2012; 51(4): 497-504.
- Trojan A, et al.: Effetti avversi della chemioterapia sulla pelle e sulle membrane mucose. Recensione. Praxis (Berna 1994). 2002; 91(24): 1078-87.
- Piérard-Franchimont C, et al: Rivisitazione delle reazioni avverse cutanee al pemetrexed. Oncol Lett. 2011; 2: 769-772.
- Gerber PA, et al: Terapia con inibitori del recettore del fattore di crescita epidermico. Spettro degli effetti collaterali cutanei Hautarzt. 2010; 61: 654-61.
- Macdonald JB, et al: Effetti avversi cutanei delle terapie mirate: Parte I: Inibitori della membrana cellulare. J Am Acad Dermatol. 2015; 72: 203-18.
- Bachelot T, et al: Lapatinib più capecitabina in pazienti con metastasi cerebrali precedentemente non trattate da carcinoma mammario metastatico HER2-positivo (LANDSCAPE): uno studio di fase 2 a gruppo singolo. Lancet Oncol. 2013; 14(1): 64-71.
- Finn RS, et al.: Puntare le chinasi ciclina-dipendenti (CDK) 4/6 nei tumori al seno positivi al recettore degli estrogeni. Breast Cancer Res. 2016; 18: 17.
- Piccart M, et al: Everolimus più exemestane per il carcinoma mammario avanzato positivo ai recettori ormonali e negativo al recettore del fattore di crescita epidermico umano-2: risultati di sopravvivenza globale di BOLERO-2. Ann Oncol. 2014; 25(12): 2357-62.
- Herzberg B, et al: Inibitori del checkpoint immunitario nel tumore del polmone non a piccole cellule. Oncologo. 2016.
- Carlo MI, et al: Inibitori del checkpoint e altre nuove immunoterapie per il carcinoma a cellule renali avanzato. Nat Rev Urol. 2016; 13(7): 420-31.
- Redman JM, et al.: Progressi nell’immunoterapia per il melanoma. BMC Med. 2016; 14: 20.
- Fuereder T.: Immunoterapia per il carcinoma a cellule squamose della testa e del collo. Memo. 2016; 9: 66-69.
- Zhou TC, et al: Revisione del checkpoint PD-1/PD-L1 nel cancro della vescica: da mediatore della fuga immunitaria a bersaglio per il trattamento. Urol Oncol. 2016
- de Golian E, et al: Complicazioni cutanee della terapia mirata del melanoma. Curr Treat Options Oncol. 2016; 17: 57.
- Macdonald JB, et al: Effetti avversi cutanei delle terapie mirate: Parte II: Inibitori delle vie di segnalazione molecolare intracellulare. J Am Acad Dermatol. 2015; 72: 221-36.
- Trojan A, et al: Progressi nel melanoma maligno metastatico. Dermatologie Praxis 2014; Vol. 24, No. 3.
- Egbring M, et al: Un’applicazione mobile per stabilizzare l’attività funzionale quotidiana delle pazienti con cancro al seno in collaborazione con il medico: uno studio clinico controllato randomizzato. J Med Internet Res. 2016; 18(9).
InFo ONCOLOGIA & EMATOLOGIA 2016; 4(7-8): 19-22