Quali farmaci sono adatti alla radiochemioterapia neoadiuvante? Se c’è una risposta clinica completa, dobbiamo aspettare o operare? E quali pazienti beneficiano del trattamento adiuvante? Queste sono state alcune delle domande discusse al GICC dell’EORTC a San Gallo all’inizio di marzo.
(rs) “In una percentuale fino al 30% di persone con carcinoma rettale distale avanzato, la radiochemioterapia preoperatoria (neoadiuvante) può ottenere una risposta patologica completa (pCR) e clinica (cCR), evitando potenzialmente la chirurgia radicale”, ha detto la Prof.ssa Angelita Habr-Gama, MD, San Paolo, all’EORTC GICC di San Gallo. Con l’obiettivo di standardizzare la procedura nella diagnostica del tumore, il Prof. Habr-Gama e colleghi hanno definito i criteri clinici ed endoscopici per la risposta clinica e, sulla base di questi, l’ulteriore procedura [1]. Oltre alla procedura standardizzata, anche il momento della valutazione del tumore gioca un ruolo importante. “Diversi studi dimostrano che la valutazione dovrebbe avvenire non prima di sette-otto settimane dopo la fine della RCT neoadiuvante”, ha detto il Prof. Habr-Gama. Ha fatto riferimento a uno studio di Kalady et al. che ha dimostrato che un intervallo di tempo superiore a otto settimane tra la fine della RCT neoadiuvante e l’intervento chirurgico era associato a una pCR significativamente più elevata [2]. La sopravvivenza globale (OS) o libera da malattia (DFS) non è stata influenzata dalla valutazione ritardata del tumore negli studi.
“Guardare e aspettare” o operare immediatamente?
Il prerequisito per il protocollo “Watch and Wait” presentato dal Prof. Habr-Gama e utilizzato dal 1991 è una risposta clinica completa dopo un RCT neoadiuvante (Fig. 1) .
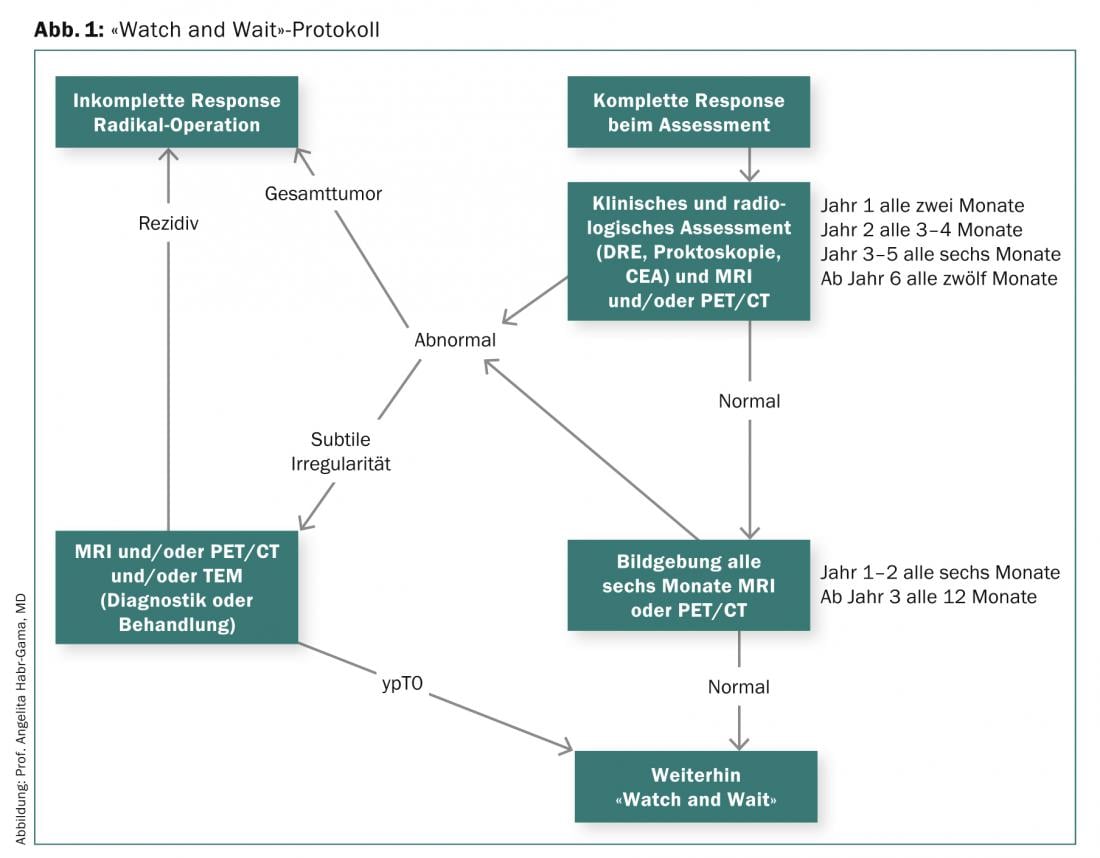
Come dimostrano i risultati a lungo termine di uno studio su 265 pazienti con carcinoma rettale distale, operati radicalmente (risposta incompleta) o seguiti (cCR) dopo RCT neoadiuvante, il tasso di sopravvivenza globale e libera da malattia è stato dell’84 contro il 97,7%. Dopo cinque anni, il tasso di sopravvivenza globale era di 88 nel gruppo di resezione e di 100 nel gruppo di osservazione, e il tasso di sopravvivenza libera da malattia era dell’83 e del 92%. Per aumentare il numero di pazienti in cui si può evitare l’intervento chirurgico radicale, il Prof. Habr-Gama e colleghi hanno studiato l’impatto di una RCT neoadiuvante prolungata con una dose di radiazioni più elevata, cicli di chemioterapia più frequenti e un intervallo più lungo fino alla valutazione del tumore [3]. Il regime terapeutico studiato ha portato inizialmente a una cCR nel 68% dei pazienti. Entro i primi dodici mesi, 17 e nel corso (>12 mesi) un altro 10% ha sviluppato una recidiva locale. La metà dei 70 pazienti inclusi non ha richiesto un intervento chirurgico a lungo termine (follow-up mediano di 56 mesi).
Partner ottimali per l’RCT neoadiuvante
La risposta alla domanda su quale chemioterapia sia più adatta per la combinazione con la radioterapia nel trattamento adiuvante del tumore del retto localmente avanzato è complicata dalla diversa somministrazione delle fluoropiramidine. “Sappiamo dagli studi post-operatori che il 5-FU più la radioterapia è un trattamento attivo e che la somministrazione continua i.v. durante la radioterapia è superiore alle iniezioni in bolo”, ha detto il Prof. Hans-Joachim Schmoll, MD, dell’Università tedesca di Halle. Il Prof. Schmoll ha risposto se il farmaco 5-FU orale capecitabina è preferibile alla forma i.v. di 5-FU nel trattamento perioperatorio, sulla base di una pubblicazione di Hofheinz e colleghi. Questo ha mostrato un vantaggio significativo di sopravvivenza per la capecitabina dopo cinque anni (76 vs. 67% p=0,0004) [4]. I risultati dello studio NSABP-R-04 pubblicato all’ASCO 2013, che ha analizzato il trattamento con capecitabina più radioterapia (RT) in due dei quattro bracci e un RCT con infusione continua a basso dosaggio di 5-FU, hanno mostrato un esito comparabile [5]. “I risultati dello studio mostrano un trattamento comparabilmente efficace”, ha detto il Prof. Schmoll. “Tuttavia, grazie alla sua maggiore facilità di somministrazione, la capecitabina dovrebbe essere preferita al 5-FU”.
La questione dell’RCT a base di fluoropiramidina più oxaliplatino per l’RCT neoadiuvante nel carcinoma del colon localmente avanzato è stata analizzata utilizzando cinque studi: STAR, ACCORD/Prodige2, NSABP R-04, ARO/CAO/AIO 04, PETACC-6. Solo lo studio ARO/CAO/AIO-04 ha mostrato una pCR significativamente più alta (17 vs. 13%, p=0,038) [6]. Tutti gli altri studi sono stati negativi a questo proposito. Tuttavia, come dimostrato dal già citato studio NSABP-R-04, che ha analizzato un RCT neoadiuvante con fluoropirimidine più oxaliplatino nei due bracci rimanenti, la tossicità è aumentata significativamente con la combinazione.
Un RCT neoadiuvante con capecitabina e irinotecan è stato studiato in studi più piccoli. Questi hanno mostrato tassi di pCR tra il 9 e il 27% e un alto tasso di resezione R0. La combinazione con l’inibitore VEGF bevacizumab sembrava inizialmente promettente. “I risultati degli studi di fase I e II con tassi di pCR tra il 16 e il 36% non suggeriscono che la combinazione con bevacizumab contribuisca in modo significativo a migliorare l’esito”, ha detto il Prof. Schmoll. Lo stesso vale per l’inibitore dell’EGFR cetuximab.
Chemioterapia adiuvante
La questione della chemioterapia post-operatoria (adiuvante) nel trattamento del cancro del retto era molto meno chiara. Sebbene ci sia un ampio consenso sul fatto che la chemioterapia adiuvante sia utile nei pazienti ad alto rischio. Tuttavia, questa conclusione indiretta è tratta da studi più vecchi con pazienti che per la maggior parte non avevano ricevuto una terapia neoadiuvante. Al contrario, è noto dagli studi EORTC che i pazienti che hanno risposto bene alla terapia neoadiuvante traggono il massimo beneficio dalla TC adiuvante [7]. Per il trattamento adiuvante, si raccomanda una terapia di sei mesi con 5-FU o capecitabina. Le informazioni sulla combinazione con oxaliplatino nella TC adiuvante saranno fornite dai risultati iniziali degli studi PETACC-6 e ARO/CAO/AIO-04. Si prevede che questi saranno presentati all’ASCO 2014.
Fonte: “Issues in combined modality treatment for rectal cancer”,2a Conferenza sul cancro gastrointestinale (GICC) dell’EORTC (Organizzazione europea per la ricerca e il trattamento del cancro) di San Gallo 2014, 7 marzo 2014, San Gallo.
Letteratura:
- Habr-Gama A, et al.: Risposta clinica completa dopo la chemioradioterapia neoadiuvante per il cancro rettale distale: caratterizzazione dei risultati clinici ed endoscopici per la standardizzazione. Dis Colon Rectum 2010; 53(12): 1692-1698.
- Kalady MF, et al: Fattori predittivi di risposta patologica completa dopo la chemioradioterapia neoadiuvante per il cancro del retto. Ann Surg 2009; 250(4): 582-589.
- Habr-Gama, et al: Approccio watch and wait dopo la chemioradiografia neoadiuvante estesa per il cancro rettale distale: ci stiamo avvicinando alla gestione del cancro anale? Dis Colon Rectum 2013; 56(10): 1109-1117.
- Hofheinz RD, et al: Chemoradioterapia con capecitabina rispetto al fluorouracile per il carcinoma rettale localmente avanzato: uno studio di fase 3, randomizzato, multicentrico, di non inferiorità. Lancet Oncol 2012; 13(6): 579-588.
- Roh MS, et al: L’impatto di capecitabina e oxaliplatino nel trattamento multimodale preoperatorio nei pazienti con carcinoma del retto: NSABP R-04. J Clin Oncol 29: 2011 (suppl; abstr 3503).
- Rödel C, et al: Chemioradioterapia preoperatoria e chemioterapia postoperatoria con fluorouracile e oxaliplatino rispetto al solo fluorouracile nel carcinoma rettale localmente avanzato: risultati iniziali dello studio randomizzato tedesco di fase 3 CAO/ARO/AIO-04. Lancet Oncol 2012; 13(7): 679-687.
- Collette L, et al: Pazienti con resezione curativa di cancro rettale cT3-4 dopo radioterapia preoperatoria o radiochemioterapia: qualcuno trae beneficio dalla chemioterapia adiuvante a base di fluorouracile? Uno studio del Gruppo di Radiologia Oncologica dell’Organizzazione Europea per la Ricerca e il Trattamento del Cancro. J Clin Oncol 2007; 25(28): 4379-4386.
InFo ONCOLOGIA & EMATOLOGIA 2014; 2(4): 25-27











