La comparsa di dolore in seguito a un ictus rappresenta una sfida per la medicina del dolore. Sebbene la conoscenza dei meccanismi fisiopatologici del dolore neuropatico dopo l’ictus sia aumentata notevolmente negli ultimi anni, il successo degli approcci terapeutici farmacologici, neurochirurgici, interventistici e di altro tipo è ancora limitato. Un approccio terapeutico multimodale è quindi obbligatorio. Questo articolo si propone di fornire una panoramica degli aspetti diagnostici e terapeutici di questa entità patologica.
Il dolore cronico da moderato a grave è un problema sanitario comune in Svizzera, con una prevalenza del 16%, anche se va notato che pochi pazienti sono trattati da specialisti del dolore e circa la metà dei pazienti riceve una gestione del dolore inadeguata [1]. Anche la presenza di dolore neuropatico puro è comune, con una prevalenza che va dal 3,3% in uno studio sulla popolazione generale in Austria [2] al 7% nella popolazione generale in Francia [3].
L’incidenza dell’ictus in Europa è di 1,1 milioni all’anno, con un aumento previsto a circa 1,5 milioni all’anno entro il 2025, a causa dell’aumento della percentuale di anziani nella popolazione [4]. Il dolore cronico associato all’ictus si osserva nell’11-55% di tutti i pazienti con ictus [5]. I tipi comuni di dolore che si verificano dopo un ictus possono includere il dolore neuropatico centrale, il dolore nocicettivo alla spalla, la spasticità dolorosa e anche la cefalea tensiva. Il dolore neuropatico centrale si manifesta nell’8% di tutti i pazienti che hanno subito un ictus [6]. Il dolore nocicettivo alla spalla è riportato tra il 30 e il 40% nei pazienti colpiti da ictus, con deficit sensoriali e motori, sublussazioni della spalla e limitazioni di movimento [7]. Il dolore muscoloscheletrico può manifestarsi anche nella schiena e negli arti inferiori, soprattutto nelle ginocchia e nelle anche [8] (Tab. 1).

Dolore centrale dopo l’ictus
La definizione di dolore neuropatico secondo l’Associazione Internazionale per lo Studio del Dolore (IASP) presuppone una lesione o una malattia che colpisce il sistema somatosensoriale [9]. Per diagnosticare il dolore neuropatico, si devono utilizzare i criteri diagnostici IASP per cercare una storia di dolore che corrisponda a una distribuzione neuroanatomicamente circoscritta e per cercare prove di una lesione o malattia rilevante del sistema nervoso periferico o centrale. L’esame clinico deve dimostrare segni sensoriali positivi e negativi corrispondenti a una distribuzione circoscritta neuroanatomicamente plausibile e coerente con l’area del dolore. Inoltre, la diagnostica apparizione deve dimostrare la presenza di una lesione o di una malattia del sistema somatosensoriale [9].
Nella letteratura in lingua inglese, il dolore neuropatico centrale dopo l’ictus viene definito “dolore centrale post-ictus” (CPSP). Poiché non esistono segni patognomonici per la CPSP, il metodo di Klit et al. seguendo i suddetti criteri diagnostici della IASP, solo recentemente ha proposto criteri diagnostici specifici per la CPSP [10]. Di conseguenza, i criteri necessari per la diagnosi di CPSP sono il dolore in una regione del corpo corrispondente a una lesione del sistema nervoso centrale. L’anamnesi deve indicare che il paziente ha avuto un ictus e l’insorgenza del dolore deve essere avvenuta dopo l’ictus. Inoltre, è necessaria la conferma di una lesione del sistema nervoso centrale mediante studi di imaging (ad esempio, TAC o risonanza magnetica del cranio) o deve essere dimostrata la presenza di segni sensoriali negativi o positivi, compatibili con una regione del corpo, corrispondente a una lesione del sistema nervoso centrale.
Trattandosi di una diagnosi clinica di esclusione, si devono escludere o rendere improbabili altre cause di dolore, come il dolore nocicettivo o neuropatico periferico. La diagnosi può essere sostenuta da criteri di supporto come l’assenza di una relazione primaria del dolore con il movimento (per esempio delle estremità), l’assenza di segni di infiammazione locale o di segni di patologia tissutale locale diversa da una causa nocicettiva del dolore. Una descrizione tipica del dolore può includere bruciore, formicolio, pressione, spilli e aghi, trafittura acuta, sparo, costrizione, dolore freddo, dolore elettrizzante, sebbene si osservino anche altre descrizioni. La presenza di allodinia o disestesia al tatto o al freddo nell’area del dolore può fornire ulteriori indizi (scheda 2).

Caratteristiche cliniche della CPSP neuropatica
La revisione di Klit [10] riassume le caratteristiche cliniche tipiche della CPSP. La distribuzione dell’area del dolore può interessare solo una piccola zona, ad esempio solo la mano, o anche aree estese del corpo, fino al dolore a metà lato. Anche il viso e il tronco possono essere tralasciati. I pazienti con il cosiddetto infarto laterale del midollo allungato e la conseguente sindrome di Wallenberg possono anche presentare dolore facciale sul lato colpito e dolore al tronco e alle estremità sul lato opposto (sindrome incrociata). Anche il dolore periorbitale è segnalato di frequente. L’emiplegia si verifica spesso dopo una lesione talamica. Anche i fenomeni sensoriali negativi e positivi sono tipici della CPSP come di altre sindromi neuropatiche. I disturbi termici, soprattutto della sensazione di freddo o anche i disturbi della sensazione di dolore o i disturbi della percezione della puntura di spillo o del picco si verificano in oltre il 90% dei casi. I sintomi negativi relativi al tatto o alle vibrazioni si verificano meno frequentemente. Sono comuni i fenomeni positivi come il dolore evocato da stimoli termici (soprattutto freddi) o meccanici (punture di spillo), ma anche l’allodinia agli stimoli tattili.
Il dolore centrale dopo l’ictus non solo si verifica tipicamente dopo una lesione talamica (“dolore talamico”), ma viene riferito anche dopo emorragie e ischemie in altre aree del cervello [11]. I dati raccolti mostrano la presenza di dolore centrale dopo l’ictus nei pazienti con infarti del tronco encefalico, lesioni midollari e lesioni della corteccia insulare. Sono state trovate cause molto diverse per la genesi dell’ictus, come l’infarto cerebrale microvascolare o embolico, l’infarto cerebrale dopo il vasospasmo dovuto all’emorragia subaracnoidea o all’emorragia intracerebrale [12].
Il tempo che intercorre tra l’insorgenza dell’ictus e la comparsa della CPSP può essere variabile (insorgenza immediata o comparsa del dolore dopo anni), ma la comparsa del dolore entro pochi mesi è la più tipica [13]. In uno studio prospettico su 16 pazienti [6], la CPSP si è verificata in dieci pazienti entro il primo mese, in altri tre pazienti da uno a sei mesi e in tre pazienti dopo sei mesi. Pertanto, un esordio tardivo della CPSP dovrebbe indurre a una diagnosi differenziale di altre cause di dolore o addirittura di un nuovo ictus.
Ruolo della diagnostica strumentale
Secondo i criteri diagnostici della IASP menzionati all’inizio, si dovrebbe effettuare una diagnosi per immagini del cervello, in particolare una risonanza magnetica per mostrare le strutture cerebrali. Se viene rilevata una lesione corrispondente al dolore, non è necessaria un’ulteriore diagnosi. In alcuni casi, una lesione molto piccola può non essere rilevabile con la diagnostica per immagini. Se il quadro clinico è tipico (storia di un ictus ed evidenza di fenomeni negativi e/o positivi corrispondenti), si può fare una diagnosi di CPSP. Inoltre, si può tentare la prova neurofisiologica di una lesione. I potenziali evocati somatosensoriali [14] e quelli evocati dal laser [15], ma anche i test sensoriali quantitativi [16] possono aiutare a rilevare una lesione. I nostri dati mostrano risultati patologici nell’esame dei potenziali evocati dal laser e dei test sensoriali quantitativi nella maggior parte dei casi di pazienti con dolore neuropatico centrale dopo ictus di diversa genesi [12].
Meccanismi di sviluppo del dolore nel dolore neuropatico dopo l’ictus
La recente revisione di Klit et al. [10] offre una buona panoramica dei possibili meccanismi del dolore centrale dopo l’ictus. L’ipereccitabilità neuronale a livello cerebrale gioca un ruolo significativo nella fisiopatologia del dolore neuropatico generato a livello centrale. I fattori che possono promuovere l’ipereccitabilità neuronale includono l’attivazione gliale con rilascio di chemochine e sostanze infiammatorie, l’indebolimento dei sistemi inibitori GABA-ergici del talamo, lo squilibrio tra i tratti spinotalamici laterali e mediali a causa di una lesione in quel punto, o la deafferentazione dell’input sensoriale. Le conseguenze di tali meccanismi possono essere il rilevamento dell’attività spontanea nel nucleo ventrocaudale del talamo o anche un cambiamento del flusso sanguigno cerebrale nel talamo. Vengono discussi ulteriori meccanismi, come un disturbo dei circuiti di eccitazione cortico-talamo-corticali o la riorganizzazione corticale e anche altri meccanismi.
Approcci terapeutici per la CPSP
Il dolore cronico dopo l’ictus può portare a una riduzione della qualità di vita che influisce sull’umore, sul sonno e sul funzionamento sociale [17]. In generale, la cosiddetta terapia del dolore multimodale con procedure somatiche, fisiche e psicoterapeutiche è superiore alla terapia monodisciplinare per le sindromi di dolore cronico. A questo proposito, oltre alle varie possibili cause di dolore descritte sopra, il trattamento del dolore dopo l’ictus dovrebbe sempre essere interdisciplinare e multimodale. Soprattutto nei pazienti con dolore neuropatico dopo l’ictus, i trattamenti psicologici come le strategie di coping e le terapie comportamentali possono portare a un miglioramento del dolore [17].
Per quanto riguarda il dolore nocicettivo, sono utili soprattutto misure ortopediche (ad esempio, la terapia delle patologie della spalla), fisioterapiche (ad esempio, il trattamento dei fattori di dolore muscolare) e di terapia occupazionale, a seconda della patologia muscolo-scheletrica. Inoltre, può essere necessario il trattamento della spasticità dolorosa con baclofen orale. In casi particolari, può essere utile l’applicazione di una pompa intratecale per la spasticità.
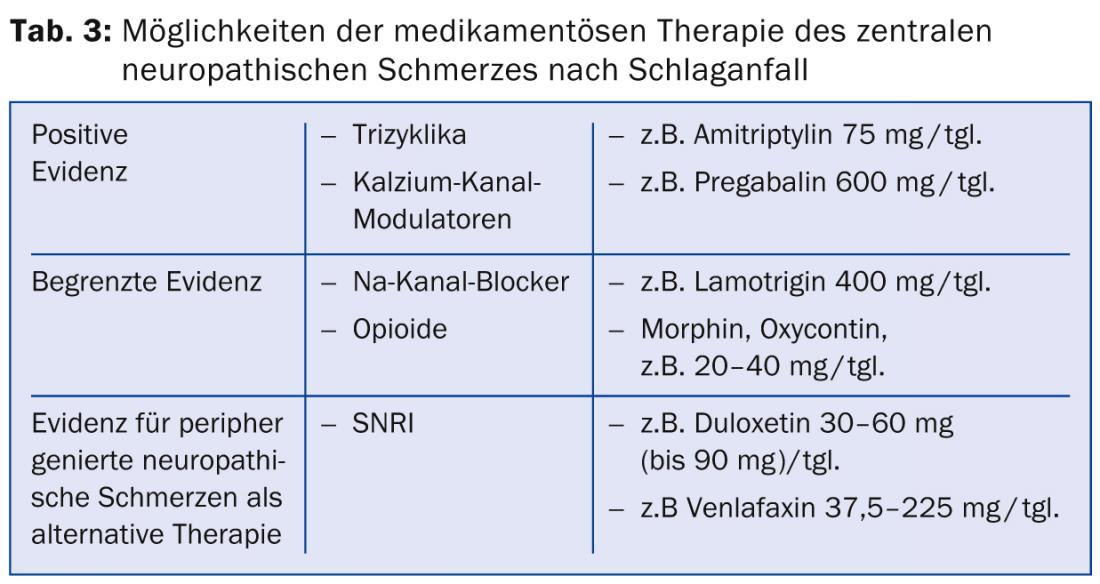
Approcci di terapia farmacologica: Gli approcci terapeutici per il dolore neuropatico dopo l’ictus sono valutati in linee guida internazionali come la linea guida del Gruppo di Lavoro sul Dolore Neuropatico della Società Internazionale del Dolore (NeuPSIG) [18] e la linea guida della Federazione Europea delle Società Neurologiche (EFNS) [19]. Le opzioni di terapia farmacologica disponibili sono limitate. È possibile che la moltitudine di meccanismi fisiopatologici sopra menzionati a diversi livelli neuronali sia la ragione della risposta spesso scarsa ai farmaci disponibili per il trattamento del dolore neuropatico dopo l’ictus. Per un gran numero di meccanismi citati, non è ancora disponibile alcuna terapia.
Esistono pochi studi randomizzati e controllati per il trattamento del dolore neuropatico centrale dopo l’ictus. I triciclici e i modulatori dei canali del calcio sono considerati i farmaci di prima scelta. Sono disponibili dati di studio positivi per l’amitriptilina alla dose di 75 mg [20]. Il “numero necessario per trattare” (NNT), cioè il numero di pazienti da trattare per ottenere una riduzione del 50% del dolore, è stato indicato in questo caso come 1,7. Sono stati osservati effetti collaterali moderati, come affaticamento e secchezza delle fauci.
Per quanto riguarda gli anticonvulsivi del gruppo dei modulatori dei canali del calcio, uno studio su pazienti con dolore neuropatico centrale ha mostrato un’efficacia significativa del pregabalin con un NNT di 4,0 [21]. Gli effetti collaterali includevano vertigini, deterioramento cognitivo, affaticamento e nausea. Inoltre, il farmaco antiepilettico lamotrigina, appartenente al gruppo dei bloccanti dei canali del sodio, ha mostrato un’efficacia moderata con una buona tollerabilità in uno studio sul dolore centrale dopo l’ictus [22]. In altri disturbi del dolore neuropatico, l’efficacia della lamotrigina non è chiara, per cui in generale la sua efficacia è considerata poco chiara [23]. Uno studio con carbamazepina alla dose di 800 mg/tgl. non ha mostrato alcuna efficacia nel dolore neuropatico dopo l’ictus.
In uno studio sul dolore neuropatico di varie eziologie, gli oppioidi orali hanno mostrato una riduzione media del dolore del 23%, anche se il numero di pazienti con dolore neuropatico dopo l’ictus era basso, dieci su 81, e sette di loro hanno abbandonato lo studio a causa degli effetti collaterali [24]. Gli studi con la somministrazione endovenosa di morfina, lidocaina e propofol hanno mostrato un miglioramento del dolore post-ictus durante l’infusione. Le successive terapie orali di mantenimento con morfina e mexiletina sono state poco tollerate a causa degli effetti collaterali [25–27].
Se non è possibile ottenere una riduzione sufficiente del dolore con i farmaci sopra citati, si raccomanda di ricorrere ai farmaci di prima e seconda scelta per la terapia del dolore neuropatico generato perifericamente [18]. Questi includono, come farmaci di prima linea, gli inibitori selettivi della ricaptazione della serotonina e della noradrenalina (SNRI), come la duloxetina e la venlafaxina, e per i farmaci di seconda linea, gli oppioidi altamente potenti come l’MST, l’ossicodone e altri oppioidi (tab. 3).
Approcci terapeutici neurochirurgici e interventistici: Come dimostrato, le opzioni di terapia farmacologica per il dolore neuropatico dopo l’ictus sono limitate e quindi spesso insoddisfacenti. Secondo Dworkin et al. [23], i metodi invasivi possono essere provati dopo aver esaurito i singoli metodi di terapia conservativa o combinata. La situazione attuale dei dati relativi agli approcci terapeutici neurochirurgici e interventistici è raccolta in recenti rassegne [10,28,29]. Poiché le prove a favore di queste procedure sono limitate, dovrebbero essere riservate a centri di trattamento esperti.
La stimolazione magnetica transcranica ripetitiva (rTMS) è una procedura neuromodulativa, non invasiva. In questo caso, l’effetto è moderato e dura solo per un breve periodo, anche se non si verificano quasi mai effetti collaterali gravi. Trattamenti ripetuti della corteccia motoria con la rTMS possono mostrare un miglioramento significativo del dolore [30,31]. Inoltre, questa terapia può essere utilizzata come predittore della risposta alla stimolazione epidurale della corteccia motoria [32].
L’efficacia della stimolazione epidurale della corteccia motoria per il dolore centrale dopo l’ictus ha mostrato una riduzione del dolore di circa il 45-50% dopo un anno [28,33]. Raramente sono state segnalate complicazioni gravi. In fase perioperatoria, possono verificarsi crisi epilettiche, infezioni e anche problemi tecnici.
La stimolazione cerebrale profonda (DBS) può essere considerata un’altra terapia invasiva. Qui viene stimolato il talamo sensoriale (nervo posteriore ventrale) o il grigio periventricolare. L’efficacia è riportata tra il 25 e il 67% [34,35]. In generale, l’efficacia non può essere chiaramente quantificata, per cui sono necessari ulteriori studi [28].
Una nuova modalità di trattamento per i pazienti con dolore neuropatico, compreso il dolore neuropatico centrale dopo l’ictus, è l’ultrasuono focalizzato ad alta intensità (HIFUS), che viene applicato per via transcranica, in modo non invasivo, per ablare termicamente un’area circoscritta del talamo centrolaterale, che può portare al sollievo dal dolore [36].
Gunther Landmann, MD
Dott.ssa Emmanuelle Opsommer
Letteratura:
- Breivik H, et al: European Journal of Pain 2006; 10(4): 287-287.
- Gustorff B, et al: Acta Anaesthesiol Scand 2008; 52(1): 132-136.
- Bouhassira D, et al: Pain 2008; 136(3): 380-387.
- Truelsen T, et al: Eur J Neurol 2006; 13: 581-598.
- Jönsson AC, et al: J Neurol Neurosurg Psychiatry 2006; 77: 590-595.
- Andersen G, et al: Pain 1995; 61: 187-193.
- Lindgren I, et al: Stroke 2007; 38: 343-348.
- Kuptniratsaikul V, et al: Am J Phys Med Rehabil 2009; 88: 92-99.
- Treede RD, et al: Neurology 2008; 70(18): 1630-1635.
- Klit H, Finnerup NB, Jensen TS: Lancet Neurol 2009; 8(9): 857-868.
- Weimar C, et al: Cerebrovasc Dis 2002; 14: 261-263.
- Landmann G, Stockinger L, Opsommer E: Il dolore centrale post-ictus esplorato dai potenziali evocati dal laser e dai test sensoriali quantitativi: uno studio su casi multipli. 30° Congresso internazionale di neurofisiologia clinica (ICCN). Berlino, Germania, 2014.
- Tasker R: Stati dolorosi centrali. In: L JD, editore. Bonica’s management of pain Philadelphia: Lipponcott Williams & Wilkins, 2001; 433-445.
- Holmgren H, et al: Pain 1990; 40: 43-52.
- Garcia-Larrea L, et al: Brain 2002; 125: 2766-2781.
- Boivie J: Eur J Pain 2003; 7: 339-343.
- Widar M, et al: J Pain Symptom Manage 2004; 27: 215-225.
- Dworkin RH: Am J Med 2009; 122(10 Suppl): S1-2.
- Attal N, et al: Eur J Neurol 2010; 17(9): 1113-1188.
- Leijon G: Dolore 1989; 36: 27-36.
- Vranken JH, et al: Pain 2008; 136: 150-157.
- Vestergaard K, et al: Neurology 2001; 56: 184-190.
- Dworkin RH, et al: Pain 2007; 132(3): 237-251.
- Rowbotham MC, et al: N Engl J Med 2003; 348: 1223-1232.
- Attal N, et al: Neurology 2000; 54: 564-574.
- Attal N, et al: Neurology 2002; 58: 554-563.
- Canavero S: Clin Neuropharmacol 2004; 27: 182-186.
- Cruccu G, et al: Eur J Neurol 2007; 14: 952-970.
- Kumar B, et al: Anestesia e analgesia 2009; 108(5): 1645-1657.
- Khedr EM, et al: J Neurol Neurosurg Psychiatry 2005; 76(6): 833-838.
- Leung A, et al: J Pain 2009; 10(12): 1205-1216.
- Andre-Obadia N, et al: Clin Neurophysiol 2006; 117(7): 1536-1544.
- Fontaine D, Hamani C: Journal of neurosurgery 2009; 110: 251-256.
- Katayama Y, et al: Stereotact Funct Neurosurg 2001; 77: 183-186.
- Owen SL, et al: Pain 2006; 120: 202-206.
- Martin E, et al: Ann Neurol 2009; 66(6): 858-861.
PRATICA GP 2014; 9(5): 20-24