A cosa mirano effettivamente le cosiddette terapie mirate? E quali progressi sono stati fatti a questo proposito nelle varie neoplasie emato-oncologiche? Al 21° Simposio Medicina nel Maneggio al Circo Knie, il Prof. Dr. med. Markus G. Manz dell’Ospedale Universitario di Zurigo ha dato risposte alle domande più scottanti.
Secondo il Prof. Markus G. Manz, MD, Clinica di Ematologia, Ospedale Universitario di Zurigo, i tumori nel campo dell’emato-oncologia rappresentano circa il 10% delle neoplasie in Svizzera. Si tratta principalmente delle cosiddette “malattie della vecchiaia”, cioè di condizioni che si verificano più frequentemente con l’avanzare dell’età.
“Anche se non si ipotizza lo scenario demografico più estremo, ma piuttosto uno medio, entro il 2030 si verificherà un raddoppio della popolazione di età superiore ai 65 anni. Quindi, in modo molto semplificato, ci si aspetta un raddoppio delle neoplasie emato-oncologiche, il che rende ancora più importante la necessità di terapie adeguate”, ha spiegato il Prof. Manz.
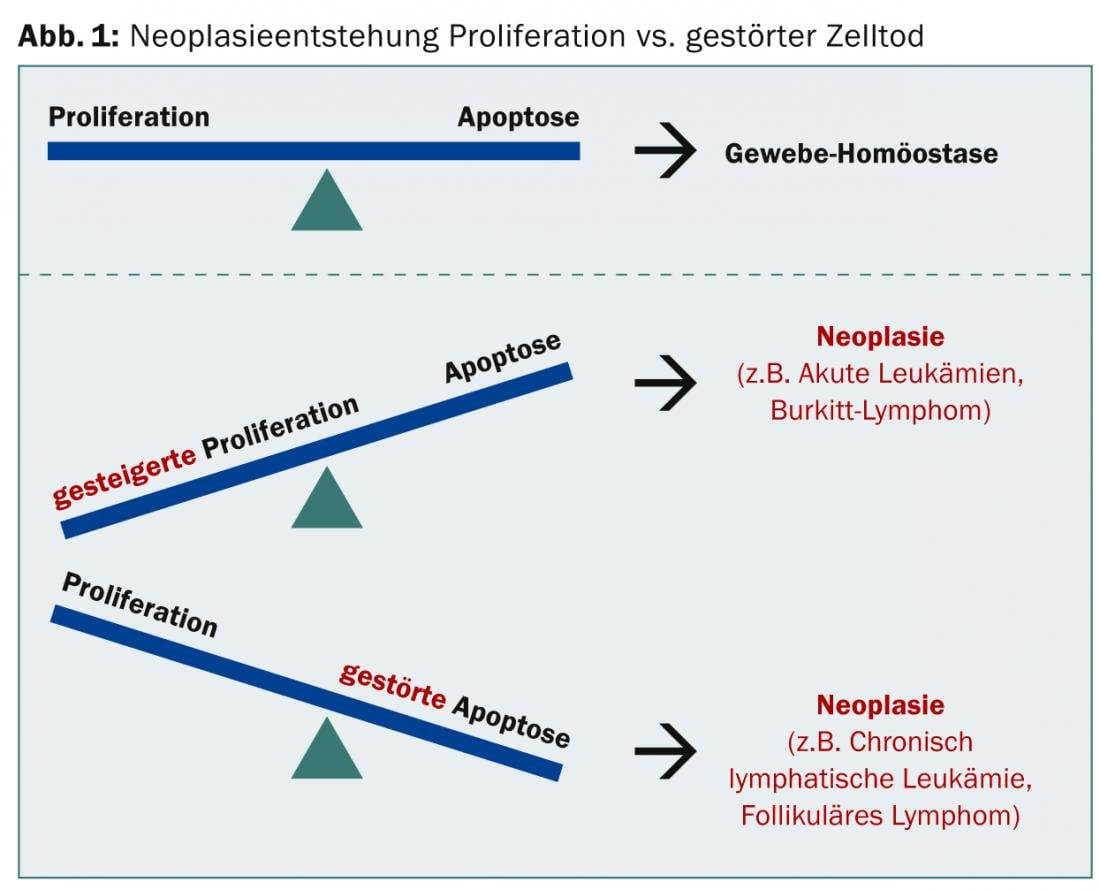
Nel caso di una neoplasia, può predominare l’aumento della proliferazione o l’apoptosi disturbata; in entrambi i casi, l’equilibrio tissutale non è più dato (Fig. 1).
L’ideale della terapia mirata, invece, è la massima selettività tumorale possibile; deve attaccare solo il tumore, ma non l’intero paziente o il tessuto sano. “La cosiddetta chemioterapia classica non mirata è solitamente dipendente dal ciclo cellulare, cioè segue il principio: molta divisione – alto effetto”, ha detto il relatore. La terapia mirata, invece, mira ai cosiddetti “driver tumorali” che sono essenziali per il tumore e quindi distrugge il tumore in modo efficiente e, almeno teoricamente, con il minor numero possibile di effetti collaterali.
I due bersagli più comuni sono gli enzimi/kinasi (intracellulari) e gli antigeni sulla superficie cellulare. Le prime sono inibite dalle cosiddette “piccole molecole”, le seconde sono attaccate da anticorpi con o senza “munizioni” annesse.
Le chinasi trasferiscono un residuo di fosfato e possono quindi attivare altri enzimi. Sono essenziali per la trasduzione del segnale nella cellula. Nel tessuto tumorale, la chinasi è sempre attiva, il che porta a una massiccia divisione cellulare. L’inibitore blocca la chinasi e quindi pone la divisione cellulare in uno stato di inattività. “Un esempio lampante di inibitore della chinasi è l’imatinib. Il Rituximab, invece, è il rappresentante più noto degli anticorpi monoclonali e ha portato ad una vera e propria rivoluzione in tutti i linfomi con espressione di CD20, che comprende praticamente tutti i linfomi a cellule B”, afferma il Prof. Manz.
Quali miglioramenti si possono ottenere?
Prendendo come esempio la leucemia mieloide cronica (CML), il Prof. Manz ha dimostrato che da quando gli inibitori della tirosin-chinasi sono stati introdotti per la prima volta intorno al 2001, l’efficacia del trattamento è aumentata notevolmente e la sopravvivenza a lungo termine è migliorata di conseguenza. “Circa il 5% dei pazienti con CML che assumono imatinib sono i cosiddetti super-responder: qui, per la prima volta, si pone la questione di una possibile cura [1,2]”, afferma il Prof. Manz. “La conseguenza del successo è un’aspettativa maggiore nel campo della CML per il prossimo futuro: il 100% di sopravvivenza a lungo termine con lo 0% di riduzione della qualità di vita”.
Come secondo esempio, ha citato lo sviluppo nel campo della mielofibrosi primaria (PMF): la cosiddetta mutazione JAK-2 (Janus kinase 2) si verifica in circa il 50% dei casi di PMF. Meno di dieci anni dopo la scoperta e l’identificazione di questa mutazione, è stato approvato il primo inibitore della JAK. “I dati mostrano che sotto ruxolitinib (Jakavi®), rispetto alla migliore terapia disponibile, un miglioramento del controllo dei sintomi e della qualità di vita [3], nonché una migliore sopravvivenza globale rispetto al placebo [4]. Ma: gli inibitori della JAK-1&2 sono attivi anche nella JAK-2 non mutata. Il bersaglio selettivo nel tumore non è quindi rilevante?”, ha chiesto il Prof. Manz.
L’ultimo argomento è stato la leucemia linfatica cronica (LLC). In questo caso, è stato dimostrato che l’aggiunta di un anticorpo anti-CD20 alla chemioterapia è più efficace della sola chemioterapia. Inoltre, gli anticorpi anti-CD20 ottimizzati, come GA101 (obinutuzumab), funzionano meglio di quelli di prima generazione [5].
“Attualmente, ci sono anche studi che indagano sull’efficacia dell’inibizione della chinasi nella LLC [6]. Un’ampia applicazione di questa modalità d’azione nel linfoma B-non-Hodgkin è molto probabile nel prossimo futuro”, conclude il Prof. Manz.
Fonte: 21° Simposio Medicina nel Maneggio, 5 giugno 2014, Zurigo.
Letteratura:
- Mahon FX, et al: Interruzione di imatinib nei pazienti con leucemia mieloide cronica che hanno mantenuto una remissione molecolare completa per almeno 2 anni: lo studio prospettico, multicentrico Stop Imatinib (STIM). Lancet Oncol 2010 Nov; 11(11): 1029-1035.
- Ross DM, et al: Sicurezza ed efficacia della cessazione di imatinib per i pazienti con CML con malattia minima residua stabile non rilevabile: risultati dello studio TWISTER. Sangue 2013 Jul 25; 122(4): 515-522.
- Harrison C, et al: Inibizione della JAK con Ruxolitinib rispetto alla migliore terapia disponibile per la mielofibrosi. N Engl J Med 2012; 366: 787-798.
- Verstovsek S, et al: Esiti a lungo termine della terapia con Ruxolitinib nei pazienti con mielofibrosi: aggiornamento a 3 anni da COMFORT-I. Sangue 2013; 122(21): 396.
- Goede V, et al: Obinutuzumab più clorambucile nei pazienti con LLC e condizioni coesistenti. N Engl J Med 2014; 370: 1101-1111.
- Byrd JC, et al: Ibrutinib rispetto a ofatumumab nella leucemia linfoide cronica precedentemente trattata. NEJM 31 maggio 2014. DOI: 10.1056/NEJMoa1400376.
InFo ONCOLOGIA & EMATOLOGIA 2014; 2(6): 33-34