La psoriasi è una malattia autoimmune infiammatoria cronica, mediata dalle cellule T, che colpisce in particolare la pelle e le articolazioni. Tuttavia, si tratta anche di una malattia multisistemica con diverse comorbidità e, pertanto, è diventata sempre più importante per tutti i settori medici, ben oltre la dermatologia e la reumatologia. L’introduzione dei biologici ha portato un profondo cambiamento nella dermatologia, a beneficio non solo di chi soffre di psoriasi, ma anche di pazienti con altre patologie dermatologiche infiammatorie. Il seguente articolo offre una panoramica sulla patogenesi della psoriasi e sulla modalità d’azione dei biologici.
La psoriasi è una malattia infiammatoria cronica che colpisce in particolare la pelle e le articolazioni. Colpisce circa il 2-3% della popolazione, rendendo la psoriasi una delle malattie infiammatorie della pelle più comuni [1]. Tuttavia, la psoriasi è anche una malattia multisistemica con diverse manifestazioni sistemiche e malattie concomitanti. I pazienti presentano un aumento del rischio cardiovascolare [2,3], la prevalenza della sindrome metabolica è aumentata [4]. La depressione è raggruppata e la psoriasi può essere un peso psicologico pronunciato [5,6]. Il rischio di cancro, in particolare di linfoma e di cancro della pelle, è aumentato [7]. Inoltre, la psoriasi è spesso associata ad altre malattie infiammatorie immuno-mediate. L’incidenza della malattia di Crohn, ad esempio, è da quattro a otto volte superiore rispetto alla popolazione generale [8]. Infatti, la malattia infiammatoria intestinale, il diabete e la psoriasi sono stati associati agli stessi geni di rischio o a geni simili [9,10]. La psoriasi è oggi considerata una malattia genetica con una complessa interazione di fattori genetici ed esterni che portano allo sviluppo della malattia.
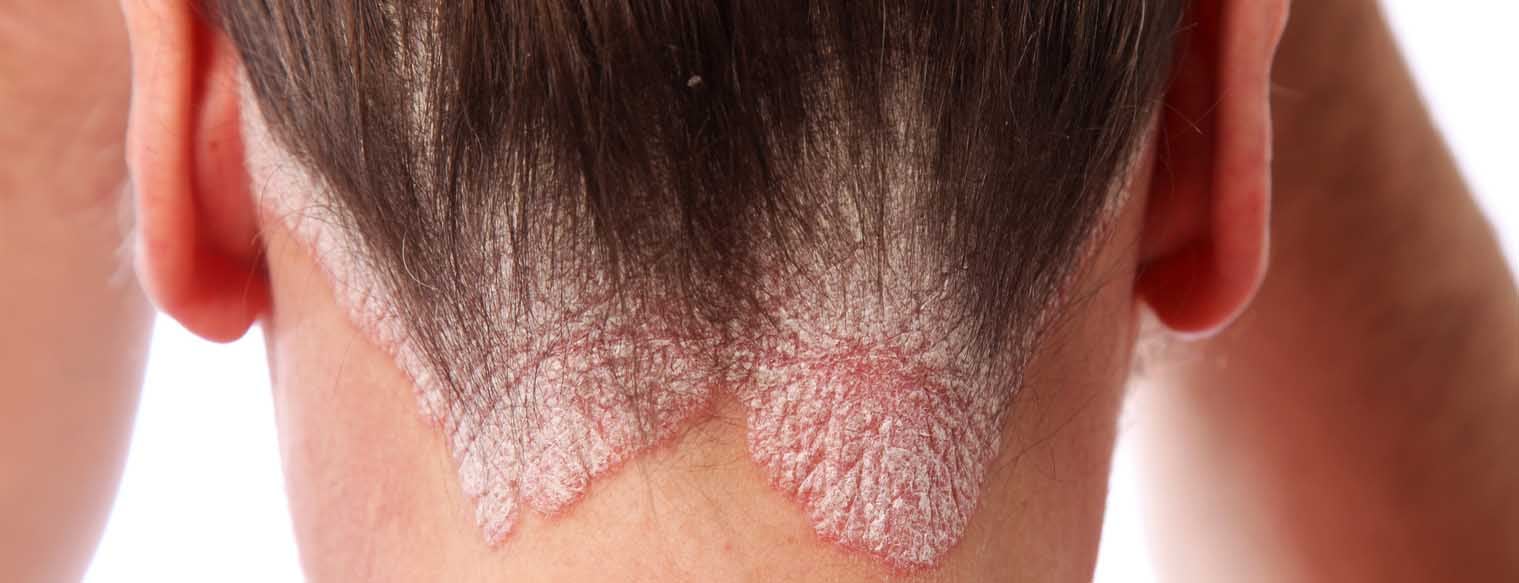
Psoriasi vulgaris
La forma classica di psoriasi, la psoriasi vulgaris, si presenta tipicamente con placche rosse ben definite, coperte da squame bianco-argentee. La clinica si riflette istologicamente con un’epidermide allargata (acantosi), creste di rete allungate (papillomatosi), uno strato corneo ispessito (ipercheratosi) e una differenziazione anomala dei cheratinociti con ritenzione dei nuclei cellulari nello strato corneo (para-cheratosi). Questo spiega le placche squamose clinicamente visibili. Il rossore riflette un aumento del numero di capillari dilatati e tortuosi. L’infiltrato infiammatorio è costituito principalmente da macrofagi, varie cellule dendritiche, cellule T e granulociti neutrofili.
Primi approcci terapeutici
Poiché la psoriasi è caratterizzata da ipercheratosi e squame bianche ispessite causate dalla proliferazione troppo rapida dei cheratinociti, è stata a lungo considerata una malattia dei cheratinociti. Solo il successo dell’uso della ciclosporina A e di altri approcci terapeutici diretti contro le cellule T ha portato a un cambiamento di paradigma alla fine degli anni ’70 [11,12]. Sebbene la rilevanza delle cellule immunitarie non sia più stata messa in dubbio, ancora oggi non è chiaro quale tipo di cellula sia all’origine della psoriasi. Ricerche recenti suggeriscono che la psoriasi è scatenata da una combinazione di un difetto primario nei cheratinociti e da una risposta immunitaria eccessiva [13–16].
Comprendere la patogenesi
Nelle persone con una predisposizione genetica, vari fattori esterni come i traumi (il cosiddetto fenomeno di Köbner), le infezioni, lo stress o i farmaci possono scatenare o peggiorare la psoriasi. Questi fattori scatenanti iniziali attivano il sistema immunitario innato.
Complessi di acidi nucleici (DNA e RNA) e peptidi antimicrobici, come LL-37, rilasciati dai cheratinociti dopo un trauma epidermico, attivano le cellule dendritiche plasmacitoidi e portano alla produzione di grandi quantità di interferone alfa (IFN-α) [14,15,17]. In condizioni fisiologiche, le cellule dendritiche plasmacitoidi riconoscono gli acidi nucleici virali e sono essenziali nell’induzione dell’immunità protettiva [18]. Nella psoriasi, l’aumento della produzione di IFN-α è cruciale nello sviluppo precoce della malattia, poiché guida la risposta autoimmune [15]. L’IFN-α porta all’attivazione e alla maturazione delle cellule dendritiche tradizionali, che a loro volta stimolano le cellule T. In questo modo, l’IFN-α collega la risposta immunitaria innata con la risposta immunitaria acquisita. Successivamente, le cellule T autoreattive proliferano, migrano nell’epidermide e alla fine scatenano le caratteristiche epidermiche della psoriasi, come l’iperproliferazione dei cheratinociti e l’ispessimento dell’epidermide [16].
Nella psoriasi, queste cellule T autoreattive sono principalmente cellule T helper di tipo 1 (Th1) e Th17, che producono interferone-gamma e interleuchina (IL)-17 e IL-22, rispettivamente [19,20]. È interessante notare che le due citochine Th17 in particolare sono cruciali nel collegare la risposta immunitaria acquisita alla disregolazione epidermica caratteristica della psoriasi [21–23]. L’IL-22 induce l’iperproliferazione dei cheratinociti e l’IL-17 e l’IL-22 aumentano entrambi la produzione di peptidi antimicrobici [24–26]. I peptidi antimicrobici portano – come descritto sopra – ad una continua attivazione del sistema immunitario e quindi alla cronicizzazione della malattia attraverso un ciclo di feedback positivo. In sintesi, un asse LL-37/IFN-α/Th17 persistentemente attivato è essenziale per la patogenesi della psoriasi [18]. Infatti, diversi geni di suscettibilità forniscono una base genetica per la rilevanza di questo asse nella psoriasi. I geni di suscettibilità come RAGE e il “fattore regolatore” IFN 5 sono coinvolti nell’attivazione delle cellule dendritiche plasmacitoidi e nella produzione di IFN-α, rispettivamente [27], i geni MHC I sono coinvolti nell’attivazione delle cellule T autoreattive [27,28], e i geni IL-23 e del recettore IL-23 sono direttamente coinvolti nella polarizzazione e nell’espansione delle cellule T Th17 [29,30].
Il trionfo dei biologici
Negli ultimi 15 anni, questa comprensione sempre più dettagliata della patogenesi ha cambiato radicalmente il trattamento della psoriasi. Sulla base di questa conoscenza, è stata sviluppata una nuova generazione di farmaci chiamati biologici. Questa classe di farmaci si basa sulla tecnologia del DNA ricombinante e comprende anticorpi monoclonali e proteine di fusione del recettore che mirano specificamente all’attivazione delle cellule T o alle citochine essenziali. Poiché i biologici intervengono in modo molto specifico nella risposta immunitaria, gli altri organi possono essere meno colpiti e gli effetti collaterali possono quindi essere ridotti. La crescente comprensione della psoriasi ha aperto molti nuovi potenziali approcci terapeutici e, di conseguenza, numerosi biologici sono ora in fase di sviluppo clinico o sono già disponibili per medici e pazienti come farmaci [31].
Il fattore di necrosi tumorale (TNF) è una citochina che svolge un ruolo importante nelle risposte infiammatorie [32]. Poiché i livelli di TNF sono elevati nel siero, nelle lesioni cutanee e nelle articolazioni colpite dei pazienti affetti da psoriasi, il TNF era un candidato ovvio per il primo intervento immunitario mirato nelle malattie infiammatorie croniche come la malattia di Crohn, l’artrite o la psoriasi. Mentre i primi studi si basavano ancora sull’esperienza aneddotica di un paziente che soffriva contemporaneamente di malattia di Crohn e psoriasi [33], la terapia anti-TNF è diventata in seguito il gold standard assoluto nel trattamento della psoriasi. Oggi, tre diversi farmaci anti-TNF sono tra i dieci farmaci più venduti al mondo, e Humira® è in cima alla lista con vendite pari a 10 miliardi di dollari.
Sempre di più
Da quando è stata riconosciuta l’importanza funzionale dell’asse IFN-α/IL-23/Th17 nella psoriasi, è in fase di sviluppo clinico un numero crescente di farmaci biologici che mirano a questo asse. Ustekinumab, che blocca contemporaneamente l’IL-12 e l’IL-23 e quindi inibisce la differenziazione dei Th1- resp. inibisce le cellule T Th17, è il primo farmaco di questo gruppo disponibile sul mercato [34,35]. L’efficacia è assolutamente paragonabile a quella degli inibitori del TNF [36]. Briakinumab, un altro anticorpo anti-IL-12/23, invece, era già stato ritirato prima del suo lancio sul mercato, nonostante l’impressionante efficacia [37], a causa di un’elevata incidenza di eventi cardiovascolari gravi. Sebbene una meta-analisi indipendente non abbia mostrato un’associazione tra il blocco dell’IL-12/23 e l’aumento del rischio cardiovascolare [38], rimane qualche incertezza sulla sicurezza cardiovascolare di questo gruppo di farmaci. Recentemente, uno studio ha dimostrato che i livelli sierici più bassi di IL-17 nei pazienti con infarto miocardico acuto comportano un aumento del rischio di ulteriori eventi cardiovascolari [39]. Di conseguenza, gli anticorpi anti-IL12/23 e, in futuro, gli inibitori dell’IL-17 dovrebbero essere utilizzati con cautela dopo la loro introduzione sul mercato, almeno nei pazienti con un aumentato rischio cardiovascolare. Tuttavia, gli anticorpi anti-IL-17 e i biologici che interferiscono con l’asse IL-23/Th17 saranno probabilmente tra i biologici più utilizzati nella psoriasi nei prossimi anni, insieme ai già affermati inibitori del TNF.
Una migliore comprensione della patogenesi della psoriasi ha portato negli ultimi anni a una serie di nuovi potenziali approcci terapeutici [31]. Sebbene i biologici attualmente disponibili siano efficaci e ben tollerati, rimangono alcuni problemi relativi alla loro efficacia e sicurezza a lungo termine. Con i progressi futuri, la disponibilità di dati genomici completi dei pazienti affetti da psoriasi e possibilmente l’identificazione di autoantigeni nella psoriasi, possiamo aspettarci nuove scoperte nell’immunoterapia e un arsenale crescente di trattamenti migliori e più mirati.
Biologici al di fuori dell’indicazione psoriasi
Il successo dei biologici nella psoriasi ha portato a un ripensamento della dermatologia nel suo complesso e all’uso crescente di terapie mirate e orientate alla patogenesi in altre indicazioni. Data la rilevanza del TNF nella maggior parte delle reazioni infiammatorie croniche, gli inibitori del TNF sono stati testati in altre indicazioni subito dopo il loro lancio sul mercato. Oggi vengono utilizzati con successo per numerose dermatosi infiammatorie: Il blocco del TNF, ad esempio, mostra un’ottima efficacia nel pioderma gangraenosum [40] resistente alla terapia e ha persino trovato posto nelle linee guida per il trattamento dell’hidradenitis suppurativa. Oggi, gli anticorpi anti-IgE sono utilizzati nell’orticaria cronica [41] e il blocco dell’IL-1 è la terapia standard per le sindromi autoinfiammatorie [42]. Inoltre, sulla base della comprensione fondamentale delle malattie e della risposta immunitaria, si stanno sviluppando sempre più biologici per specifiche malattie dermatologiche. Ad esempio, l’immunoterapia mirata con anticorpi contro CTLA-4 e PD-1/PD-L1 nel melanoma ha inaugurato una nuova era della terapia antitumorale. Il trattamento si basa sul blocco delle molecole che regolano negativamente un’efficace risposta antitumorale delle cellule T (la cosiddetta inibizione del checkpoint delle cellule T). Oggi si possono ottenere alti tassi di risposta e remissioni sostenute nel melanoma, soprattutto con le strategie di combinazione [43].
CONCLUSIONE PER LA PRATICA
- La comprensione sempre più dettagliata della patogenesi della malattia ha cambiato radicalmente il trattamento della psoriasi nell’ultimo decennio e ha portato all’introduzione dei biologici in dermatologia.
- Oggi la psoriasi è considerata una malattia modello per altre malattie infiammatorie croniche e viene spesso utilizzata nei cosiddetti studi “proof-of-concept” per studiare nuovi approcci terapeutici che intervengono in modo specifico nella patogenesi.
- Il successo dei biologici nella psoriasi ha provocato un ripensamento dell’intera dermatologia. L’uso di terapie mirate orientate alla patogenesi in altre indicazioni è in aumento.
Letteratura:
- Christophers E: Psoriasi – epidemiologia e spettro clinico. Clin Exp Dermatol 2001; 26(4): 314-320.
- Mehta NN, et al: I pazienti con psoriasi grave sono ad aumentato rischio di mortalità cardiovascolare: studio di coorte utilizzando il General Practice Research Database. Eur Heart J 2010; 31(8): 1000-1006.
- Gelfand JM, et al: Rischio di infarto miocardico nei pazienti con psoriasi. JAMA 2006; 296(14): 1735-1741.
- Gisondi P, et al: Prevalenza della sindrome metabolica nei pazienti con psoriasi: uno studio caso-controllo basato sull’ospedale. Br J Dermatol 2007; 157(1): 68-73.
- Kurd SK, et al: Il rischio di depressione, ansia e suicidalità nei pazienti con psoriasi: uno studio di coorte basato sulla popolazione. Arch Dermatol 2010; 146(8): 891-895.
- Krueger G, et al: L’impatto della psoriasi sulla qualità della vita: risultati di un sondaggio della National Psoriasis Foundation del 1998 tra i pazienti. Arch Dermatol 2001; 137(3): 280-284.
- Gelfand JM, et al: Il rischio di linfoma nei pazienti con psoriasi. J Invest Dermatol 2006; 126(10): 2194-2201.
- Najarian DJ, Gottlieb AB: Collegamenti tra psoriasi e malattia di Crohn. J Am Acad Dermatol 2003; 48(6): 805-821.
- Wolf N, et al: La psoriasi è associata a loci di suscettibilità pleiotropici identificati nel diabete di tipo II e nella malattia di Crohn. J Med Genet 2008; 45(2): 114-116.
- Nair RP, et al: Evidenza di due loci di suscettibilità alla psoriasi (HLA e 17q) e di due nuove regioni candidate (16q e 20p) mediante una scansione genome-wide. Hum Mol Genet 1997; 6(8): 1349-1356.
- Mueller W, Herrmann B: Ciclosporina A per la psoriasi. N Engl J Med 1979; 301(10): 555.
- Gottlieb SL, et al: La risposta della psoriasi a una tossina selettiva per i linfociti (DAB389IL-2) suggerisce una base patogena primaria immunitaria, ma non cheratinocitaria. Nat Med 1995; 1(5): 442-447.
- Sano S, et al.: Stat3 collega i cheratinociti attivati e gli immunociti necessari per lo sviluppo della psoriasi in un nuovo modello di topo transgenico. Nat Med 2005; 11(1): 43-49.
- Lande R, et al.: Le cellule dendritiche plasmacitoidi percepiscono il self-DNA accoppiato al peptide antimicrobico. Natura 2007; 449(7162): 564-569.
- Nestle FO, et al: Le cellule predendritiche plasmacitoidi avviano la psoriasi attraverso la produzione di interferone-alfa. J Exp Med 2005; 202(1): 135-143.
- Conrad C, et al.: L’integrina Alfa1beta1 è fondamentale per l’accumulo di cellule T epidermiche e lo sviluppo della psoriasi. Nat Med 2007; 13(7): 836-842.
- Ganguly D, et al.: Complessi peptidici auto-RNA-antimicrobici attivano le cellule dendritiche umane attraverso TLR7 e TLR8. J Exp Med 2009 Aug 31; 206(9): 1983-1994.
- Conrad C, Meller S, Gilliet M: Le cellule dendritiche plasmacitoidi nella pelle: percepire o non percepire gli acidi nucleici. Semin Immunol 2009; 21(3): 101-109.
- Uyemura K, et al: La rete di citochine nella pelle psoriasica lesionata e priva di lesioni è caratterizzata da una risposta mediata dalle cellule T-helper di tipo 1. J Invest Dermatol 1993; 101(5): 701-705.
- Lowes MA, et al: Le lesioni della psoriasi vulgaris contengono popolazioni discrete di cellule T Th1 e Th17. J Invest Dermatol 2008; 128(5): 1207-1211.
- Tonel G, Conrad C: Interazione tra cheratinociti e cellule immunitarie – recenti intuizioni sulla patogenesi della psoriasi. Int J Biochem Cell Biol 2009; 41(5): 963-968.
- Zheng Y, et al: L’interleuchina-22, una citochina T(H)17, media l’infiammazione cutanea e l’acantosi indotta da IL-23. Natura 2007; 445(7128): 648-651.
- Tonel G, et al.: Un ruolo funzionale critico per l’IL-23 nella psoriasi. J Immunol 2010; 185(10): 5688-5691.
- Liang SC, et al: L’interleuchina (IL)-22 e l’IL-17 sono coespresse dalle cellule Th17 e migliorano in modo cooperativo l’espressione dei peptidi antimicrobici. J Exp Med 2006; 203(10): 2271-2279.
- Wolk K, et al: L’IL-22 aumenta l’immunità innata dei tessuti. Immunità 2004; 21(2): 241-254.
- Peric M, et al.: L’IL-17A aumenta l’espressione della vitamina D3 indotta dal peptide antimicrobico catelicidina nei cheratinociti umani. J Immunol 2008; 181(12): 8504-8512.
- Sánchez FO, et al: Le varianti del gene IFN-fattore regolatore 5 interagiscono con il locus MHC di classe I nella popolazione svedese affetta da psoriasi. J Invest Dermatol 2008; 128(7): 1704-1709.
- Nair RP, et al: L’analisi delle sequenze e degli aplotipi supporta l’HLA-C come gene di suscettibilità 1 alla psoriasi. Am J Hum Genet 2006; 78(5): 827-851.
- Cargill M, et al: Uno studio di associazione genetica su larga scala conferma IL12B e porta all’identificazione di IL23R come geni di rischio per la psoriasi. Am J Hum Genet 2007; 80(2): 273-290.
- Capon F, et al.: Le varianti di sequenza nei geni per il recettore dell’interleuchina-23 (IL23R) e il suo ligando (IL12B) conferiscono protezione contro la psoriasi. Hum Genet 2007; 122(2): 201-206.
- Flatz L, Conrad C: Ruolo dell’infiammazione mediata dalle cellule T nella psoriasi: patogenesi e terapia mirata. Psoriasi: Obiettivi e Terapia 2013; 3: 1-10.
- Baugh JA, Bucala R: Meccanismi di modulazione del TNF alfa nelle malattie immunitarie e infiammatorie. Curr Opin Drug Discov Devel 2001; 4(5): 635-650.
- Oh CJ, Das KM, Gottlieb AB: Il trattamento con l’anticorpo monoclonale anti-fattore di necrosi tumorale alfa (TNF-alfa) riduce drasticamente l’attività clinica delle lesioni della psoriasi. J Am Acad Dermatol 2000; 42(5 Pt 1): 829-830.
- Leonardi CL, et al. (investigatori dello studio PHOENIX 1): PHOENIX Efficacia e sicurezza di ustekinumab, un anticorpo monoclonale umano contro l’interleuchina-12/23, nei pazienti con psoriasi: risultati a 76 settimane di uno studio randomizzato, in doppio cieco, controllato con placebo (PHOENIX 1). Lancet 2008; 371(9625): 1665-1674.
- Papp KA, et al. (investigatori dello studio PHOENIX 2): Efficacia e sicurezza di ustekinumab, un anticorpo monoclonale umano interleuchina-12/23, nei pazienti con psoriasi: risultati a 52 settimane di uno studio randomizzato, in doppio cieco, controllato con placebo (PHOENIX 2). Lancet 2008; 371(9625): 1675-1684.
- Griffiths CE, et al. (Gruppo di studio ACCEPT): Confronto tra ustekinumab ed etanercept per la psoriasi da moderata a grave. N Engl J Med 2010; 362(2): 118-128.
- Reich K, et al: Uno studio di 52 settimane di confronto tra briakinumab e metotrexato nei pazienti con psoriasi. N Engl J Med 2011; 365(17): 1586-1596.
- Ryan C, et al: Associazione tra terapie biologiche per la psoriasi cronica a placche ed eventi cardiovascolari: una meta-analisi di studi controllati randomizzati. JAMA 2011; 306(8): 864-871.
- Simon T, et al: Livelli circolanti di interleuchina-17 ed esiti cardiovascolari nei pazienti con infarto miocardico acuto. Eur Heart J 2013 Feb; 34(8): 570-577.
- Conrad C, Trueb RM: Pioderma gangrenoso. J Dtsch Dermatol Ges 2005; 3(5): 334-342.
- Maurer M, et al: Omalizumab per il trattamento dell’orticaria cronica idiopatica o spontanea. N Engl J Med 2013 Mar 7; 368(10): 924-935.
- Caorsi R, Federici S, Gattorno M: Farmaci biologici nelle sindromi autoinfiammatorie. Autoimmune Rev 2012 Nov; 12(1): 81-86.
- Ott PA, Hodi FS, Robert C: Blocco di CTLA-4 e PD-1/PD-L1: nuove modalità immunoterapiche con beneficio clinico duraturo nei pazienti con melanoma. Clin Cancer Res 2013 Oct 1; 19(19): 5300-5309.
PRATICA DERMATOLOGICA 2014; 24(5): 6-8