È comune che la diagnosi di PPCM venga fatta solo in caso di shock cardiogeno, perché l’insufficienza cardiaca si è aggravata rapidamente o i sintomi sono stati interpretati erroneamente come sintomi legati alla gravidanza o al post-partum. Secondo un recente studio, la bromocriptina sembra contribuire al recupero della funzione cardiaca.
Sintomatologia e diagnostica
I sintomi principali della PPCM sono la dispnea e l’affaticamento progressivi. Spesso la malattia viene riconosciuta in ritardo, poiché si presume che si tratti di una mancanza di respiro legata alla gravidanza o di comuni sintomi di esaurimento dopo il parto. La tosse viene spesso interpretata erroneamente come un’infezione broncopolmonare. Accade più volte che la diagnosi di PPCM venga fatta solo in caso di shock cardiogeno, perché l’insufficienza cardiaca si è aggravata rapidamente o i sintomi sono stati interpretati male in precedenza.
È difficile distinguere i cambiamenti fisiologici al termine della gravidanza associati a tachicardia sinusale, respiro corto ed edema dalla PPCM. Pertanto, è necessario sensibilizzare tutti i medici coinvolti a questo quadro clinico. In Germania, Danimarca e Stati Uniti, i decorsi molto gravi della malattia sono descritti in circa il 15% dei casi e la mortalità è del 2-4% [1–3]. In Sudafrica e in Turchia, i decessi sono significativamente più frequenti; in questi Paesi si registra una mortalità del 15-24% [4,5].
Se si sospetta una dispnea legata all’insufficienza cardiaca, si devono determinare nel siero i marcatori di insufficienza cardiaca BNP o NT-proBNP e l’enzima cardiaco altamente sensibile troponina T o I. Se tutti i valori rientrano nel range di normalità, un’insufficienza cardiaca rilevante è praticamente esclusa. Se i valori sono elevati, sono necessari ulteriori chiarimenti. A seconda dei sintomi, l’intervento può essere effettuato in regime ambulatoriale da un cardiologo o in ospedale. La procedura diagnostica più importante è l’ecocardiografia. Se viene rilevata per la prima volta una frazione di eiezione ridotta <45% e vengono escluse altre cause di funzione cardiaca ridotta, viene fatta la diagnosi di PPCM. Devono essere prese in considerazione anche altre diagnosi differenziali, come l’infarto del miocardio o l’embolia dell’arteria polmonare.
Definizione ed epidemiologia
La PPCM è definita come insufficienza cardiaca sistolica idiopatica con una frazione di eiezione ridotta <45% che si verifica nelle ultime settimane di gravidanza fino a pochi mesi dopo la nascita [6]. La PPCM è una malattia a sé stante e non, come spesso si ritiene, un peggioramento di una cardiomiopatia preesistente di origine diversa. Devono essere escluse malattie cardiache come un difetto cardiaco congenito, una cardiomiopatia dilatativa familiare o un danno cardiaco in seguito a precedenti chemioterapie e/o radiazioni toraciche. Questo non è sempre possibile a causa dei risultati preliminari mancanti. Tuttavia, quasi tutte le pazienti riferiscono benessere e buona resistenza fisica prima e spesso durante la gravidanza. Alcuni avevano un ecocardiogramma non rilevante come parte di un precedente esame di routine, ad esempio per chiarire le palpitazioni o l’ipertensione arteriosa verificatasi durante la gravidanza. Nel caso di una cardiomiopatia preesistente, i sintomi dell’insufficienza cardiaca di solito iniziano già nella fase di 1. fino a quando Secondo trimestre. La maggior parte delle pazienti affette da PPCM diventa sintomatica solo durante o dopo il parto; in questo momento, il carico circolatorio aumenta per un breve periodo perché il volume di distribuzione del sangue materno si riduce acutamente in assenza di circolazione placentare, ma si riduce di nuovo rapidamente rispetto alla gravidanza avanzata.
È difficile separare la PPCM dalla miocardite. In uno studio su 1230 pazienti con cardiomiopatia di eziologia non chiara, queste potevano essere distinte tra loro sulla base di biopsie endomiocardiche [7]. Ulteriori studi riportano che i risultati positivi al virus si verificano anche nelle persone sane [8]. È interessante notare che molti pazienti nei registri tedeschi mostrano livelli di proteina C-reattiva (CRP) solo moderatamente o non elevati [1]. Al contrario, le reazioni autoimmuni giocano probabilmente un ruolo importante nella patogenesi della PPCM [9]. La biopsia miocardica o il cateterismo cardiaco di solito non sono necessari nella PPCM tipica.
L’incidenza della PPCM varia da regione a regione. In Nigeria, la PPCM sembra essere molto comune in alcune regioni, con 1 ogni 100 gravidanze. Anche Haiti, con 1 su 299, e il Sudafrica, con 1 su 1000 gravidanze, sono punti caldi [10]. Negli Stati Uniti, negli ultimi decenni è stato registrato un aumento dell’incidenza di 1 per 1149-3189. In Germania, si ipotizza 1 malattia ogni 1000-1500 nascite.
Fisiopatologia
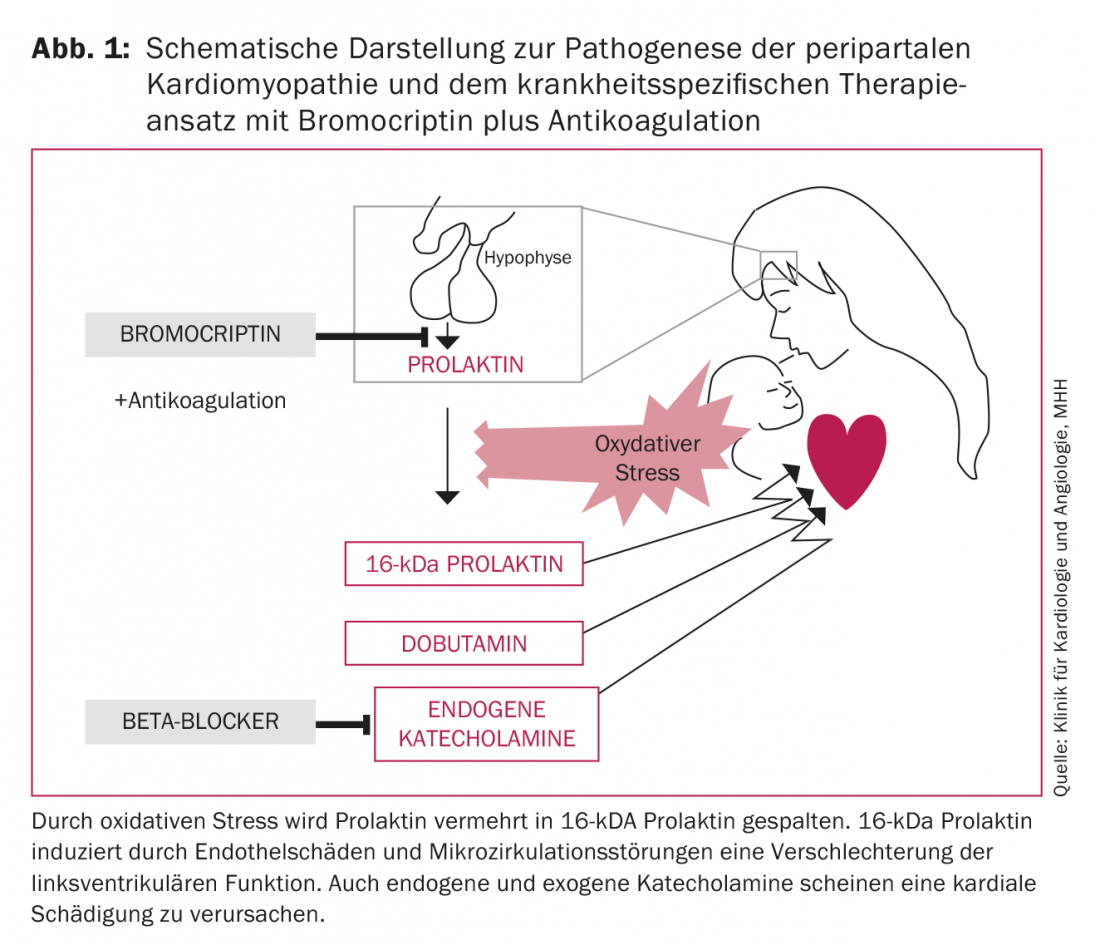
I fattori scatenanti della PPCM non sono ancora sufficientemente chiari. Attualmente si ipotizza una genesi multifattoriale per il quadro completo della PPCM. Vengono discusse varie eziologie come l’infiammazione, l’infezione virale o batterica, la malattia autoimmune, le caratteristiche genetiche e lo stress ossidativo. Quest’ultima osservazione, in particolare, rappresenta il primo approccio terapeutico specifico in aggiunta alla terapia dell’insufficienza cardiaca. Per esempio, Hilfiker-Kleiner et al. mostrano che lo stress ossidativo provoca un aumento del clivaggio della prolattina a 16-kDa prolattina. Questo prodotto di scissione da 16 kDa attacca i vasi sanguigni e soprattutto l’endotelio, inducendo così la disfunzione endoteliale e la degradazione dei capillari. Inoltre, agisce come angiostatico e quindi impedisce la rigenerazione dei vasi sanguigni [11]. Le conseguenze sono il danno endoteliale, i disturbi microcircolatori e quindi il deterioramento della funzione ventricolare sinistra (LV) (Fig. 1). La terapia con l’agonista della dopamina bromocriptina inibisce la secrezione di prolattina, previene lo sviluppo dell’insufficienza cardiaca nel modello murino 100% [11] e migliora significativamente la funzione LV nei pazienti con PPCM [1,4,12,13]. Gli esiti patologici più favorevoli pubblicati finora sono stati osservati nello studio multicentrico randomizzato tedesco di recente pubblicazione sulla terapia con bromocriptina nei pazienti affetti da PPCM [14]: non si sono verificati decessi con la terapia con bromocriptina, nessun paziente ha richiesto un trapianto di cuore o un supporto cardiaco meccanico e la funzione sistolica ventricolare sinistra è stata completamente recuperata nel 62% (Fig. 2).
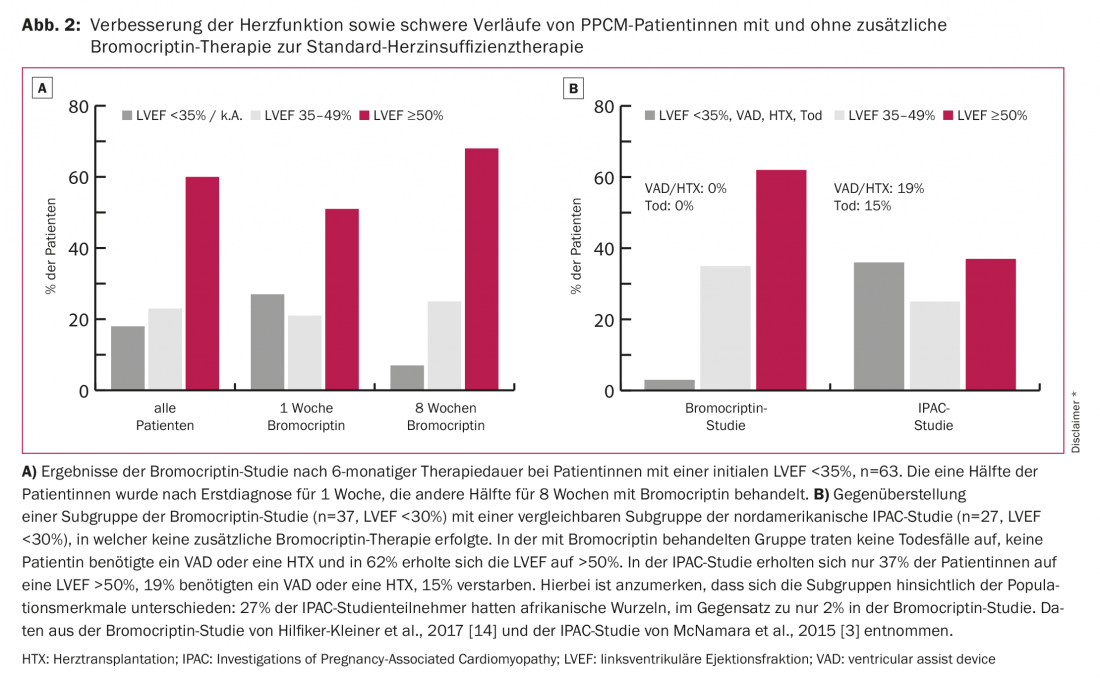
*Questa figura è stata tradotta e ristampata su autorizzazione della Oxford University Press per conto del CES. OUP e il CES non sono responsabili né in alcun modo dell’accuratezza della traduzione. Il traduttore è l’unico responsabile della traduzione contenuta in questa pubblicazione.
Terapia
I pazienti emodinamicamente stabili con segni clinici di scompenso cardiaco, come dispnea ed edema alle gambe, vengono trattati in condizioni di degenza con diuretici dell’ansa e avviati rapidamente a una terapia per l’insufficienza cardiaca composta da ACE-inibitore/antagonista del recettore AT-1, betabloccante e antagonista del recettore mineralcorticoide (MRA). I preparati devono essere aumentati alla dose massima tollerata della terapia standard per l’insufficienza cardiaca. Se l’up-dosing dei beta-bloccanti non è possibile a causa di valori ipotensivi della pressione arteriosa (<90 mmHg sistolica), si raccomanda di abbassare la frequenza cardiaca con l’ivabradina, poiché l’abbassamento precoce della frequenza cardiaca sembra essere associato a un miglioramento della funzione LV [15]. Oltre alla terapia standard per l’insufficienza cardiaca, il trattamento con bromocriptina deve essere somministrato a una dose dipendente dalla gravità del decorso della malattia (Fig. 3), poiché è molto probabile che la terapia iniziale con bromocriptina attenui l’estensione della malattia [14]. A causa delle possibili proprietà protrombogeniche della bromocriptina, l’anticoagulazione è obbligatoria, almeno nelle dosi di tromboprofilassi.
I pazienti compromessi dal punto di vista emodinamico o respiratorio devono essere trattati nell’unità di terapia intensiva. Se la pressione arteriosa sistolica è >110 mmHg, si possono utilizzare anche i vasodilatatori. In caso di instabilità emodinamica e di indicazione alla terapia con catecolamine, si deve considerare precocemente l’impianto di un sistema di supporto circolatorio temporaneo, come una pompa cardiaca impiantabile (Impella®). In caso di insufficienza circolatoria e polmonare, si deve prendere in considerazione anche l’ossigenazione extracorporea a membrana (ECMO) veno-arteriosa. Questo è l’unico modo per alleviare il cuore, risparmiando o addirittura eliminando completamente le catecolamine. L’uso di catecolamine e in particolare della dobutamina sembra essere associato a un aumento della mortalità e dovrebbe essere evitato quando possibile [16,17]. Più vantaggioso è probabilmente l’inotropo levosimendan, che non aumenta il consumo di ossigeno del cuore e ha mostrato risultati promettenti in un piccolo studio [18]. Il decorso della malattia varia molto tra gli individui.
Se la stabilizzazione emodinamica può essere raggiunta tramite le terapie sopra citate, la nostra esperienza dimostra che un lento recupero è ancora possibile settimane dopo. È fondamentale diagnosticare e trattare le comorbidità, come le infezioni dell’utero o la mastite. È necessario un approccio interdisciplinare, soprattutto per questi pazienti gravemente malati. Se non è possibile ottenere lo svezzamento dal sistema di supporto percutaneo temporaneo dopo circa 14 giorni, nonostante queste misure, si ricorre a sistemi di supporto permanenti, come un dispositivo di assistenza ventricolare (VAD) impiantato chirurgicamente.
La lista per il trapianto di cuore deve essere fatta se la funzione cardiaca non è migliorata dopo 6-12 mesi e l’espianto del VAD non sembra possibile. A seconda del livello di prolattina, trattiamo i pazienti in terapia intensiva che sono ventilati artificialmente o che richiedono un supporto circolatorio meccanico con un massimo di 20 mg di bromocriptina al giorno per almeno otto settimane, con una riduzione graduale della dose in base allo sviluppo clinico e sotto controllo dei livelli di prolattina (fig. 3).
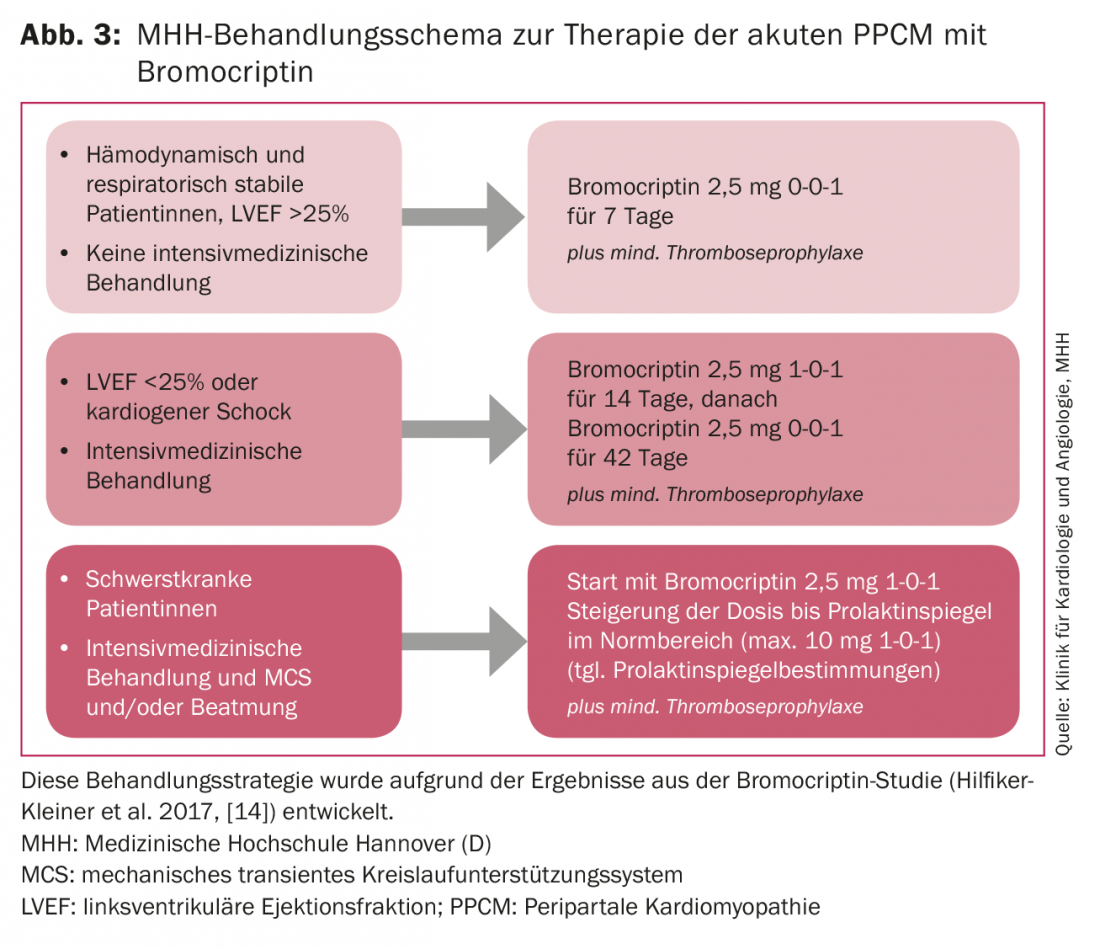
I sistemi di supporto circolatorio possono provocare un aumento dei livelli di prolattina, per cui è necessario monitorarli attentamente. Corsi così drammatici sono fortunatamente rari in Germania e la pianificazione della terapia richiede sempre decisioni prese caso per caso. È necessario un trasferimento precoce in un centro esperto. La strategia di trattamento consigliata per i pazienti con PPCM è riassunta nell’algoritmo BOARD: Bromocriptina, farmaci orali per l’insufficienza cardiaca, anticoagulazione, vaso-rilassanti e diuretici [19].
Pazienti in gravidanza
La terapia dell’insufficienza cardiaca con ACE-inibitori, antagonisti AT-1 e antagonisti del recettore mineralcorticoide è controindicata durante la gravidanza. I beta-bloccanti possono e devono essere utilizzati anche in gravidanza per la PPCM, mentre i diuretici devono essere usati con cautela e solo in caso di congestione venosa polmonare sintomatica, poiché esiste il rischio di sottoperfusione placentare.
La gravidanza può essere portata avanti nelle pazienti cardiopolmonari stabili, sotto stretta assistenza cardiologica e ginecologica. Il parto vaginale è possibile, ma la procedura di parto deve essere decisa individualmente in équipe dagli ostetrici e dai cardiologi presenti. Per ridurre il pesante carico cardiaco nella tarda gravidanza, la sectio primaria viene spesso pianificata a partire dalla 36esima settimana di gravidanza.
Nelle pazienti emodinamicamente instabili, il parto deve essere tentato immediatamente, indipendentemente dall’età del bambino. La maturità polmonare del bambino può essere indotta. In questo caso, si consiglia il parto primario in anestesia combinata spinale ed epidurale [20].
Dopo il parto, le pazienti affette da PPCM dovrebbero essere svezzate con la bromocriptina e continuare a prenderla, inibendo così la formazione del prodotto di scissione della prolattina 16-kDa che contribuisce alla malattia ed evitando alla madre lo stress metabolico aggiuntivo dell’allattamento. Gli ACE-inibitori e gli antagonisti del recettore mineralcorticoide (MRA) passano nel latte materno. Pertanto, la terapia ottimale dell’insufficienza cardiaca è possibile solo con lo svezzamento del bambino.
Cura successiva
La terapia dell’insufficienza cardiaca deve seguire le linee guida della Società Europea di Cardiologia [21]. La PPCM, a differenza di altre cardiomiopatie, ha un’alta percentuale di remissioni. Nel frattempo, >90% dei pazienti in Germania migliora e >60% mostra una funzione LV completamente recuperata ≥50%. La rigenerazione della funzione LV richiede tempi diversi: in alcuni pazienti, la funzione LV ritorna normale dopo poche settimane, in altri il processo di guarigione può richiedere diversi mesi o addirittura anni.
Pertanto, i pazienti con una LVEF <35% dovrebbero essere inizialmente dotati di un defibrillatore indossabile a gilet per proteggerli dall’aumento del rischio di morte cardiaca improvvisa [22]. Se necessario, questo dovrebbe essere indossato ben oltre il periodo di 3 mesi prima che venga presa una decisione in merito a un defibrillatore impiantabile.
Anche dopo il recupero completo della funzione LV, si consiglia di continuare la terapia per l’insufficienza cardiaca per almeno sei mesi. Solo allora, a partire dall’MRA, le sostanze possono essere ridotte e sospese individualmente e sotto controllo ecocardiografico regolare [23]. Ci sono sempre pazienti la cui funzione LV si deteriora con una terapia ridotta per l’insufficienza cardiaca, per cui è necessaria una terapia a lungo termine.
Una nuova gravidanza comporta un aumento del rischio di recidiva di PPCM in tutte le pazienti con PPCM, soprattutto se la funzione cardiaca non ha recuperato una LVEF >50% [24]. Questo deve essere discusso con i pazienti e i loro partner. Se si verifica una nuova gravidanza – pianificata o non pianificata – raccomandiamo una consulenza presso un centro specializzato in PPCM. Un farmaco per l’insufficienza cardiaca esistente deve essere cambiato, se necessario, per evitare possibili effetti collaterali sul feto. La gravidanza deve essere seguita da vicino e in modo interdisciplinare e il parto deve essere pianificato con cura. Il trattamento immediato con bromocriptina e farmaci per l’insufficienza cardiaca dopo il parto di solito suggerisce una prognosi favorevole. Durante la consulenza, bisogna tenere presente che un aborto precoce non può necessariamente prevenire l’insorgenza della PPCM. D’altra parte, molte pazienti con una funzione LV compromessa hanno una gravidanza successiva senza gravi complicazioni.
Sommario
La PPCM è un’insufficienza cardiaca che spesso è acuta, ma può anche essere subacuta, verificandosi poco prima, durante o alcuni mesi dopo la nascita. Oltre ai sintomi clinici, sono indicativi l’aumento dei valori di BNP o NT-proBNP e l’evidenza ecocardiografica di una ridotta funzione LV <45%. Per evitare decorsi fatali, sono indispensabili una diagnosi rapida e l’inizio della terapia. Spesso è necessaria una terapia a lungo termine per l’insufficienza cardiaca; inoltre, deve essere somministrato un trattamento iniziale con bromocriptina. Il proseguimento della gravidanza, anche dopo il recupero completo della funzione LV, comporta un rischio maggiore di recidiva e deve essere assolutamente gestito in centri esperti.
Messaggi da portare a casa
- La cardiomiopatia peripartum (PPCM) si riferisce all’insufficienza cardiaca che si verifica al momento del parto in donne precedentemente sane.
- L’affanno prima o dopo il parto non deve essere banalizzato come associato alla gravidanza o come un’infezione broncopolmonare senza un’ulteriore diagnosi.
- Se l’insufficienza cardiaca peripartum viene diagnosticata per la prima volta, la consulenza e, se necessario, il trattamento devono essere forniti da un centro esperto, poiché si verificano ripetutamente casi fatali.
- Oltre alla terapia standard per l’insufficienza cardiaca, il trattamento con bromocriptina sembra migliorare il recupero della funzione cardiaca.
Letteratura:
- Haghikia A, et al: Fenotipizzazione ed esito della gestione contemporanea in una coorte tedesca di pazienti con cardiomiopatia peripartum. Basic Res Cardiol 2013; 108: 366.
- Ersbøll AS, et al: Cardiomiopatia peripartum in Danimarca: uno studio retrospettivo, basato sulla popolazione, su incidenza, gestione ed esito. Eur J Heart Fail 2017 Jun 8. doi: 10.1002/ejhf.882. [Epub ahead of print].
- McNamara DM, et al: Esiti clinici della cardiomiopatia peripartum in Nord America. Risultati dello studio IPAC (Investigations of Pregnancy-Associated Cardiomyopathy). J Am Coll Cardiol 2015; 66: 905-914.
- Sliwa K, et al: Valutazione della bromocriptina nel trattamento della cardiomiopatia peripartum acuta grave: uno studio pilota proof-of-concept. Circolazione 2010; 121(13): 1465-1473.
- Biteker M, et al: Recupero ritardato nella cardiomiopatia peripartum: un’indicazione per un follow-up a lungo termine e una terapia sostenuta. Eur J Heart Fail 2012; 14(8): 895-901.
- Sliwa K, et al.: Stato attuale delle conoscenze sull’eziologia, la diagnosi, la gestione e la terapia della cardiomiopatia peripartum: una dichiarazione di posizione del Gruppo di lavoro sulla cardiomiopatia peripartum della Heart Failure Association della Società Europea di Cardiologia. Eur J Heart Fail 2010; 12: 767-778.
- Felker GM, et al: Cause sottostanti e sopravvivenza a lungo termine nei pazienti con cardiomiopatia inizialmente inspiegata. N Engl J Med 2000; 342(15): 1077-1084.
- Selle T, et al: Revisione della cardiomiopatia peripartum: stato attuale delle conoscenze. Future Cardiol 2009; 5: 175-189.
- Haghikia A, et al: Evidenza di autoanticorpi contro la troponina I cardiaca e la miosina sarcomerica nella cardiomiopatia peripartum. Basic Res Cardiol 2015; 110(6): 60.
- Hilfiker-Kleiner D, Sliwa K: Fisiopatologia ed epidemiologia della cardiomiopatia peripartum. Nat Rev Cardiol 2014; 11(6): 364-370.
- Hilfiker-Kleiner D, et al.: Una forma di prolattina 16 kDa, scissa dalla catepsina D, media la cardiomiopatia post-partum. Cellula 2007; 128: 589-600.
- Jahns B, et al.: Cardiomiopatia peripartum – una nuova opzione di trattamento attraverso l’inibizione della secrezione di prolattina. Am J Obstet Gynecol 2008; 199(4): e5-6.
- Meyer GP, et al: Il trattamento con bromocriptina associato al recupero dalla cardiomiopatia peripartum nei fratelli: due rapporti di casi 2010; 4: 80.
- Hilfiker-Kleiner D, et al: Bromocriptina per il trattamento della cardiomiopatia peripartum: uno studio multicentrico randomizzato. Eur Heart J 2017; 38(35): 2671-2679.
- Haghikia A, et al: Trattamento precoce con ivabradina nei pazienti con cardiomiopatia peripartum acuta: sottoanalisi del registro tedesco PPCM. Int J Cardiol 2016; 216: 165-167.
- Stapel B, et al: La bassa espressione di STAT3 sensibilizza agli effetti tossici della stimolazione dei recettori β-adrenergici nella cardiomiopatia peripartum. Eur Heart Jour 2017; 36: 349-361.
- Bauersachs J, et al: Gestione attuale dei pazienti con cardiomiopatia peripartum acuta grave: guida pratica dell’Associazione per lo Scompenso Cardiaco del Gruppo di Studio della Società Europea di Cardiologia sulla cardiomiopatia peripartum. Eur J Heart Fail 2016; 18(9): 1096-1105.
- Labbene I, et al: Effetti decongestionanti del levosimendan nello shock cardiogeno indotto dalla cardiomiopatia post-partum. Anaesth Crit Care Pain Med 2017; 36(1): 39-42.
- Arrigo M, et al: Bromocriptina per il trattamento della cardiomiopatia peripartum: benvenuto su BOARD. Eur Heart J 2017; 38(35): 2680-2682.
- Società Europea di Ginecologia (ESG), Associazione Europea di Cardiologia Pediatrica (AEPC), Società Tedesca di Medicina di Genere (DGesGM), et al: Linee guida ESC sulla gestione delle malattie cardiovascolari in gravidanza. La Task Force sulla gestione delle malattie cardiovascolari in gravidanza della Società Europea di Cardiologia (ESC). Eur Heart Jour 2011; 32: 3147-3197.
- Ponikowski P, et al.: Linee guida ESC 2016 per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica. La Task Force per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica della Società Europea di Cardiologia (ESC). Eur J Heart Fail 2016; 18: 891-975.
- Duncker D, et al: Rischio di aritmia pericolosa per la vita nella cardiomiopatia peripartum con bassa frazione di eiezione di nuova diagnosi: un’analisi multicentrica tedesca. Clin Res Cardiol 2017; 106(8): 582-589.
- Hilfiker-Kleiner D, et al: Cardiomiopatia peripartum: gestione attuale e prospettive future. Eur J Heart Fail 2015; 36: 1090-1097.
- Hilfiker-Kleiner D, et al: Esito delle gravidanze successive nelle pazienti con una storia di cardiomiopatia peripartum. Eur J Heart Fail 2017 Mar 27. doi: 10.1002/ejhf.808. [Epub ahead of print].
CARDIOVASC 2018; 17(1): 8-12