Les nouveaux anticoagulants oraux (NOAK) sont entrés depuis longtemps dans la pratique clinique quotidienne pour la prévention des AVC en cas de fibrillation auriculaire. En raison de leur utilisation plus simple, plus sûre et plus efficace, on peut s’attendre à ce qu’ils remplacent le traitement par antagonistes de la vitamine K (AVK) chez la majorité des patients. Cependant, comme pour toute thérapie, il y a des aspects pratiques importants à prendre en compte pour une utilisation correcte et sûre. L’utilisation non sélective des substances doit être évitée dans tous les cas.
Les grandes études d’homologation des nouveaux anticoagulants oraux (NOAK) pour la prévention thromboembolique de la fibrillation auriculaire – RE-LY (dabigatran) [1], ROCKET-AF (rivaroxaban) [2], ARISTOTLE (apixaban) [3] ainsi que ENGAGE-TIMI 48 (edoxaban) [4] – ont démontré que que ces substances sont non seulement au moins équivalentes, voire supérieures aux antagonistes de la vitamine K (AVK) en termes de prévention des AVC, mais aussi et surtout qu’elles réduisent considérablement le risque d’hémorragies intracrâniennes et/ou les plus graves [5–7]. L’une des plus grandes erreurs consiste toutefois à considérer ces substances de manière indifférenciée comme des médicaments “taille unique” et à les utiliser de manière non critique et non sélective. Le présent article résume dix aspects importants dans l’application quotidienne (en s’appuyant sur des travaux antérieurs et en les complétant [5–9]).
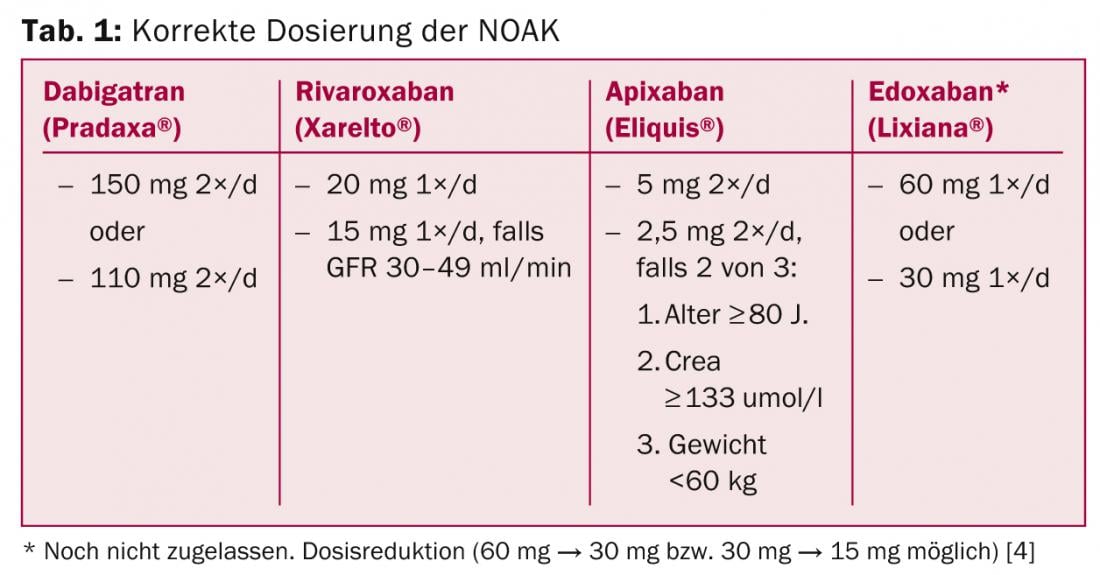
Question 1 : Quel est le dosage correct ?
Le tableau 1 résume la posologie correcte des NOAK. Les dérogations à cette règle sont des utilisations “hors étiquette” et doivent être évitées en raison de l’absence de données (par exemple, la prescription de 10 mg de rivaroxaban chez les patients présentant une FVH et un “risque élevé de saignement”). Le traitement initial est nettement plus simple qu’avec les AVK, car le plein effet est obtenu au bout de deux à trois heures – sans qu’il soit nécessaire de procéder à un pontage au moyen d’héparine ou d’HNM.
Question 2 : Que faire en cas d’oubli d’une dose ?
La compliance/adhésion au médicament est essentielle avec les NOAK et il ne faut négliger aucune occasion de le rappeler au patient. Néanmoins, des erreurs de dosage se produisent naturellement dans la pratique clinique quotidienne. Sur la base d’extrapolations pharmacocinétiques, il est recommandé de prendre une dose oubliée jusqu’à six heures (pour les doses 2×/d, c’est-à-dire apixaban/dabigatran) ou jusqu’à douze heures (pour les doses 1×/d, c’est-à-dire rivaroxaban) après la prise prévue [10]. Si l’erreur n’est constatée qu’après cette fenêtre, la dose doit être omise et la prochaine prise prévue doit être poursuivie.
Question 3 : Que faire en cas de double prise accidentelle ?
Pour les NOAK en prise 2×/d, en cas de double dose accidentelle, la prochaine dose prévue doit être omise et le cycle régulier doit être repris avec la deuxième dose suivante [10]. En cas de dosage 1×/d, le cycle normal doit être poursuivi, car après 24 heures, une grande partie de la substance est déjà éliminée, même en cas de double dosage accidentel.
Question 4 : Que faire si le patient n’est pas sûr de la prise ?
Il n’est pas rare de rencontrer au quotidien des situations où le patient ne sait pas s’il a déjà pris son médicament ou non. Pour les NOAK pris 2×/d, il est recommandé de ne pas prendre de dose supplémentaire (afin d’éviter un surdosage, puisque la dose suivante sera de toute façon prise dans les 12 heures). En revanche, en cas de prise 1×/d, il est recommandé de prendre la dose potentiellement oubliée, car la prochaine prise n’aura lieu que dans 24 heures et il y aurait donc une période prolongée sans protection pertinente [10].
Question 5 : Comment les NOAK sont-ils utilisés en cas d’insuffisance rénale ?
Les patients atteints d’insuffisance rénale constituent une population de patients difficile, car les complications thromboemboliques et hémorragiques sont plus fréquentes [11, 12]. En cas d’insuffisance rénale sévère et de fibrillation auriculaire, les NOAK n’ont pratiquement pas été étudiés et ne devraient donc pas être utilisés (même si certains d’entre eux sont également autorisés dans ce cas) [13]. Le problème est de trouver une bonne alternative – car les AVK sont également formellement contre-indiqués en cas de dysfonctionnement rénal sévère. Il a en effet été démontré que le bénéfice des AVK diminue avec l’altération de la fonction rénale [14]. Néanmoins, les AVK semblent actuellement être la meilleure option chez les patients souffrant de fibrillation auriculaire et d’insuffisance rénale sévère, compte tenu des cavesats mentionnés. Dans ce contexte, un réglage optimal de l’INR est plus que jamais essentiel.
La posologie de l’apixaban (clairance rénale de 50% de la substance résorbée) et du rivaroxaban (clairance rénale de 37%) est réduite en cas d’altération modérée de la fonction rénale (DFG 50 – 30 ml/min). (tableau 1). Les deux substances se sont révélées efficaces et sûres dans ce groupe de patients (par rapport aux AVK), et l’apixaban en particulier a démontré un très bon profil de sécurité par rapport aux AVK [11, 15]. En particulier, en présence d’autres facteurs de risque de saignement (comme l’âge ≥ 80 ans, le score HAS-BLED ≥ 3), il est recommandé de réduire la dose de dabigatran (clairance rénale de 80%) à 2 × 110 mg/j à partir d’un DFG <50 ml/min [13]. En principe, l’utilisation du dabigatran chez les patients ayant un DFG <40 ml/min doit être bien pesée, car l’expérience montre que chez ces patients, une détérioration supplémentaire de la fonction rénale peut rapidement survenir avec une accumulation correspondante de la substance, par exemple dans le cadre de maladies intercurrentes, d’une co-médication (AINS !), ou d’une déshydratation.
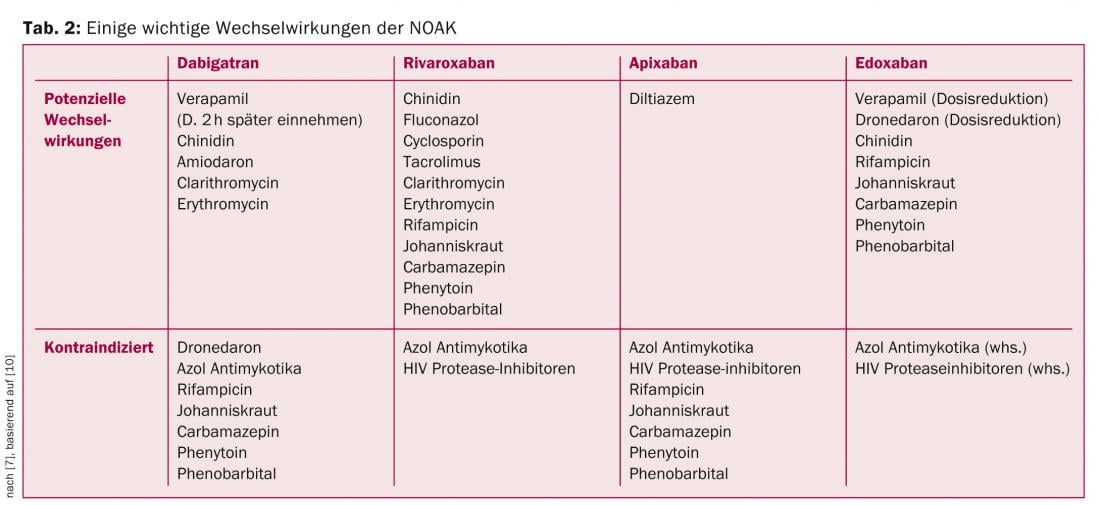
Question 6 : Y a-t-il des interactions avec d’autres médicaments ?
Bien que les NOAK aient un potentiel d’interaction médicamenteuse nettement plus faible que les AVK, certaines interactions importantes doivent être prises en compte. Certaines des interactions les plus importantes sont résumées dans le tableau 2, sur la base des recommandations de l’EHRA [10].
Question 7 : Quelle est la procédure en cas de saignement sous NOAK ?
Les complications hémorragiques, en particulier les hémorragies intracrâniennes et les hémorragies mettant en jeu le pronostic vital, sont significativement moins fréquentes avec les NOAK qu’avec les AVK.
Des antidotes spécifiques à action rapide sont en cours de développement pour les NOAK, mais il est fort probable qu’il faudra encore quelques années avant qu’ils ne soient introduits dans la pratique clinique quotidienne. En conséquence, il faut recourir à des procoagulants non septiques comme le PCC, l’aPCC ou le FVIIa recombinant pour une antagonisation rapide. Cette situation n’est pas tout à fait différente de celle des AVK, car ici aussi, l’antagonisation “spécifique” par la vitamine K est loin d’être rapidement efficace en situation d’urgence. En principe, l’antagonisation d’un traitement anticoagulant, qu’il s’agisse d’un AVK ou d’un NOAK, n’est pas sans risque, car elle induit un état procoagulant. Ainsi, même la normalisation des paramètres de coagulation n’est pas nécessairement corrélée à une amélioration du résultat clinique, en particulier après une hémorragie intracrânienne [16–18]. Les recommandations de l’EHRA, qui reposent principalement sur des données précliniques et des extrapolations pharmacocinétiques, tiennent compte de cette réalité (figure 1) [10]. L’utilisation de procoagulants n’est donc recommandée qu’en cas d’hémorragie très grave et mettant en jeu le pronostic vital, tandis qu’en cas d’hémorragie légère ou modérée, on recourt en premier lieu à des mesures générales.
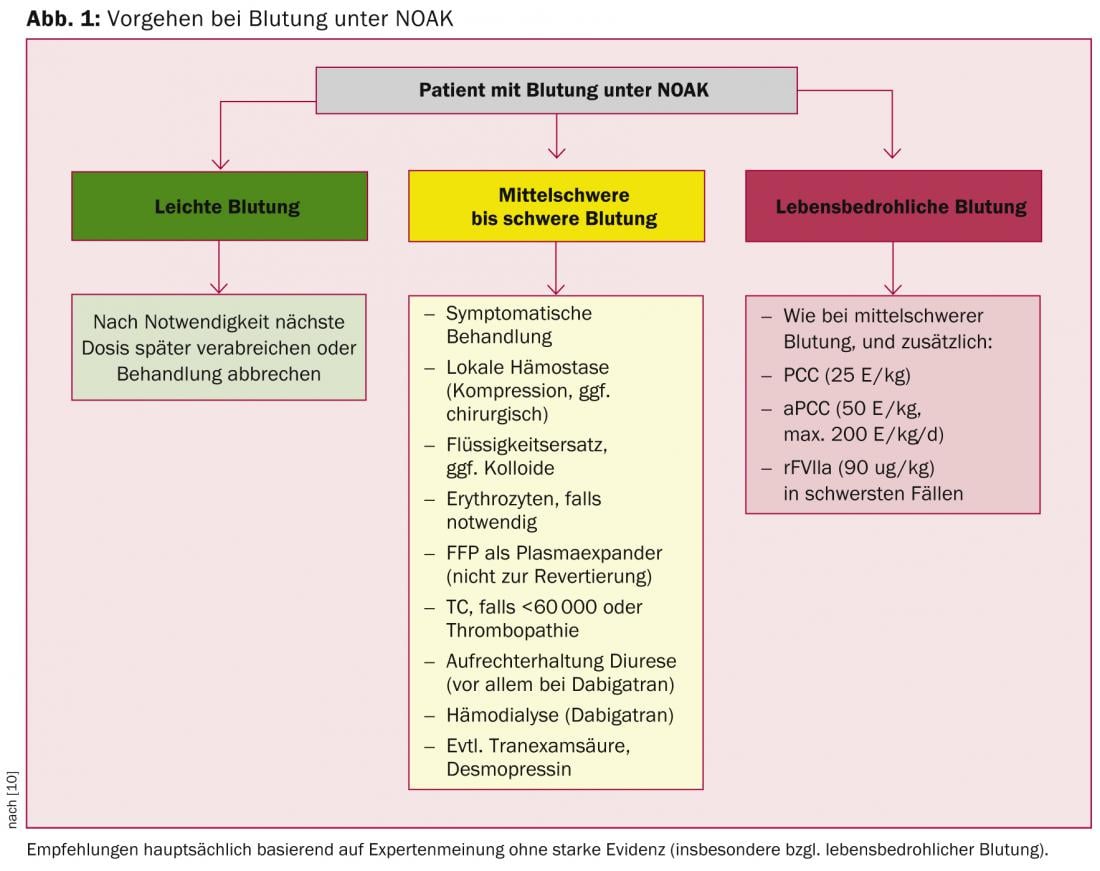
Question 8 : Quelle est la meilleure façon de procéder en cas de “triple anticoagulation” ?
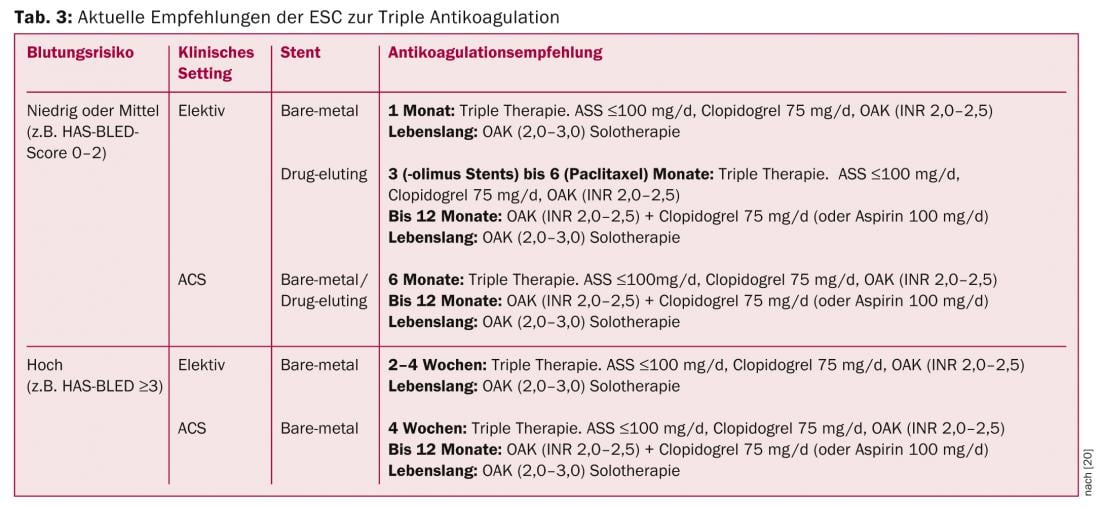
Les patients atteints de fibrillation auriculaire qui, en raison d’un SCA et/ou de l’implantation d’un stent, nécessitent formellement une double anticoagulation plaquettaire (dite “triple anticoagulation”) en plus de l’anticoagulation plasmatique (NOAK/VKA), présentent un risque fortement accru d’hémorragies graves [19]. Actuellement, à l’exception de quelques patients de l’étude RE-LY, il n’existe pas de données sur l’utilisation des NOAK en association avec l’aspirine et le clopidogrel. Il n’existe pas non plus de données sur l’association des AINS avec la nouvelle génération d’antagonistes des récepteurs ADP, le prasugrel et le ticagrelor. Il est donc déconseillé à ce stade de combiner ces substances. On peut s’attendre à ce que les recommandations soient encore adaptées au fur et à mesure que de nouvelles données apparaîtront, tant en ce qui concerne les stents de dernière génération que l’association des NOAK et des nouveaux antiagrégants plaquettaires. Toutefois, l’approche proposée dans les lignes directrices de l’ESC, à savoir l’ASA, le clopidogrel et les AVK, semble être la meilleure alternative à l’heure actuelle (tableau 3) [20]. L’étude WOEST, récemment publiée, a montré que l’association clopidogrel et AVK est supérieure à la “triple anticoagulation” classique, tant en termes d’événements hémorragiques que de critères ischémiques [21]. Au quotidien, la durée de la “triple anticoagulation” initialement recommandée dans les lignes directrices de l’ESC est donc déjà considérablement réduite, en fonction du contexte clinique.
Question 9 : Les NOAK peuvent-ils être utilisés en cas de cardioversion ?
Les meilleures données sur la cardioversion sous NOAK sont celles du dabigatran (de l’étude RE-LY) : Ce dernier s’est avéré aussi efficace que les AVK en termes d’accidents vasculaires cérébraux et d’hémorragies [22]. Pour le rivaroxaban et l’apixaban, le nombre de patients publiés jusqu’à présent est plus faible, mais va dans le même sens. Ce qui est décisif au quotidien, c’est la compliance ! Si l’on peut s’assurer que le patient a pris régulièrement le NOAK au cours des trois (mieux encore, quatre à cinq) semaines précédentes, une cardioversion sous NOAK semble réalisable en toute sécurité [10]. Dans le cas contraire, un thrombus doit être exclu par ETO. Les études et les registres en cours fourniront des données supplémentaires sur la meilleure procédure à suivre.
Question 10 : Comment fonctionne la gestion périopératoire ?
En raison de la pharmacocinétique des NOAK, aucun pontage n’est nécessaire en périopératoire (ce qui est également de moins en moins pratiqué pour les AVK). La recommandation d’arrêter le traitement par NOAK dépend du risque hémorragique de l’intervention ainsi que de la fonction rénale (influence la plus importante pour le dabigatran ; Tab. 4).
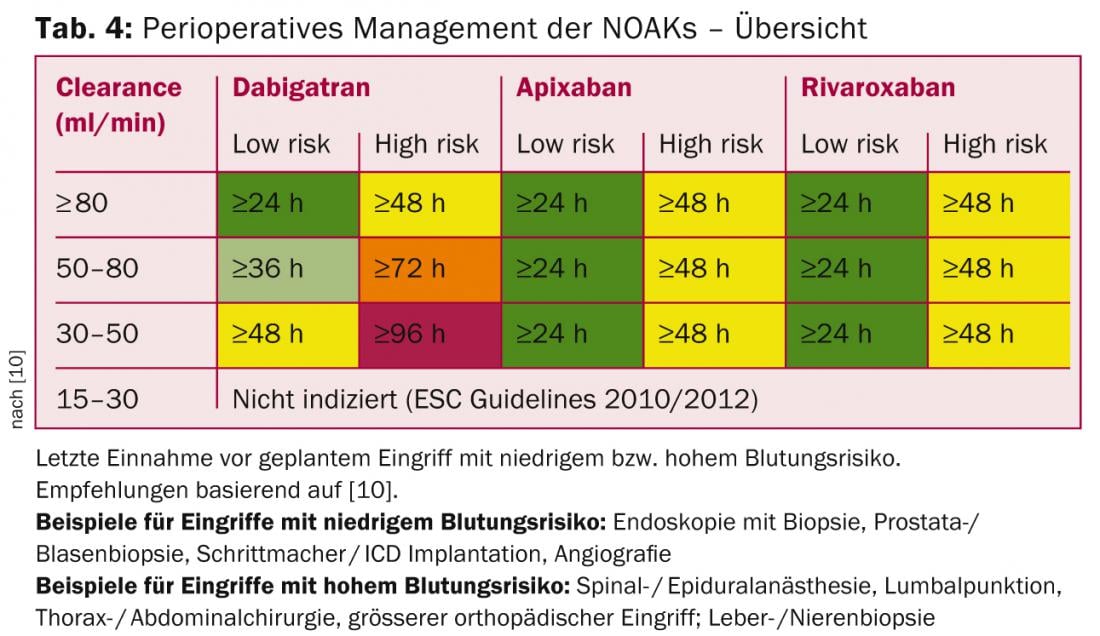
Pour les interventions à très faible risque hémorragique (interventions dentaires, cataracte, glaucome, endoscopie sans intervention), l’intervention peut généralement être réalisée au niveau de la vallée du NOAK (donc avant l’administration suivante prévue), avec prise de la dose suivante six heures plus tard (si l’hémostase est bonne) [10].
Après l’intervention, en cas d’hémostase directe ou complète, le traitement par NOAK peut être recommencé après seulement six à huit heures. En cas d’intervention majeure avec un risque de saignement encore présent, il peut être nécessaire d’attendre deux ou trois jours avant de recommencer. Dans ces situations, l’héparine non fractionnée ou de bas poids moléculaire à dose prophylactique doit être débutée six à huit heures après l’intervention. Après une hémostase sûre, le passage au NOAK se fait à pleine dose.
Résumé
En raison des études convaincantes et de la simplicité d’utilisation, les NOAK sont entrés depuis longtemps dans la pratique clinique quotidienne pour la prévention des AVC en cas de fibrillation auriculaire. Il n’existe pas de données issues d’études randomisées pour bon nombre des recommandations pratiques mentionnées. Il est donc nécessaire de formuler des recommandations sur la meilleure façon de réagir dans ces situations, en se basant sur l’avis d’experts tels que le “Guide pratique” détaillé de l’EHRA [10]. Pour une étude plus approfondie, nous vous renvoyons à cette littérature et à d’autres plus détaillées [6, 7, 10].
PD Dr. med. Jan Steffel
Conflict of interest statements : PD Dr. med. Jan Steffel a reçu des honoraires de conseil et/ou de présentation d’AstraZeneca, Bayer HealthCare, Boehringer Ingelheim, Bristol-Myers Squibb, Daiichi Sankyo, Pfizer et Roche.
Littérature :
- Connolly SJ, et al : Dabigatran versus warfarine chez les patients atteints de fibrillation auriculaire. N Engl J Med 2009 ; 361 : 1139-1151.
- Patel MR, et al : Rivaroxaban versus warfarine dans la fibrillation auriculaire non valvulaire. N Engl J Med 2011 ; 365 : 883-891.
- Granger CB, et al : Apixaban versus warfarine chez les patients atteints de fibrillation auriculaire. N Engl J Med 2011 ; 365 : 981-992.
- Giugliano RP, et al : Edoxaban versus warfarin chez les patients atteints de fibrillation auriculaire. N Engl J Med 2013.
- Steffel J, Braunwald E : Novel oral anticoagulants : Focus sur la prévention des accidents vasculaires cérébraux et le traitement de la thrombo-embolie veineuse. Eur Heart J 2011 ; 32 : 1968-1976.
- Steffel J, Brunckhorst C : Prophylaxie des accidents vasculaires cérébraux en cas de fibrillation auriculaire. Bremen : UniMed ; 2012.
- Steffel J, et al : Stroke prevention in atrial fibrillation. Bremen : UniMed ; 2014 (sous presse).
- Steffel J : Nouveaux anticoagulants : prévention et traitement des événements thromboemboliques. Leading Opinions Cardiologie + Médecine vasculaire 2011 ; 2 : 14-19.
- Steffel J : Les nouveaux anticoagulants – aspects pratiques de l’utilisation. Leading Opinions Cardiologie + Médecine vasculaire 2012 ; 2 : 10-14.
- Heidbuchel H, et al : European heart rhythm association practical guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation. Europace 2013 ; 15 : 625-651.
- Steffel J, Hindricks G : Apixaban in renal insufficiency : Successful navigation between the scylla and charybdis. Eur Heart J 2012 ; 33 : 2766-2768.
- Steffel J : Nouveaux anticoagulants oraux en cas de fonction rénale réduite et de dialyse. Leading Opinions Nephrologie 2013 ; 2 : 73-75.
- Camm AJ, et al. : 2012 focused update of the esc guidelines for the management of atrial fibrillation : An update of the 2010 esc guidelines for the management of atrial fibrillation. Développé avec la contribution spéciale de l’association européenne du rythme cardiaque. Europace 2012.
- Marinigh R, Lane DA, Lip GY : Impact de l’insuffisance rénale sévère et de la prévention des accidents vasculaires cérébraux dans la fibrillation auriculaire : implications pour la thromboprophylaxie et le risque hémorragique. J Am Coll Cardiol 2011 ; 57 : 1339-1348.
- Hohnloser SH, et al : Efficacité de l’apixaban comparé à la warfarine en relation avec la fonction rénale chez les patients atteints de fibrillation auriculaire : Insights from the aristotle trial. Eur Heart J 2012.
- Dowlatshahi D, et al : Poor prognosis in warfarin-associated intracranial hemorrhage despite anticoagulation reversal. Accident vasculaire cérébral 2012 ; 43 : 1812-1817.
- Lee SB, et al : Progression de l’hémorragie intracérébrale associée à la warfarine après normalisation de l’inr avec ffp. Neurology 2006 ; 67 : 1272-1274.
- Kuwashiro T, et al : Effet du concentré de complexe prothrombique sur l’élargissement de l’hématome et l’issue clinique chez les patients souffrant d’hémorragies intracérébrales associées à un anticoagulant. Cerebrovasc Dis 2011 ; 31 : 170-176.
- Sourgounis A, et al : Stents coronaires et anticoagulation chronique. Circulation 2009 ; 119 : 1682-1688.
- Camm AJ, et al : Guidelines for the management of atrial fibrillation : The task force for the management of atrial fibrillation of the european society of cardiology (esc). Europace 2010 ; 12 : 1360-1420.
- Dewilde WJ, et al : Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and subgoing percutaneous coronary intervention : An open-label, randomised, controlled trial. Lancet 2013 ; 381 : 1107-1115.
- Nagarakanti R, et al : Dabigatran versus warfarine chez les patients atteints de fibrillation auriculaire : une analyse des patients subissant une cardioversion. Circulation 2011 ; 123 : 131-136.
CARDIOVASC 2014 ; 13(2) : 12-16
PRATIQUE DU MÉDECIN DE FAMILLE 2014 ; 9(6) : 32-37