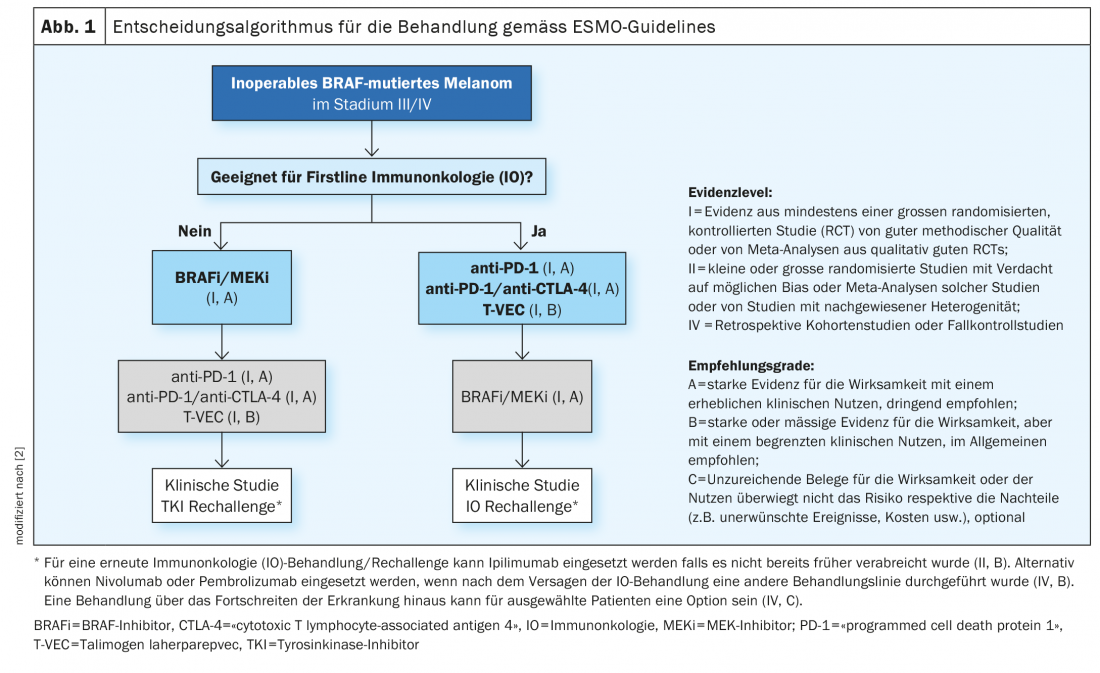
Chez les patients atteints de mélanome métastatique non résécable avec mutation BRAFV600, l’éligibilité à l’immunothérapie doit d’abord être évaluée. Outre l’inhibition des points de contrôle, la thérapie ciblée avec des inhibiteurs de BRAF-MEK est aujourd’hui une option de traitement établie. Trois combinaisons d’inhibiteurs de BRAF et de MEK sont actuellement disponibles en Suisse. L’utilisation combinée s’est avérée supérieure à la monothérapie, tant en termes d’efficacité que de tolérance.
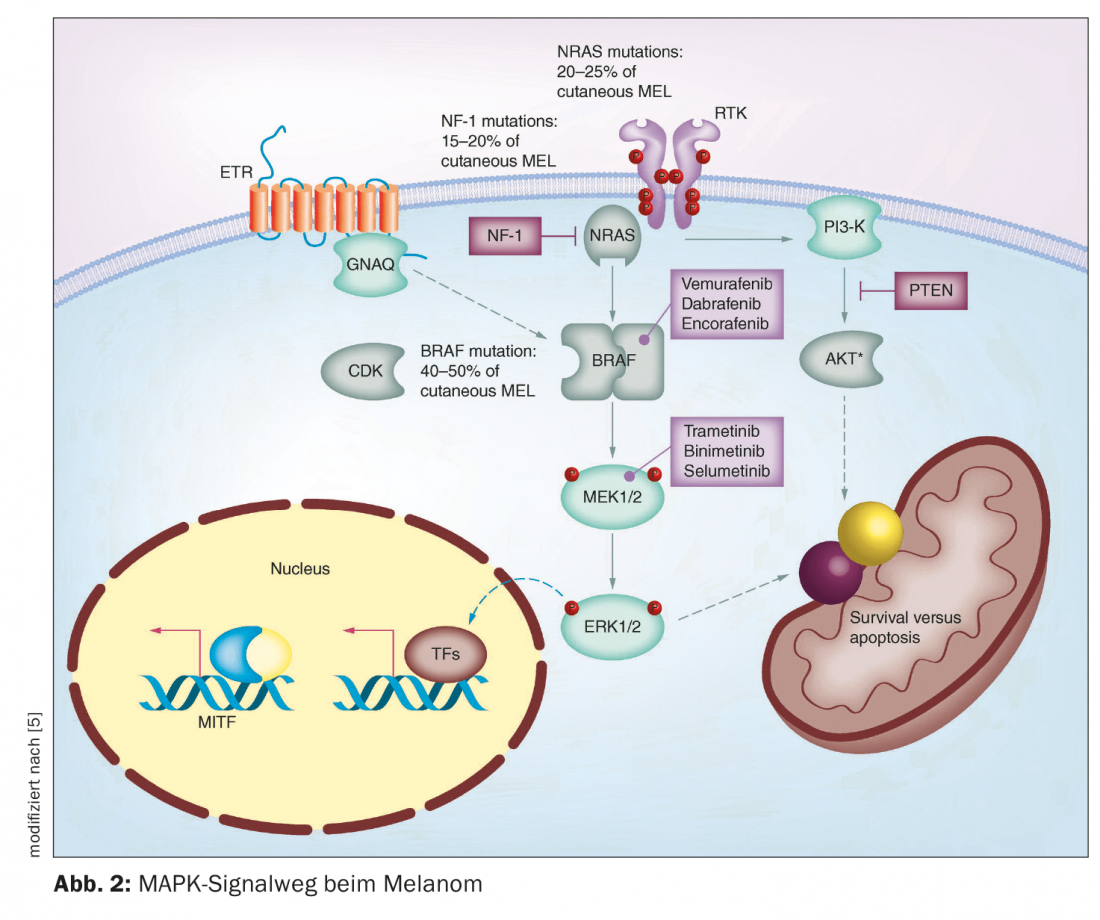
Ces dernières années, plusieurs percées ont été réalisées dans le domaine du traitement du mélanome malin. Jusqu’au milieu des années 1990 environ, seules des chimiothérapies étaient disponibles. Ils empêchent la croissance ou la division cellulaire de manière relativement peu spécifique, ce qui entraîne parfois des effets secondaires importants [1]. L’autorisation de mise sur le marché des thérapies immuno-oncologiques et ciblées a considérablement modifié les options de traitement du mélanome métastatique inopérable. Chez les patients atteints de mélanome avec des métastases non résécables, l’option d’une immunothérapie avec des inhibiteurs de points de contrôle doit d’abord être envisagée. Si les patients sont éligibles pour une immunothérapie, les directives actuelles de l’ESMO recommandent une immunothérapie avec des inhibiteurs de points de contrôle comme traitement de première ligne (figure 1) [2]. Cependant, dans le cas du mélanome métastatique non résécable muté par BRAF, l’utilisation de la thérapie ciblée avec inhibition de BRAF/MEK est également possible. L’inhibition des points de contrôle et la thérapie ciblée présentent toutes deux des avantages et des inconvénients [3]. Prof. Dr. med. Reinhard Dummer, Vice-président de la Commission européenne directeur de la clinique dermatologique et directeur du centre des tumeurs cutanées de l’hôpital universitaire de Zurich, a résumé les faits importants concernant l’inhibition de BRAF/MEK à l’occasion des journées de formation dermatologique de Zurich de cette année [4]. Cette thérapie combinée ciblée inhibe la voie de signalisation “mitogen-activated protein kinase” (MAPK) activée en continu en cas de mutation de BRAFV600 (figure 2) [5].
Analyse de mutation pour détecter un statut de mutation BRAFV600E/K
L’utilisation d’inhibiteurs de BRAF/MEK nécessite un statut de mutation BRAFV600E/K. BRAF est la mutation la plus fréquente dans le mélanome, qui apparaît typiquement chez les jeunes patients atteints de mélanome. Il s’agit souvent de patients qui ont de nombreux nevi. En particulier, les petits nevus mélanocytaires et les nevus acquis ont une fréquence très élevée de mutations BRAF, selon le professeur Dummer. En cas de mélanome localement avancé ou métastasé de stade III ou IV, un diagnostic de pathologie moléculaire doit être effectué pour déterminer le statut BRAF. [6]. L’analyse de la mutation de BRAF peut être effectuée sur des biopsies ou des poinçonnages des zones cutanées concernées, ainsi que sur du matériel tumoral fixé et inclus en paraffine [7]. La technique de PCR permet d’amplifier les zones pertinentes du gène BRAF à partir de l’ADN génomique et de les analyser par séquençage de l’ADN [8]. Selon la Genomic Classification of Cutaneous Melanoma, on peut distinguer quatre sous-types qui ont des prévalences différentes : Mélanomes avec mutation BRAF (50%), mutation N-Ras, K-Ras ou H-Ras (25%), mutation NF1 (15%) et mélanomes triples de type sauvage (10%) [9]. Le gène BRAF code pour la sérine-thréonine protéine kinase BRAF. Celle-ci joue un rôle dans la régulation de la croissance cellulaire via la voie de signalisation MAP kinase et Ras-Raf. Une mutation avec remplacement de l’acide aminé valine en position V600 par la glutamine (V600E) ou par la lysine (V600K) dans la protéine BRAF entraîne une régulation constitutive élevée de l’activité kinase de BRAF [7]. En conséquence, une cascade de signaux est activée en permanence, ce qui entraîne une croissance cellulaire incontrôlée.
Quels sont les traitements par inhibiteurs de BRAF/MEK disponibles en Suisse ?
Avant que les combinaisons d’inhibiteurs de BRAF et de MEK ne soient mises sur le marché, les essais cliniques ont d’abord testé les inhibiteurs de BRAF en monothérapie par rapport à la chimiothérapie. Les inhibiteurs de kinase ont obtenu des résultats bien supérieurs, avec un hazard ratio (HR) de 0,37 en faveur du dabrafenib et de 0,38 en faveur du vemurafenib. “Cela signifie une amélioration de plus de 60% de l’intervalle sans progression grâce à ces inhibiteurs. C’est une différence énorme”, a expliqué le professeur Dummer. L’étape suivante a consisté à combiner les inhibiteurs de BRAF et de MEK dans des essais cliniques. L’ajout d’un inhibiteur de MEK à un inhibiteur de BRAF devrait permettre d’éviter le développement précoce d’une résistance par la réactivation de la cascade MAPK et l’activation paradoxale de ces voies de signalisation dans des cellules saines sans mutation du gène BRAF [10].
Des études cliniques ont été menées sur le principe de la monothérapie et de l’association thérapeutique, qui ont toujours montré un net avantage pour l’utilisation combinée. Les thérapies combinées BRAF-i/MEK-i ont une tolérance similaire ou meilleure que la monothérapie avec BRAF-i, explique le conférencier [4]. Actuellement, trois combinaisons BRAF-i/MEK-i sont disponibles en Suisse : Dabrafenib/Trametinib, Vemurafenib/Cobimetinib, Encorafenib/Binimetinib. “Pour le triple traitement, nous utilisons en premier lieu le vémurafénib/cobimétinib. Pour les patients qui progressent directement après l’immunothérapie, Encorafenib/Binimetinib et dans le setting adjuvant, nous avons de très bonnes données pour Dabrafenib/Trametinib”, explique le professeur Dummer et ajoute : “Pour les métastases cérébrales, nous avons également de très bons résultats pour l’association Dabrafenib/Trametinib” [4].
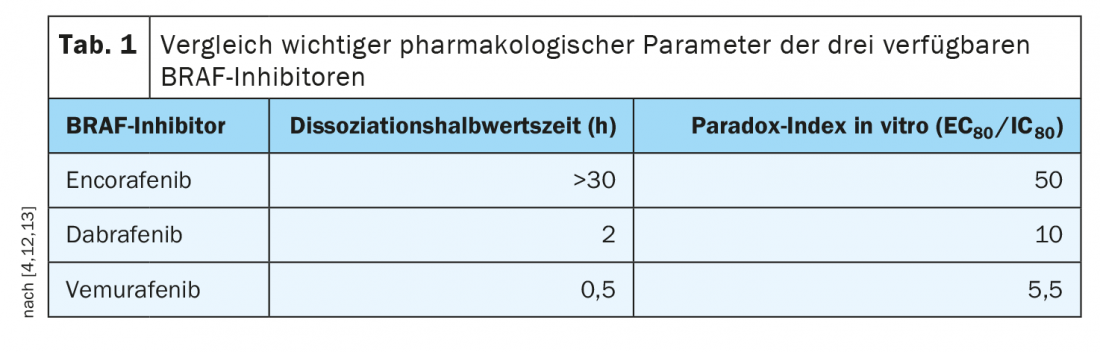

L’encorafénib présente des propriétés pharmacologiques avantageuses
Les profils de tolérance des différentes thérapies combinées diffèrent quelque peu, ce qui doit être discuté avec les patients. Par exemple, il est prouvé que l’encorafénib/binimétinib réduit le risque de pyrexie (fièvre) et de photosensibilité, et l’on dispose d’une bonne expérience en matière de traitement prolongé. Alors qu’avec le vémurafénib, l’inhibition de la voie est très étroitement corrélée au taux sérique, avec l’encorafénib, le taux sérique peut diminuer, mais l’inhibition persiste. Cela s’étend sur plus de 30 heures. Cette demi-vie de dissociation particulièrement longue de l’encorafénib (tableau 1), signifie un blocage stable de la voie de signalisation, ce qui est cliniquement pertinent, souligne le professeur Dummer [4]. En outre, les valeurs de l’indice de paradoxe, qui est une mesure des effets secondaires sur les cellules saines (c’est-à-dire celles qui ne présentent pas de mutation du gène BRAF), sont favorables à l’encorafénib, a déclaré l’orateur. L’utilisation combinée de l’encorafénib et du binimétinib, un inhibiteur de la MEK, permet d’augmenter la dose d’encorafénib et d’accroître encore son efficacité. “Comme l’inhibiteur de la MEK améliore encore la tolérance, il est possible d’augmenter la dose d’encorafénib en association avec le binimétinib”, précise le professeur Dummer [4]. Cela a été étudié dans l’étude de phase III à trois bras COLUMBUS [11]. Cette étude a comparé l’encorafénib 450 mg (1×/d) plus le binimétinib 45 mg (2×/d) à l’encorafénib 300 mg (1×/d) et au vémurafénib 960 mg (2×/d). Au total, 577 patients atteints d’un mélanome avancé/métastatique nouvellement diagnostiqué avec BRAFV600 muté ou en progression après une immunothérapie de première ligne ont été inclus. La thérapie ciblée associant encorafénib et binimétinib (COMBO450) s’est révélée significativement supérieure à la monothérapie par vémurafénib ou encorafénib, avec une PFS médiane de 14,9 mois. En ce qui concerne les risques d’effets secondaires, on sait désormais que la rétinopathie associée à la MEK-i est complètement régressive et qu’elle n’entraîne pas de lésions permanentes de la rétine, même en cas d’utilisation prolongée, a déclaré le professeur Dummer. Si les patients souffrent d’effets secondaires, ceux-ci peuvent être traités localement par des anti-inflammatoires et disparaissent généralement en peu de temps.
Congrès : Journées zurichoises de formation continue en dermatologie
Littérature :
- “Oncologie de précision – Développement de la thérapie médicamenteuse du cancer jusqu’à la thérapie personnalisée du cancer”, Dr Thomas Kubin, www.kliniken-suedostbayern.de/files/PDF-Dokumente/oz/Newsletter_OnkoKrebszentr_3_2021_web.pdf, (dernière consultation 14.09.2022)
- Michielin O, et al : Cutaneous melanoma : ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-updagger. Ann Oncol 2019 ; 30(12) : 1884-1901.
- Reschke R, et al. : Compréhension du traitement et qualité de vie liée à la santé chez les patients atteints de mélanome de stade III/IV traités avec de nouvelles thérapies adjuvantes. J Dtsch Dermatol Ges 2021 ; 19(2) : 215-222.
- “Que devrait savoir la dermatologue sur les inhibiteurs BRAF et MEK dans le mélanome ?”, Prof. Dr med. Reinhard Dummer, Journées zurichoises de formation continue en dermatologie, 16/17.6.2022.
- Koelblinger P, Dornbierer J, Dummer R : A review of binimetinib for the treatment of mutant cutaneous melanoma. Future Oncol 2017 ; 13(20) : 1755-1766.
- Hoffmann M, Özdemir B : Mélanome malin : traitement adjuvant : état de l’art, DERMATOLOGIE PRAXIS 2022 ; 32(1) : 11-16.
- “Analyse mutationnelle du mélanome malin – la voie vers un traitement personnalisé”, www.wisplinghoff.de/fileadmin/user_upload/Redakteure/Drucksachen/Laborinformationen/LabInfo_Mutationsanalyse_des_malignen_Melanoms_web.pdf, (dernière consultation 14.09.2022)
- “Détermination du statut de la mutation BRAF”, www.ukaachen.de/fileadmin/files/institute/pathologie/Bestimmung_des_BRAF-Mutationsstatus_v2022.pdf, (dernière consultation 14.09.2022)
- Akbani R, et al : Classification génomique du mélanome cutané. Cell 2015 ; 161(7) : 1681-1696.
- Hermann RM, Christiansen H : Mélanomes métastatiques mutés BRAF : premières données sur l’efficacité à long terme des thérapies ciblées. Strahlenther Onkol 2019 ; 195 : 940-942.
- Dummer R, et al : Encorafenib plus binimetinib versus vemurafenib ou encorafenib chez les patients atteints de mélanome BRAF mutant (COLUMBUS) : une étude multicentrique, en ouvert, randomisée de phase 3. Lancet Oncol 2018 ; 19(5) : 603-615.
- Koelblinger P, Thuerigen O, Dummer R : Développement de l’encorafenib pour le mélanome avancé muté BRAF. Curr Opin Oncol. 2018;30(2) : 125-133.
- Adelmann C, et al : Profils comparatifs des inhibiteurs de BRAF : l’indice de paradoxe comme prédicteur de la toxicité clinique. Oncotarget 2016 ; 7 : 30453-30460.
DERMATOLOGIE PRATIQUE 2022 ; 32(5) : 43-45