Les inhibiteurs de la 5α-réductase permettent de réduire le volume de la prostate et les troubles qui y sont associés. Les effets secondaires possibles sont la dysfonction sexuelle et les troubles dépressifs. On pense que les stéroïdes neuroactifs jouent un rôle important dans ce processus, mais les mécanismes exacts ne sont pas encore élucidés. Des études animales ont montré que le traitement par le finastéride entraînait, entre autres, des modifications importantes du système dopaminergique. La dépression, en particulier l’anhédonie, est associée à un dysfonctionnement des processus dopaminergiques.
La prévalence de l’hyperplasie bénigne de la prostate (HBP) chez les hommes âgés de 50 à 70 ans est de 50 à 75%, et d’environ 80% chez les plus de 70 ans [1]. Le traitement dépend des symptômes et du stade de la maladie. Les options de traitement médicamenteux disponibles sont les phytothérapies (par exemple les extraits de palmier nain) ainsi que les α-bloquants sélectifs, les antiandrogènes ou les inhibiteurs de la 5α-réductase (5-ARI). Les effets des 5-ARI (par exemple le finastéride) sont dus à une forte diminution de la concentration de 5α-dihydrotestostérone (DHT) en raison d’un blocage irréversible de la 5α-réductase dans les organes sexuels, le cerveau, la peau ainsi que dans d’autres organes et types de tissus [2]. Cela a pour effet d’empêcher la conversion de la testostérone en dihydrotestostérone, un androgène plus puissant, et de bloquer les stéroïdes dépresseurs neuroactifs (par ex. allopregnanolone, androstérone) [2]. Les 5-ARI doivent être pris pendant au moins 6 à 12 mois. Outre les effets thérapeutiques souhaités, tels que la réduction de la taille de la prostate et l’amélioration des troubles mictionnels, des effets secondaires tels qu’un dysfonctionnement sexuel et des troubles dépressifs peuvent survenir. Dans une analyse secondaire, Saengmearnuparp et al. a examiné l’état actuel des connaissances sur le lien entre 5-ARI et dépression (encadré). Voici un extrait des résultats.

Changements liés à la dose et au temps dans les modèles animaux
Comme le montrent des études expérimentales chez les rongeurs, les changements induits par les 5-ARI incluent des dysfonctionnements du système dopaminergique et des modifications de l’axe hypothalamo-hypophyso-surrénalien [4,5]. Contrairement aux effets aigus, le finastéride a déclenché une modification comportementale dose-dépendante et temps-dépendante chez les rats Wistar mâles adultes lors d’expériences animales avec une durée de traitement de 24 h à 7 jours et un traitement de ≥14 jours [4,5]. Les résultats d’études menées sur des souris C57BL/6N ont montré que la concentration de DHT dans le cerveau était significativement réduite dans un groupe traité au finastéride pendant 24 h à 7 jours, mais que le taux de testostérone dans le cerveau ne changeait pas [6].
Chez les rats Sprague-Dawley mâles, un traitement par finastéride à faible dose pendant ≥14 jours n’a pas eu d’effet significatif sur les concentrations de produits de la 5α-réductase tels que la dihydroprogestérone (DHP), la tétrahydroprogestérone (THP) et la dihydrotestostérone (DHT), ce qui indique des processus compensatoires [7]. En revanche, les taux plasmatiques de DHT dans le groupe traité par finastéride ont été considérablement réduits [7].
Résultats d’études animales sur les processus dopaminergiques
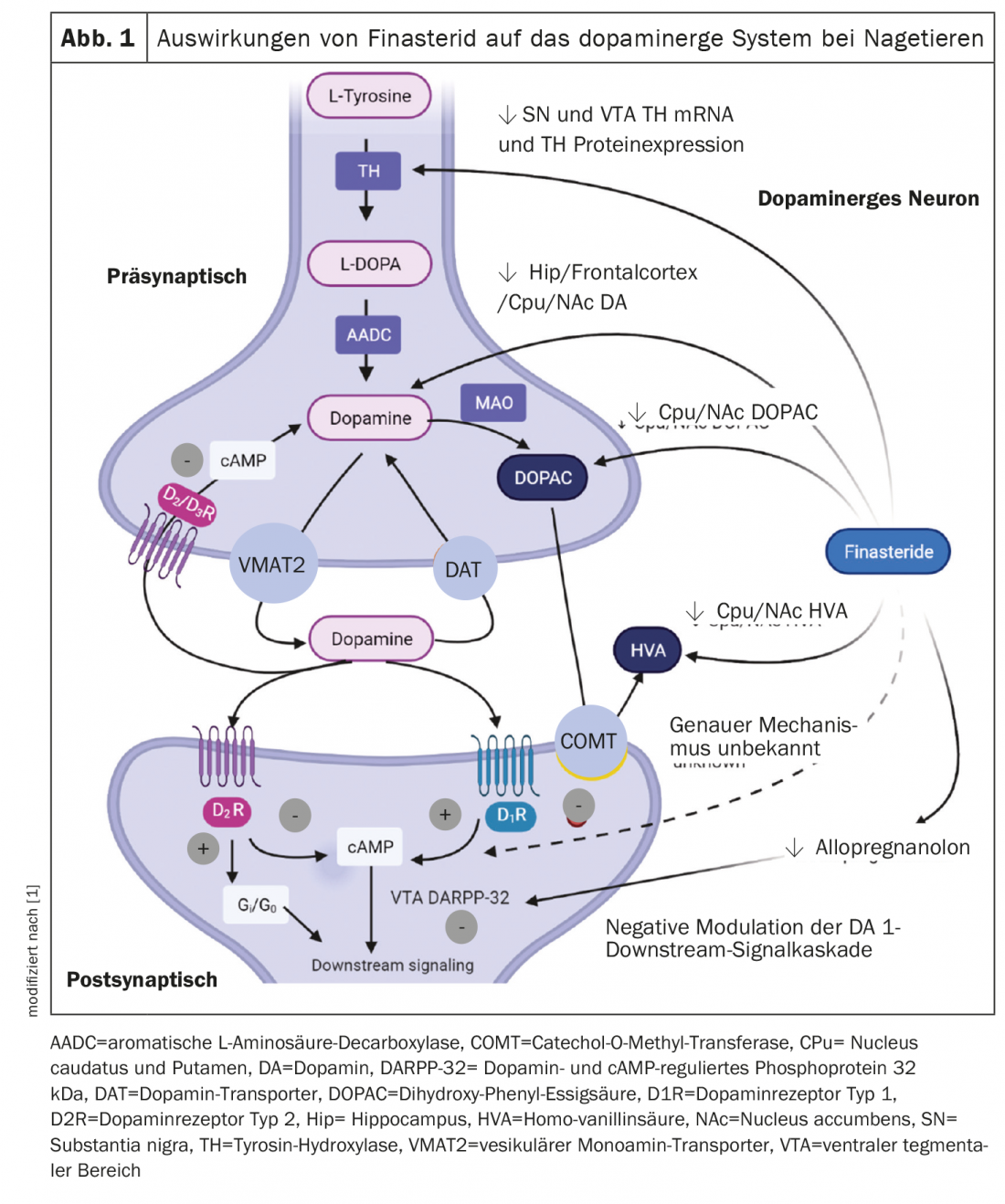
Dans un modèle de rat, l’administration prolongée de finastéride a réduit la concentration de dopamine et de ses métabolites dans différentes régions du cerveau [8]. Ces résultats n’ont été observés que dans le groupe finastéride pendant l’adolescence ou la période de poussée de testostérone. Les niveaux de dopamine, d’acide dihydroxyphénylacétique et d’acide homovanillique dans le noyau caudé, le putamen et le noyau accumbens étaient également significativement réduits. En outre, une réduction de l’expression de l’ARNm et de la protéine tyrosine hydroxylase a été observée dans la substantia nigra et dans les aires tegmentales ventrales de ces rats. Les effets du finastéride sur le système dopaminergique observés chez l’animal sont résumés dans la figure 1 [8]. Dans l’ensemble, les résultats suggèrent qu’une diminution de la DHT, le principal métabolite androgène, pendant une période de pic de testostérone peut être l’une des causes des changements dans le système dopaminergique. Il a également été documenté que les changements dans d’autres stéroïdes neuroactifs tels que la testostérone, les œstrogènes et les glucocorticoïdes, via la modulation de la signalisation dopaminergique chez les rats en croissance, présentent un risque de transduction du signal dopaminergique chez les rats en croissance [9].
Hippocampe : diminution de la neurogenèse et augmentation de la neuroinflammation
Un autre mécanisme expliquant les symptômes dépressifs après un traitement par 5-ARIs est la réduction de la neurogenèse dans l’hippocampe. De plus, le traitement par finastéride a été associé à une augmentation des cytokines pro-inflammatoires dans la région de l’hippocampe [12,13]. Selon les données précliniques et cliniques, il existe un lien entre la neuroinflammation et les tendances comportementales dépressives [10,11].
Sur la base de ces études et d’autres, les auteurs concluent ce qui suit : La neuroinflammation causée par l’administration de finastéride entraîne une réduction de la neurogenèse et, par conséquent, des symptômes dépressifs. La neuroinflammation induite par le finastéride modifie les processus dopaminergiques et la synthèse de la sérotonine, ce qui favorise les comportements dépressifs [14]. En outre, les auteurs mentionnent qu’il existe des preuves que le finastéride favorise la dysbiose intestinale, ce qui affecte l’inflammation systémique. Ainsi, le finastéride a entraîné une augmentation de la souche de Bacteroidetes dans l’intestin pour une durée de traitement de 24 h à 7 jours et un traitement de ≥14 jours. La dysbiose du microbiote intestinal a été associée à des comportements de type dépressif chez le rat [8,14].
Littérature :
- Saengmearnuparp T, et al : The connection of 5-alpha reductase inhibitors to the development of depression. Biomed Pharmacother 2021 ; 143 : 112100. doi : 10.1016/j.biopha.2021.
- “Une pilosité avec des conséquences : Un traitement au finastéride réussi peut entraîner des problèmes permanents”, www.deutsche-apotheker-zeitung.de/daz-az/2018/daz-16-2018/haarwuchs-mit-folgen, (dernière consultation 05.09.2022)
- Traish AM : Syndrome post-finasteride : un défi surmontable pour les cliniciens. Fertil Steril 2020 ; 113 (1) : 21-50.
- Sasibhushana RB, et al : Repeated finasteride administration induces depression-like behavior in adult male rats. Behav Brain Res 2019 ; 365 : 185-189.
- Li L, et al. : Finastéride inhibé le système dopaminergique du cerveau et les comportements à champ ouvert chez les rats adolescents mâles, CNS Neurosci Ther 2018 ; 24 (2) : 115-125.
- Römer B, et al : Finasteride treatment inhibits adult hippocampal neurogenesis in male mice, Pharmacopsychiatry 2010 ; 43 (5) : 174-178.
- Giatti S, et al. : Effets du traitement subchronique au finastéride et du retrait sur les niveaux de stéroïdes neuroactifs et leurs récepteurs dans le cerveau de rat mâle. Neuroendocrinology 2016 ; 103 (6) : 746-757.
- Yu M, et al. : Variations du microbiote intestinal et du phénotype métabolique fécal associées à la dépression par séquençage génétique de l’ARNr 16S et métabolomique basée sur la LC/MS. J Pharm Biomed Anal 2017 ; 138 : 231-239.
- Sinclair D, et al : Impacts du stress et des hormones sexuelles sur la neurotransmission de la dopamine dans le cerveau des adolescents. Psychopharmacologie 2014 ; 231 (8) : 1581-1599.
- Snyder JS, et al : Adult hippocampal neurogenesis buffers stress responses and depressive behaviour, Nature 2011 ; 476 (7361) : 458-461.
- Malberg JE, et al : Chronic antidepressant treatment increases neurogenesis in adult rat hippocampus, J. Neurosci 2000 ; 20 (24) : 9104-9110.
- Diviccaro S, et al : Le traitement des rats mâles par le finastéride, un inhibiteur de l’enzyme 5alpha-réductase, induit des effets à long terme sur le comportement dépressif, la neurogenèse hippocampique, la neuroinflammation et la composition du microbiote intestinal. Psychoneuroendocrinology 2019 ; 99 : 206-215.
- Felger JC, Treadway MT : Effets de l’inflammation sur la motivation et l’activité motrice : le rôle de la dopamine, Neuropsychopharmacology 2017 ; 42 (1) : 216-241.
- Troubat R, et al : Neuroinflammation and depression : a review, Eur J Neurosci 2021 ; 53 (1) : 151-171.
PRATIQUE DU MÉDECIN DE FAMILLE 2022 : 17(9) : 26-27