L’éventail des traitements systémiques de la dermatite atopique est actuellement en pleine évolution. Ces dernières années, il a été démontré que la voie de signalisation de l’interleukine (IL)-13 joue un rôle essentiel dans la pathogenèse de la dermatite atopique. Alors que le médicament biologique dupilumab inhibe la signalisation IL-4/IL-13 et s’est déjà établi dans la pratique, le tralokinumab et le lebrikizumab s’adressent spécifiquement à IL-13. Les données des études menées jusqu’à présent sont très prometteuses.
Sur la base des progrès réalisés dans le décryptage des bases immunopathologiques de la dermatite atopique, des concepts de traitement ciblant les mécanismes immunitaires de type 2 ont été développés [1]. Les thérapies innovantes sous forme d’anticorps monoclonaux spécifiques et de “petites molécules” ont ouvert une nouvelle ère. Les agents anti-inflammatoires et immunomodulateurs correspondants peuvent être utilisés chez les patients atteints de dermatite atopique modérée à sévère et combinent des effets thérapeutiques très efficaces avec un profil de sécurité avantageux, les différentes options thérapeutiques devant être adaptées aux caractéristiques de chaque patient dans l’optique d’une médecine personnalisée. Il s’agit d’une avancée significative dans les possibilités de traitement de cette maladie cutanée invalidante, car les options de traitement systémique conventionnel sont très limitées en termes de durée d’utilisation et de profil bénéfice/risque, et un traitement topique seul n’est généralement pas suffisant.
La voie de signalisation de l’interleukine (IL)-13 comme cible thérapeutique
L’anticorps monoclonal dupilumab – le premier médicament biologique approuvé pour la dermatite atopique – se lie au récepteur de l’IL-4 (IL-4Rα), empêchant ainsi les signaux de l’IL-4 et de l’IL-13 [1]. Des études récentes ont identifié l’IL-13 comme la cytokine de type 2 la plus fréquente dans la peau lésionnelle de la dermatite atopique et ont montré que le niveau d’expression de l’IL-13 était plus élevé que celui de la cytokine de type 2.
IL-13 dans les lésions cutanées est en corrélation avec la gravité de la maladie [2–6]. On pense que la surexpression de l’IL-13 dans la peau de la dermatite atopique contribue au cercle vicieux de l’inflammation, de la perturbation de la barrière cutanée et de la dysbiose du microbiome [2,3]. Le tralokinumab, également un anticorps monoclonal, neutralise spécifiquement l’IL-13 en se liant à cette cytokine et en empêchant ainsi l’interaction avec le récepteur IL-13Rα1 [1]. C’est sur cette base que reposent les propriétés anti-inflammatoires et immunomodulatrices du tralokinumab. Un autre médicament biologique ciblant l’IL-13 est le lébrikizumab. Cet anticorps monoclonal IgG4 se lie à un épitope d’IL-13 qui empêche le complexe IL-13/IL-13Rα1 de former un hétérodimère avec IL-4Rα [2].
Tralokinumab : succès dans une étude de phase III en monothérapie et avec TCS
L’efficacité et la sécurité d’un traitement de 52 semaines par tralokinumab dans la dermatite atopique ont été évaluées dans deux ECR multinationaux de phase III, ECZTRA 1 (n=802) et ECZTRA 2 (n=794) [7]. Dans les deux études, le tralokinumab 300 mg toutes les deux semaines (q2w) était significativement supérieur au placebo en termes d’amélioration des critères d’évaluation primaires IGA 0/1 et EASI-75 à 16 semaines. En outre, le tralokinumab a entraîné une amélioration significative de plusieurs critères secondaires tels que le prurit, le DLQI, le Scoring Atopic Dermatitis (SCORAD) et les troubles du sommeil liés à l’eczéma [7].
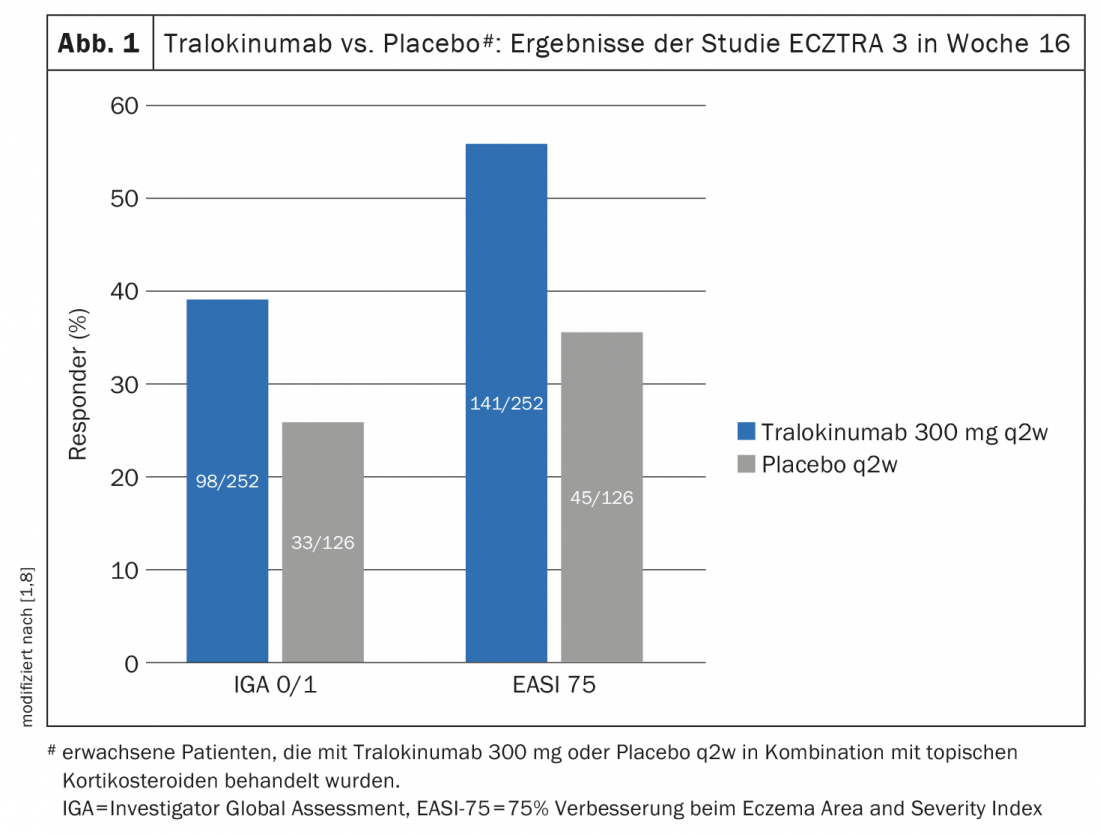
Une autre étude de phase III randomisée et contrôlée – ECZTRA 3 – a évalué l’efficacité et la sécurité du tralokinumab 300 mg q2w en association avec un corticostéroïde topique (TCS) chez 380 patients atteints de dermatite atopique modérée à sévère [8]. Le traitement à la demande par cortisone appliquée localement était le furoate de mométasone 0,1% (stéroïde de classe III), appliqué une fois par jour sur les lésions actives. A la semaine 16 de l’étude ECZTRA 3, les taux d’EASI-75 et d’IGA 0/1 ont été significativement plus élevés dans le bras tralokinumab (respectivement 56,0% et 38,9%) que dans le bras placebo, où les taux étaient respectivement de 35,7% et 26,2% (p<0,001 et p=0,015) (Fig. 1) [8]. Le bras tralokinumab s’est également révélé supérieur en termes d’EASI-90 (32,9 vs. 21,4% ; p=0,022) et d’EASI-50 (79,4 vs. 57,9% ; p<0,001). Les évaluations ont également montré qu’aux semaines 15 à 16, les patients traités par tralokinumab utilisaient environ 50% de stéroïdes topiques en moins que le groupe placebo (p=0,002). Ceux qui ont atteint le critère d’évaluation principal à la semaine 16 ont été à nouveau randomisés 1:1 pour continuer le traitement par tralokinumab q2w ou pour réduire la dose à q4w. Environ 90% des patients ont maintenu leur réponse de la semaine 16 à la semaine 32 avec les deux régimes de dosage [9].
L’étude ECZTRA 3, en particulier, est bien comparable à la pratique quotidienne de la dermatite atopique : si les TCS seuls ne sont pas efficaces, un traitement systémique est mis en place. Pour éviter une récidive, l’idéal est de poursuivre les deux traitements en parallèle [1].
Lebrikizumab : étude de phase II de détermination de la dose terminée
Les études de phase IIb sur le lébrikizumab ont montré une efficacité dose-dépendante chez les adultes sans augmentation significative de l’incidence relative de la conjonctivite [11]. Au total, 280 patients (âge moyen 39,3 ans, 59,3% de femmes) ont été randomisés dans l’un des bras de l’étude : 125 mg toutes les 4 semaines (n=73), 250 mg toutes les 4 semaines (n=80) ou 250 mg toutes les 2 semaines (n=75) ou placebo. À la semaine 16, le traitement par lébrikizumab a entraîné une amélioration statistiquement significative, en fonction de la dose, des pourcentages moyens de variation des moindres carrés EASI par rapport au placebo. Les différences par rapport au placebo se sont manifestées dès la semaine 4 et se sont accentuées jusqu’à la semaine 16. De plus, à la semaine 16, un nombre significativement plus élevé de patients ont obtenu une réponse IGA 0/1 ainsi qu’EASI50, EASI75 et EASI90 par rapport au placebo à la dose de 250 mg de lébrikizumab.

Dans l’ensemble, les résultats des études cliniques menées jusqu’à présent suggèrent que le lébrikizumab est une autre option de traitement efficace et bien tolérée de la dermatite atopique modérée à sévère. L’efficacité et l’innocuité de ce produit biologique en traitement d’entretien ainsi qu’en traitement à long terme sont évaluées depuis 2019 dans des études de phase III [12,13]. L’agence américaine des produits alimentaires et médicamenteux (FDA) a récemment accordé à cet anticorps monoclonal un “fast-track status” [10].
Littérature :
- Wollenberg A, Weidinger S, Worm M, Bieber T : J Dtsch Dermatol Ges 2021 ; 19(10) : 1435-1442.
- Bieber T : Allergy 2019 ; 75 : 54-62.
- Tubau C, Puig L : Expert Rev Clin Immunol 2021 ; 17 : 15-25.
- Tsoi LC, et al : J Invest Dermatol 2019 ; 139 : 1480-1489.
- Szegedi K, et al : J Eur Acad Dermatol Venereol 2015 ; 29 : 2136-2144.
- Marbach-Breitrück E, et al. : Skin Pharmacol Physiol 2019 ; 32 : 192-200.
- Wollenberg A, et al : Br J Dermatol 2021 ; 184 : 437-449.
- Silverberg JI, et al : Br J Dermatol 2021 ; 184 : 450-463.
- Wohlrab J, et al : Hautarzt 2021 ; 72(4) : 321-327.
- Tuttle KL, Forman J, Beck LA : Int J Womens Dermatol 2021 ; 7(5Part A) : 606-614.
- Guttman-Yassky E, et al : JAMA dermatology 2020 ; 156(4) : 411-420.
- ClinicalTrials.gov, https://clinicaltrials.gov/ct2/show/NCT04146363, (dernière consultation 24/01/2022)
- ClinicalTrials.gov, https://clinicaltrials.gov/ct2/show/NCT04178967, (dernière consultation 24/01/2022)
- Wei W, et al : J Dermatol 2018 ; 45 : 150-157.
- Langan SM, Irvine AD, Weidinger S : Lancet 2020 ; 396 : 345-360.
- Wollenberg A, et al : J Eur Acad Derm Venereol 2020 ; 34 : 2717-2744.
- Adtralza®, autorisation de l’EMA en juin 2021, https://ec.europa.eu/health/documents/community-register/html/h1554.htm, (dernière consultation 24.01.2022)
- Cork MJ, Danby SG, Ogg GS : J Dermatolog Treat 2020 ; 31(8) : 801-809, www.researchgate.net/publication/336708334_Atopic_dermatitis_epidemiology_and_unmet_need_in_the_United_Kingdom
DERMATOLOGIE PRATIQUE 2022 ; 32(1) : 26-28