Il existe désormais quatre inhibiteurs JAK autorisés en Europe : le tofacitinib, le baricitinib, l’upadacitinib et le filgotinib. Alors qu’il n’y a pas eu beaucoup de nouvelles concernant les deux premiers au cours des 12 derniers mois, l’upadacitinib a fait l’objet d’un certain nombre d’évolutions, comme le résume la mise à jour 2021 sur les rhumatismes.
Ainsi, la première étude en tête-à-tête (SELECT-CHOICE) chez des patients atteints de bDMARD-IR a été publiée : 612 patients atteints de polyarthrite rhumatoïde active malgré un traitement par csDMARD et un échec thérapeutique à au moins un médicament biologique précoce ont été randomisés en aveugle et contre placebo pour recevoir soit de l’abatacept i.v. (n=309), soit de l’upadacitinib (n=303) [2]. Le critère d’évaluation principal était le DAS28(CRP) de la ligne de base à la semaine 12. L’upadacitinib (UPA) a obtenu de meilleurs résultats que l’abatacept (ABA) pour tous les paramètres étudiés. La proportion de patients présentant une rémission DAS28(CRP) était de près de 30% avec l’UPA contre 13% avec l’ABA. Andrea Rubbert-Roth de la clinique de rhumatologie de l’hôpital cantonal de St-Gall, qui est également l’auteur principal de l’étude, a conclu que le traitement par UPA est supérieur à l’abatacept en termes d’efficacité chez les patients atteints de PR qui ne répondent pas suffisamment aux bDMARD, avec une fréquence légèrement plus élevée d’événements indésirables graves (3,3% vs. 1,6% ; 2 TEV et 1 MACE* ont été observés sous UPA ; il est intéressant de noter que l’herpès zoster est apparu à une fréquence égale dans les deux groupes (4 patients chacun).
Dans une autre étude (SELECT-COMPARE), les patients dont la PR est active malgré le méthotrexate ont été randomisés pour recevoir UPA 15 mg/jour (n=651) vs. adalimumab (ADA, n=327) vs. placebo (n=651). En cas de réponse insuffisante (définie par l’absence d’ACR20 après 14 semaines = non-répondeur ou CDAI >10 = réponse partielle), ils pouvaient passer à l’autre principe actif sans interruption à partir de la semaine 14.
* Major adverse cardiovascular events (= décès d’origine cardiovasculaire, infarctus du myocarde non fatal, maladie coronarienne, événements cérébrovasculaires).
Le filgotinib “très puissant“ pour le traitement de la PR
Résultat du switch : les patients qui sont passés de l’ADA à l’UPA ont mieux marché que ceux qui étaient passés de l’UPA à l’ADA. Lors du passage de l’adalimumab à l’upadacitinib, 47% des non-répondeurs et 58% des répondeurs incomplets ont obtenu un CDAI-LDA, et inversement, ces chiffres étaient respectivement de 36% et 45%. Il s’agit des premières données montrant ce qu’il est possible de faire lorsque la réponse à un inhibiteur JAK n’est pas suffisante, a déclaré le professeur Rubbert-Roth.
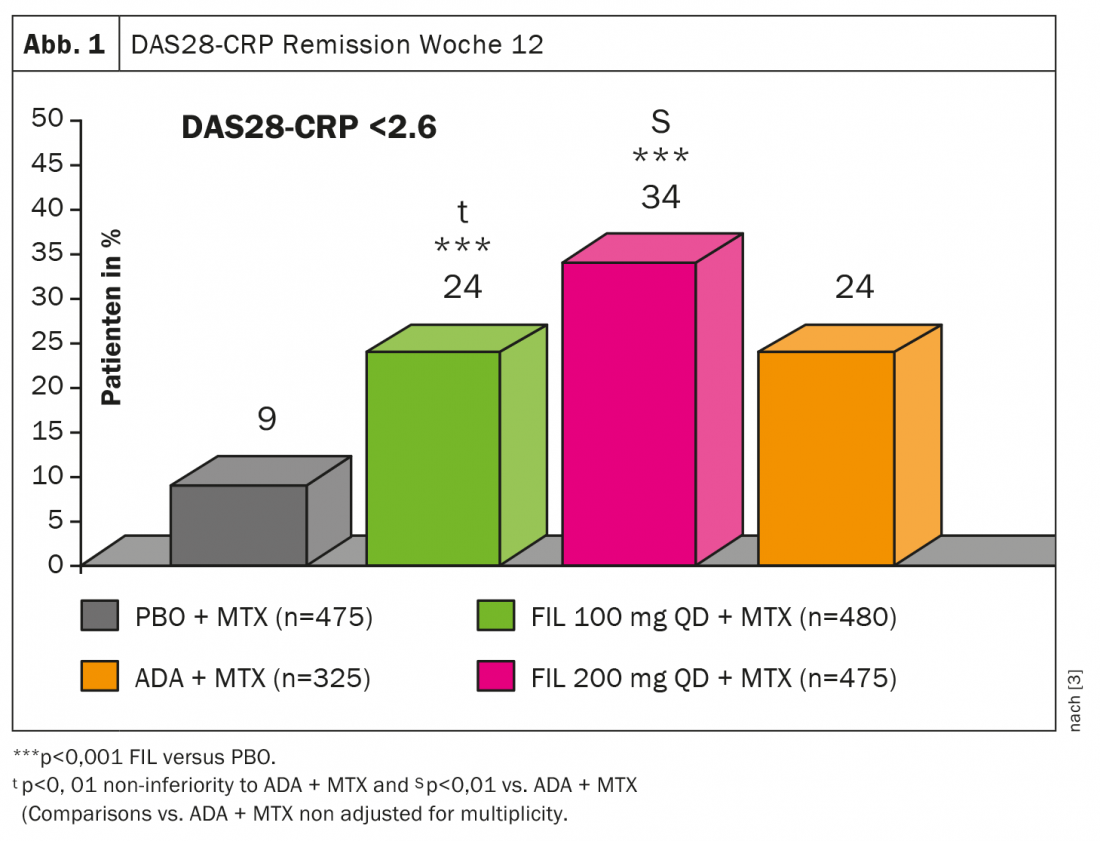
En ce qui concerne le filgotinib (FIL), les données de l’étude FINCH1 ont été récemment publiées. Il s’agit d’une étude de phase 3 en double aveugle et contrôlée par placebo portant sur 1755 patients atteints de PR active malgré le méthotrexate (MTX) [3]. Il a été mis à jour à FIL 100 mg (n=480), FIL 200 mg (n=475), ADA (n=325) ou placebo (n=475), le critère d’évaluation principal étant l’ACR20 à la semaine 12. la rémission DAS28(CRP) en semaine 12 était sous la combinaison FIL 200 mg plus MTX meilleur que ADA + MTX ou FIL 100 mg + MTX (Fig.1). Même si la supériorité n’était visible qu’à la dose la plus élevée, “le filgotinib est également un inhibiteur JAK très puissant pour le traitement de la PR”, conclut-elle.
Résultats d’études sur les produits biologiques
La recherche sur les produits biologiques a également permis de faire plusieurs découvertes. Une étude s’est penchée sur la question de savoir s’il y avait un avantage à commencer tôt avec des médicaments biologiques. L’étude NORD-STAR publiée l’année dernière, une étude multicentrique randomisée portant sur 812 patients atteints de PR précoce, a comparé quatre bras thérapeutiques différents [4] :
- MTX + prednisone (tapering jusqu’à 5 mg /d) ou MTX + SSA + HCQ + stéroïdes intra-articulaires
- MTX + certolizumab pegol
- MTX + abatacept
- MTX + tocilizumab
Au final, il n’y a pas eu de bénéfice significatif. Le taux de rémission CDAI le plus élevé a été obtenu par MTX + abatacept, le traitement combiné conventionnel n’étant pas inférieur au certolizumab + MTX ou au tocilizumab + MTX. Cependant, l’étude n’était pas suffisamment puissante pour comparer les trois bras de bDMARD. Si on le faisait, on aurait le sentiment, au moins numériquement, que le taux de rémission du CDAI sous MTX + abatacept (56,3%) est tout de même supérieur à ce que l’on voit sous certolizumab (52,6%) ou tocilizumab (48,7%), selon le professeur Rubbert-Roth. L’étude se poursuit cependant, avec une deuxième partie qui examine et compare 2 stratégies de désescalade.
Risque de lymphome non augmenté
Pendant des années, les lymphomes ont fait l’objet d’un débat important dans le cadre du traitement par bloqueur du TNF : d’un côté, il a été démontré qu’il y avait plus de lymphomes lorsque l’activité de la maladie était élevée. D’autre part, on a également constaté initialement des taux de lymphomes plus élevés chez les patients atteints de PR sous traitement par inhibiteur du TNF, “et j’avoue que je n’ai jamais compris cela, car les patients subissent une réduction de l’activité de la maladie sous blocage du TNF”, a déclaré le professeur Rubbert-Roth. Elle a estimé que c’était peut-être parce qu’il s’agissait de patients souffrant d’une PR de très longue durée. Une étude réalisée en 2020 s’est penchée une nouvelle fois sur ce phénomène en analysant les données du registre suédois de la PR.
Chez les patients traités par bDMARDs (n=16 392) et ceux sans traitement biologique (n=55 253), tous les nouveaux lymphomes survenus entre 2001 et 2016 ont été enregistrés. L’analyse des patients traités par un médicament biologique après 2006 a montré que les premiers avaient même un risque réduit de lymphome (HR ajusté 0,69 ; IC à 95% 0,28-0,73) par rapport aux patients n’ayant jamais reçu de médicament biologique. “Ce sont des données très positives qui contribuent certainement à soutenir les médicaments biologiques dans le bénéfice”, a expliqué la rhumatologue.
Le professeur Rubbert-Roth a également pu annoncer des résultats positifs concernant l’utilisation et la sécurité des médicaments biologiques chez les patients atteints de PR et ayant des antécédents de tumeurs malignes. Une méta-analyse basée sur 12 études portant sur 13 598 patients atteints de PR, 10 études sur les bloqueurs du TNF et 3 études sur le rituximab a examiné le risque relatif de récidive ou de second cancer [5]. Dans ce cas, les résultats ont montré que le risque était comparable sous bloqueur du TNF, rituximab et csDMARD et qu’il était indépendant de la durée et de l’espacement du traitement par inhibiteur du TNF.
Messages Take-Home
- Upadacitinib : données de switch intéressantes de l’étude SELECT-COMPARE, première étude tête-à-tête chez des patients bDMARD-IR contre abatacept
- Filgotinib : supériorité par rapport à ADA uniquement à la dose la plus élevée
- Les thérapies combinées contenant des bDMARD pour le traitement de la PR précoce n’ont pas montré de supériorité par rapport à la stratégie csDMARD.
- Le risque de lymphome chez les patients atteints de PR reste élevé par rapport à la population normale, mais ni les inhibiteurs du TNF ni les produits biologiques non-TNF n’augmentent le risque. La tendance montre même une réduction du risque de lymphome sous traitement biologique.
- En cas d’antécédents de tumeurs malignes, les bloqueurs du TNF, le rituximab et les csDMARD sont comparables en termes de risques de récidive ou de seconde tumeur.
Littérature :
- RA : thérapie, Rheuma-Update 2021 (en ligne), 12.03.2021.
- Rubbert-Roth A, et al : Essai d’upadacitinib ou d’abatacept dans la polyarthrite rhumatoïde. N Engl J Med 2020 ; 383 : 1511-1521 ; doi : 10.1056/NEJMoa2008250.
- Combe B et al. Filgotinib versus placebo ou adalimumab chez les patients atteints d’arthrite rhumatoïde et ne répondant pas suffisamment au méthotrexate : essai clinique randomisé de phase III. Ann Rheum Dis 2021 ; doi : 10.1136/annrheumdis-2020-219214.
- Hetland ML, et al : Active conventional treatment and three different biological treatments in early rheumatoid arthritis : phase IV investigator initiated, randomised, observer blind clinical trial. BMJ 2020 ; 371 : m4328 ; doi : 10.1136/bmj.m4328.
- Xie W, et al : A meta-analysis of biologic therapies on risk of new or recurrent cancer in patients with rheumatoid arthritis and a prior malignancy. Rheumatology 2020 ; 59 : 930-939 ; doi : 10.1093/rheumatology/kez475.
InFo DOULEUR & GERIATRIE 2021 ; 3(1) : 34-36 (publié le 3.7.21, ahead of print)