Le traitement de choix du sarcome d’Ewing comprend une chimiothérapie néoadjuvante, une résection de la tumeur et une chimiothérapie postopératoire avec/sans radiothérapie. Dans ce contexte, la gestion interdisciplinaire dans un centre approprié est d’une importance capitale.
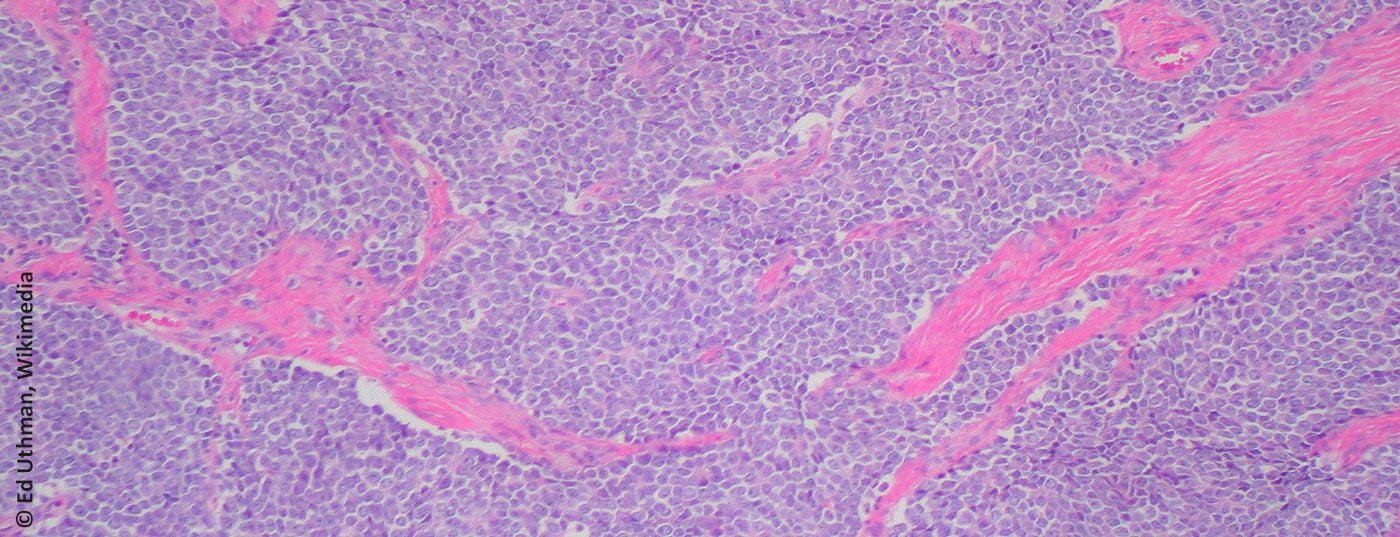
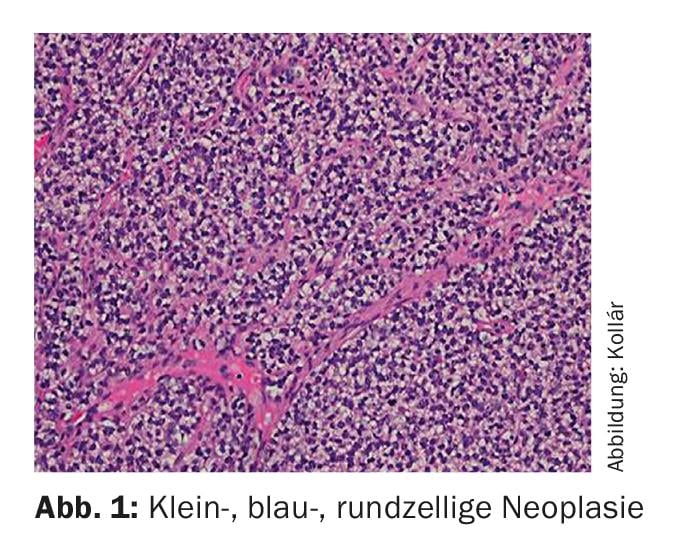
Le sarcome d’Ewing a été nommé en l’honneur de James Ewing (pathologiste américain, 1866-1943). Microscopiquement, il appartient au groupe des tumeurs à petites cellules bleues et rondes (Fig. 1). La cellule d’origine n’est pas clairement établie, bien que la présence de marqueurs neuronaux suggère un lien avec le neuroectoderme embryonnaire [1]. Le diagnostic est généralement établi par la mise en évidence, par diagnostic moléculaire, de translocations impliquant le gène EWS sur le chromosome 22. La translocation la plus fréquente (85-95%) est la t(11;22)(q24;q12) [2]. Par définition, tous les sarcomes d’Ewing sont classés comme hautement malins (G3) [3].
Épidémiologie
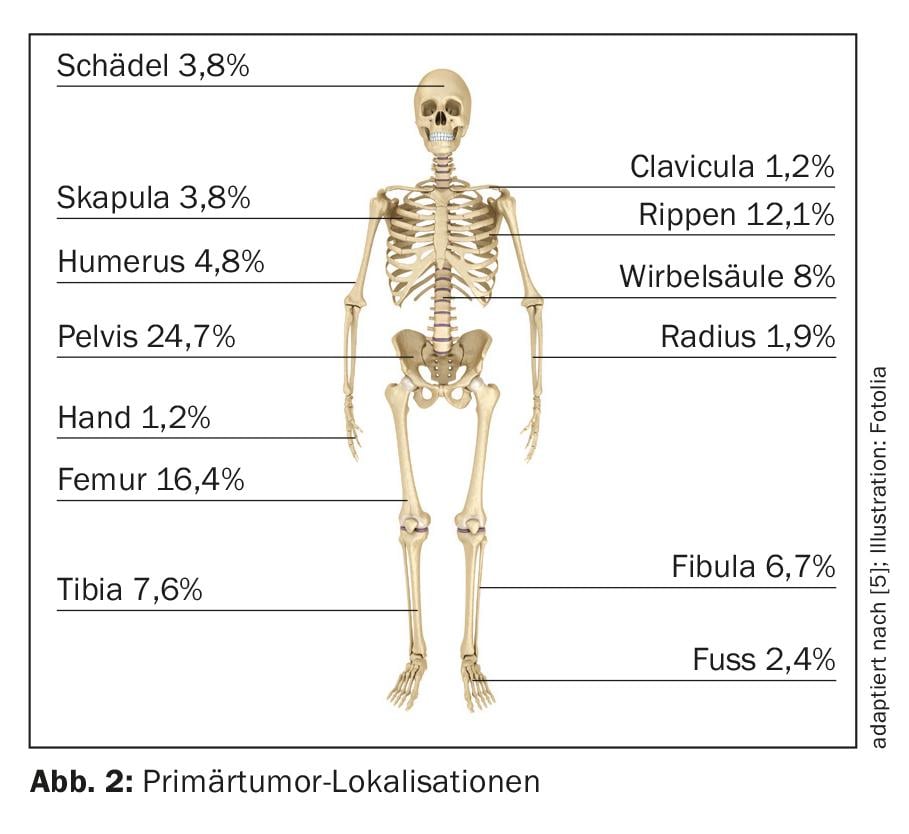
Après l’ostéosarcome, le sarcome d’Ewing représente la deuxième tumeur osseuse maligne primaire la plus fréquente chez l’enfant et l’adolescent. L’âge médian de la maladie est de 10 à 15 ans et le taux d’incidence annuel est d’environ 3/1 000 000 d’habitants [4]. Le sexe masculin est légèrement plus touché (1,5:1). Le bassin (25%) ainsi que les diaphyses des os longs, en particulier dans le fémur (environ 16%) (Fig. 2), font partie des localisations les plus fréquentes des tumeurs primaires [5]. Dans 15% des cas, une localisation extra-osseuse peut être documentée en premier lieu [6].
Clinique
La symptomatologie initiale n’est pas spécifique. Une douleur et/ou un gonflement localisés, éventuellement accompagnés d’une perte de mobilité, sont au premier plan des symptômes. Dans environ 10 à 15% des cas, une fracture pathologique est présente au moment du diagnostic initial [7], et dans 80% des cas, il s’agit d’un stade tumoral formellement localisé. En raison d’un taux de métastases très élevé (>80%) après un traitement exclusivement local de la tumeur primaire, on peut supposer que des métastases infracliniques sont déjà présentes dans presque tous les cas [8]. Les métastases se produisent le plus souvent au niveau pulmonaire, osseux et de la moelle osseuse [9].
Diagnostic
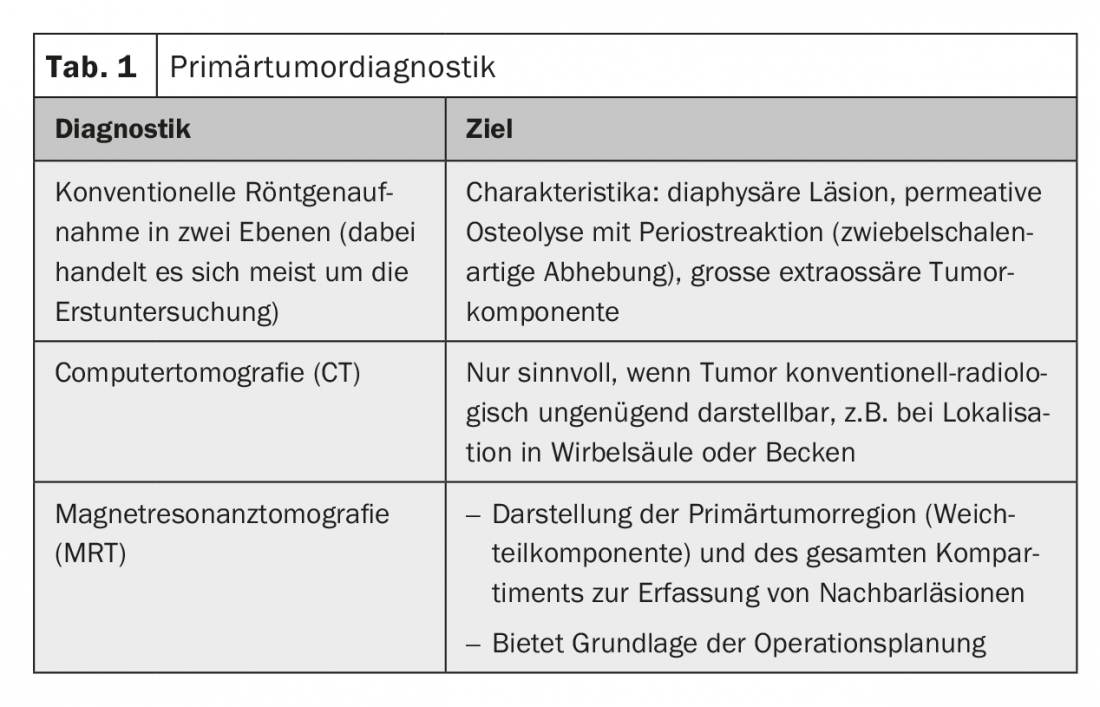
Diagnostic radiologique de la tumeur primaire : le diagnostic radiologique de la tumeur primaire doit impérativement être effectué de manière prébiopsique. Elle sert de base à l’évaluation de laignité et de la résécabilité de la tumeur ainsi qu’à la planification de la biopsie (tableau 1).
Biopsie : si l’on soupçonne une tumeur maligne des tissus mous ou de l’os, il est impératif de confirmer le diagnostic par biopsie. La biopsie doit être réalisée avec la participation d’un chirurgien expérimenté dans le traitement des sarcomes, idéalement le futur chirurgien. La voie d’accès opérationnelle doit être prise en compte à cet égard. L’étalon-or est la biopsie à l’emporte-pièce (“core needle biopsy”).
Staging : Après confirmation du diagnostic par biopsie, les examens de staging suivants doivent être réalisés :
- TDM thoracique (exclusion des métastases pulmonaires)
- Scintigraphie du squelette (exclusion des métastases osseuses)
- Biopsie et aspiration de la moelle osseuse (en raison d’une faible incidence, indiqué uniquement si le PET/CT n’est pas réalisé)
- Autres techniques d’imagerie en fonction des plaintes cliniques.
Des études cliniques sont en cours pour évaluer l’intérêt de l’examen TEP/TDM dans le cadre du staging initial et de l’imagerie évolutive. La sensibilité de la détection de métastases pulmonaires est inférieure à celle du scanner thoracique, tandis que la sensibilité de la détection de lésions osseuses est supérieure [10,11].
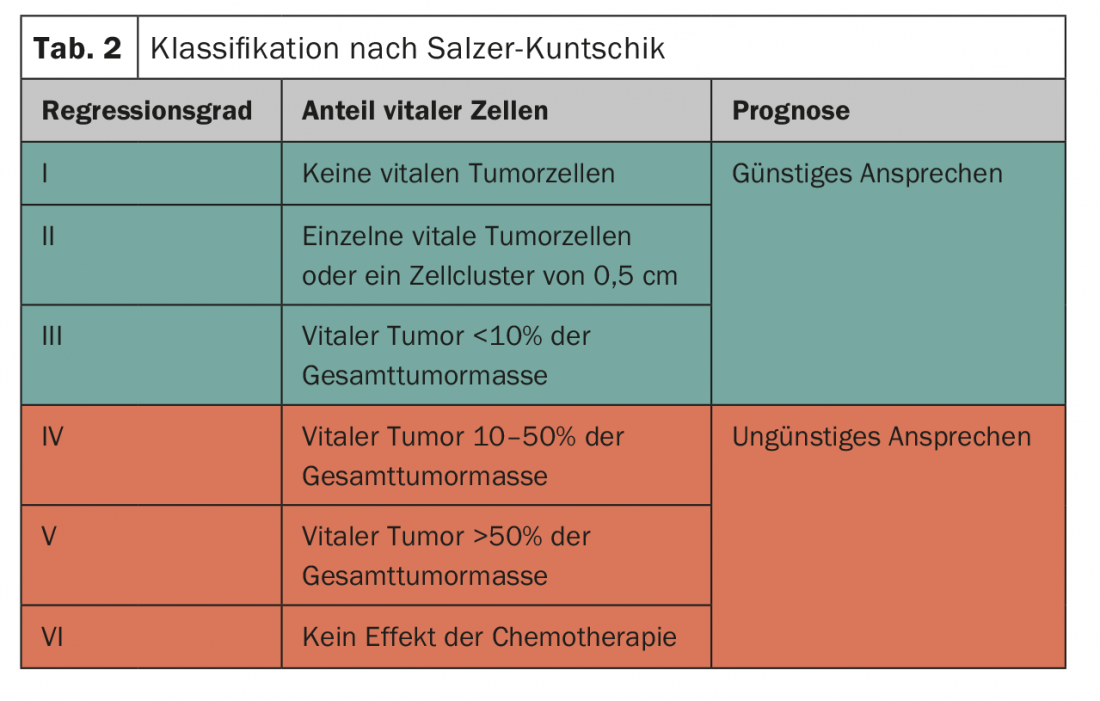
Réponse histologique de la tumeur à la thérapie systémique : pour évaluer la réponse à la chimiothérapie, le pourcentage de cellules malignes vitales est déterminé dans la préparation de résection définitive. Le pathologiste classifie ensuite la réponse dans les pays germanophones sur la base de cette évaluation (tableau 2) [12]. La classification a une signification pronostique, elle est notamment très pertinente dans le cadre des études Euro-Ewing pour déterminer la stratégie thérapeutique postopératoire.
Stade localisé de la maladie
Le traitement du sarcome d’Ewing est multimodal, il doit être discuté de manière interdisciplinaire dans un centre de sarcome. Elle comprend toujours un traitement local (résection et/ou radiothérapie) et une chimiothérapie. Des études prospectives randomisées précoces ont démontré que la chimiothérapie complémentaire améliorait significativement la survie globale (10-20% contre près de 70% pour la survie sans événement à 5 ans) [8,13], raison pour laquelle le standard thérapeutique actuel comprend une chimiothérapie néoadjuvante suivie d’un traitement local de la tumeur primaire et d’une chimiothérapie adjuvante [14]. Les patients doivent, si possible, être traités dans le cadre d’un protocole d’étude.
Chirurgie : la résection de la tumeur primaire est le traitement local de choix. L’objectif est toujours d’obtenir une résection complète de la tumeur. Cependant, en fonction de la localisation anatomique, la résécabilité de la tumeur primaire est parfois inexistante. Il s’agit principalement des sarcomes d’Ewing de la colonne vertébrale et du bassin. Dans ces cas, la modalité thérapeutique doit être individualisée. Dans ce cas, une résection avec radiothérapie postopératoire ou une radiothérapie seule sont envisagées [15,16].
Radiothérapie : en tant que tumeurs radiosensibles, les sarcomes d’Ewing présentent dans certaines études un taux de contrôle local sous radiothérapie comparable à celui des patients traités par chirurgie [17]. La radiothérapie définitive est préférée pour les tumeurs primaires non résécables, conformément à une résection incomplète suivie d’une radiothérapie postopératoire [17]. En cas d’excision marginale/intralésionnelle, il est indiqué de procéder à une radiothérapie postopératoire. La place de la radiothérapie additive en cas de réponse histologique insuffisante à la chimiothérapie (mais de résection complète de la tumeur) n’est pas claire. En principe, la radiothérapie peut également être effectuée en préopératoire [18].
Traitement systémique : la norme internationale est la chimiothérapie combinée. Les agents chimiothérapeutiques les plus efficaces sont les agents alkylants (ifosfamide, cyclophosphamide), les anthracyclines (doxorubicine) ainsi que l’étoposide, la vincristine et l’actinomycine. Le schéma VIDE (vincristine, ifosfamide, doxorubicine, étoposide), par analogie avec le protocole Euro-Ewing 1999 et 2008 en Europe, et le schéma VDC/IE (substances VIDE + cyclophosphamide) en Amérique, servent souvent de modèle pour la chimiothérapie d’induction. L’ajout d’ifosfamide et d’étoposide au VDC a été associé à une augmentation significative de la survie sans événement à 5 ans (69% vs 54%) dans l’étude randomisée IESS-III [19]. La comparaison directe entre les schémas est examinée dans la dernière étude Euro-Ewing 2012.
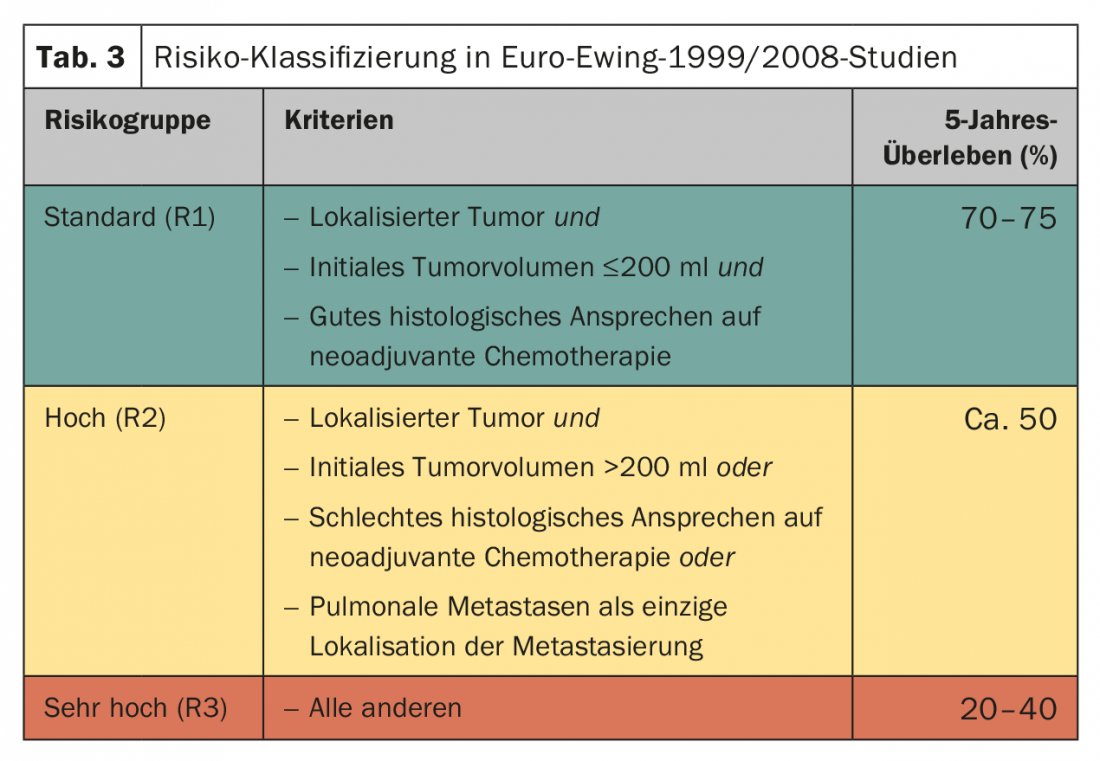
Le traitement local suit généralement six cycles de chimiothérapie néoadjuvante. Le traitement postopératoire est planifié en fonction de la constellation de risques (tableau 3). La norme est de huit cycles de chimiothérapie selon VAI ou VAC. L’étude Euro-Ewing-1999 a comparé de manière randomisée l’efficacité du VAC (cyclophosphamide) et du VAI (ifosfamide) dans le groupe de risque R1. En principe, l’équivalence des schémas a été confirmée, le sexe masculin semblant davantage bénéficier de VAI (HR 1,34 ; IC 95% 0,96-1,86) [20]. La durée totale du traitement est d’environ dix à douze mois. Dans le groupe à risque R2 (stade tumoral localisé, mauvaise réponse histologique de la tumeur, volume tumoral >200 ml), l’intérêt d’un traitement à haute dose contenant du melphalan avec autogreffe de cellules souches a été évalué de manière randomisée. Dans ce cas, une amélioration significative de la survie globale a été obtenue par une chimiothérapie à haute dose de busulfan/ melphalan (77,8 vs 69,9%, HR 0,60 [0,39–0,92], p=0,019) [21].
Stade métastatique de la maladie
Au stade métastatique, le sarcome d’Ewing répond en principe aux mêmes médicaments de chimiothérapie que ceux utilisés au stade localisé. En fonction du nombre et surtout de la localisation, il existe un potentiel curatif malgré la présence de métastases hématogènes. En cas de métastases pulmonaires/pulmonaires isolées, le taux de guérison peut atteindre 40%, en cas de métastases osseuses et médullaires, il est d’environ 20-25% et en cas de combinaison de ces localisations, il est de 15% [22]. De tels résultats sont obtenus notamment grâce à un traitement local systématique de toutes les métastases.
Métastases pulmonaires/pleurales : La résection de métastases pulmonaires persistantes après la chimiothérapie d’induction semble être associée à un meilleur pronostic [23] – d’où la recommandation de procéder à l’ablation chirurgicale des métastases pulmonaires radiologiquement visibles au cours de l’évolution. Comme le nombre de foyers observés en peropératoire est souvent supérieur à celui objectivé par le staging préopératoire, la résection doit être effectuée par chirurgie ouverte [24].
Selon des analyses rétrospectives, l’irradiation parenchymateuse pulmonaire (entre 15 et 20 Gy) est également associée à un pronostic plus favorable en cas de métastases pneumo-pleurales isolées [25,26]. L’indication doit donc être examinée en cas de rémission complète après chimiothérapie ainsi qu’après résection de tous les foyers pulmonaires.
Métastases osseuses et médullaires : En cas de métastases osseuses et/ou médullaires, le pronostic est mauvais malgré l’objectif thérapeutique potentiellement curatif. En cas d’atteinte oligométastatique, il est recommandé d’envisager des options thérapeutiques locales. C’est principalement la radiothérapie qui est utilisée dans ce cas.
Thérapie à haute dose avec transplantation de cellules souches autologues : La place d’une thérapie à haute dose avec support de cellules souches autologues a longtemps été controversée dans la littérature. Une étude prospective non randomisée a montré des résultats extraordinaires avec une survie sans événement à 5 ans allant jusqu’à 52%. D’autres publications n’ont toutefois pas pu étayer ces résultats [27,28]. Ce n’est que récemment que les résultats de la stratification R2 ont été rapportés dans le cadre de l’Euro-Ewing 1999. Chez les patients atteints de métastases pulmonaires, la chimiothérapie à haute dose sans irradiation pulmonaire n’a pas démontré de bénéfice par rapport à une chimiothérapie conventionnelle avec irradiation pulmonaire [29]. Les résultats du groupe de risque R3 sont encore attendus.
Traitement des récidives
Les récidives les plus fréquentes se produisent dans les cinq premières années après le diagnostic initial, mais les récidives tardives ne sont pas rares non plus [30]. Le pronostic des récidives dans les deux premières années est très mauvais, tandis que les récidives ultérieures montrent une survie à long terme dans environ 15-20% [31]. Le traitement de choix dépend du moment de la récidive, de la localisation et du nombre de manifestations tumorales et du traitement antérieur. Les récidives locales et les métastases pulmonaires isolées sont généralement traitées localement, c’est-à-dire par résection et/ou radiothérapie [32]. En cas de foyers de récidive étendus, l’introduction d’un traitement systémique est à nouveau indiquée, mais il n’existe pas de régime standard. En cas de bonne réponse et surtout de réponse prolongée au traitement initial, la répétition de celui-ci peut être évaluée. La dose cumulée de doxorubicine ne doit pas être négligée. En général, la tendance est d’intensifier la chimiothérapie en utilisant des doses élevées, bien que les preuves soient limitées [33]. Les schémas de chimiothérapie utilisés comprennent le topotécan/cyclophosphamide, l’irinotécan/témozolomide, la gemcitabine/docétaxel, l’ifosfamide à haute dose et la chimiothérapie à base de platine avec étoposide [34–36]. Les thérapies moléculaires ciblées (par exemple, les inhibiteurs de l’IGF-1 et du PARP) ainsi que les approches immunothérapeutiques font actuellement l’objet d’études.
Suivi des patients
Le suivi a pour objectif la détection précoce des récidives et la surveillance des toxicités tardives. Actuellement, il n’existe pas de données prospectives montrant un bénéfice en termes de survie des examens de suivi réguliers. On essaie de tenir compte, dans les intervalles de suivi, de la probabilité accrue de récidive au cours des deux ou trois premières années. Les recommandations se trouvent par exemple dans les guidelines du National Comprehensive Cancer Network (NCCN).
Les plus fréquentes sont les néoplasies secondaires (incidence cumulée de 9%), les endocrinopathies, y compris les maladies de la peau. Infertilité, cardio-, néphro- et neurotoxicité, toxicité pulmonaire et altération des fonctions locorégionales dans le cadre du traitement local effectué, en tant que toxicité thérapeutique tardive, sur [37]. Des détails et des recommandations sur le suivi des effets tardifs sont disponibles sur www.survivorshipguidelines.org.
Messages Take-Home
- Le diagnostic et le traitement du sarcome d’Ewing sont effectués de manière interdisciplinaire dans un centre de sarcome. Le diagnostic radiologique de la tumeur primaire doit être effectué de manière prébiopsique. Le traitement de choix est une chimiothérapie néoadjuvante.
- chimiothérapie, une résection de la tumeur et une chimiothérapie postopératoire avec/sans radiothérapie.
- La tumeur doit être réséquée par un chirurgien expérimenté en oncologie des sarcomes.
- Même au stade métastatique de la tumeur, l’objectif thérapeutique est curatif.
Littérature :
- Lipinski M, et al : Neuroectoderm-associated antigens on Ewing’s sarcoma cell lines. Cancer research 1987 ; 47 : 183-187.
- de Alava E, Gerald WL : Biologie moléculaire de la famille des sarcomes d’Ewing/tumeurs neuroectodermiques primitives. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2000 ; 18 : 204-213.
- Fletcher CDM BJ, Hogendoorn P, Mertens F (eds.) : WHO Classification of Tumours of Soft Tissue and Bone (IARC WHO Classification of Tumours). 4e éd. 2013.
- Esiashvili N, Goodman M, Marcus RB Jr : Changes in incidence and survival of Ewing sarcoma patients over the past 3 decades : Surveillance Epidemiology and End Results data. Journal of pediatric hematology/oncology 2008 ; 30 : 425-430.
- Cotterill SJ, et al : Facteurs pronostiques dans la tumeur osseuse d’Ewing : analyse de 975 patients du groupe d’étude européen Intergroup Cooperative Ewing’s Sarcoma. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2000 ; 18 : 3108-3114.
- Applebaum MA, et al : Caractéristiques cliniques et résultats chez les patients atteints de sarcome d’Ewing extrasquelettique. Cancer 2011 ; 117 : 3027-3032.
- Widhe B, Widhe T : Symptômes initiaux et caractéristiques cliniques dans l’ostéosarcome et le sarcome d’Ewing. The Journal of bone and joint surgery American volume 2000 ; 82 : 667-674.
- Nesbit ME Jr, et al : Multimodal therapy for the management of primary, nonmetastatic Ewing’s sarcoma of bone : a long-term follow-up of the First Intergroup study. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 1990 ; 8 : 1664-1674.
- Applebaum MA, et al : Caractéristiques cliniques et résultats chez les patients atteints du sarcome d’Ewing et d’une atteinte des ganglions lymphatiques régionaux. Pediatric blood & cancer 2012 ; 59 : 617-620.
- Franzius C, et al : FDG-PET pour la détection de métastases pulmonaires de tumeurs osseuses primaires malignes : comparaison avec le scanner hélicoïdal. Annals of oncology : official journal of the European Society for Medical Oncology/ESMO 2001 ; 12 : 479-486.
- Franzius C, et al : FDG-PET pour la détection de métastases osseuses de tumeurs osseuses primaires malignes : comparaison avec la scintigraphie osseuse. European journal of nuclear medicine 2000 ; 27 : 1305-1311.
- Salzer-Kuntschik M, et al. : Morphological grades of regression in osteosarcoma after polychemotherapy – study COSS 80. Journal of cancer research and clinical oncology 1983 ; 106 Suppl : 21-24.
- Burgert EO Jr, et al : Multimodal therapy for the management of nonpelvic, localized Ewing’s sarcoma of bone : intergroup study IESS-II. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 1990 ; 8 : 1514-1524.
- Womer RB, et al : Essai contrôlé randomisé de chimiothérapie comprimée par intervalles pour le traitement du sarcome d’Ewing localisé : un rapport du groupe d’oncologie pédiatrique. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2012 ; 30 : 4148-4154.
- Vogin G, et al : Contrôle local et séquelles dans les tumeurs d’Ewing localisées de la colonne vertébrale : une étude rétrospective française. Eur J Cancer 2013 ; 49 : 1314-1323.
- Puri A, et al : Résultats de la résection chirurgicale dans le sarcome d’Ewing pelvien. Journal of surgical oncology 2012 ; 106 : 417-422.
- La TH, et al : Radiothérapie pour le sarcome d’Ewing : résultats du Memorial Sloan-Kettering à l’ère moderne. International journal of radiation oncology, biology, physics 2006 ; 64 : 544-550.
- Krasin MJ, et al : Irradiation définitive dans la gestion multidisciplinaire de la famille des tumeurs localisées du sarcome d’Ewing chez les patients pédiatriques : résultats et facteurs pronostiques. International journal of radiation oncology, biology, physics 2004 ; 60 : 830-838.
- Grier HE, et al : Addition of ifosfamide and etoposide to standard chemotherapy for Ewing’s sarcoma and primitive neuroectodermal tumor of bone. The New England journal of medicine 2003 ; 348 : 694-701.
- Le Deley MC, et al : Cyclophosphamide comparé à l’ifosfamide dans le traitement de consolidation du sarcome d’Ewing à risque standard : résultats de l’essai randomisé non-infériorité Euro-EWING99-R1. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2014 ; 32 : 2440-2448.
- Whelan J, et al : Efficacité de la consolidation par chimiothérapie à haute dose de busulfan-melphalan (BuMel) dans le sarcome d’Ewing localisé à haut risque (ES) : Résultats de l’essai randomisé EURO-EWING 99-R2 (EE99R2Loc). Journal of Clinical Oncology 2016 ; 34(15) Suppl : 11000-11000.
- Paulussen M, et al : Ewing’s tumors with primary lung metastases : survival analysis of 114 (European Intergroup) Cooperative Ewing’s Sarcoma Studies patients. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 1998 ; 16 : 3044-3052.
- Letourneau PA, et al : La résection des métastases pulmonaires chez les patients pédiatriques atteints du sarcome d’Ewing améliore la survie. Journal of pediatric surgery 2011 ; 46 : 332-335.
- Ladenstein R, et al : Sarcome d’Ewing primaire multifocal disséminé : résultats de l’essai Euro-EWING 99. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2010 ; 28 : 3284-3291.
- Dunst J, Paulussen M, Jurgens H : Irradiation pulmonaire pour le sarcome d’Ewing avec métastases pulmonaires au diagnostic : résultats des études CESS. Radiothérapie et oncologie : organe de la société allemande de radiothérapie [et al] 1993 ; 169 : 621-623.
- Paulussen M, et al. : Tumeur d’Ewing primaire métastatique (stade IV) : analyse de la survie de 171 patients issus des études EICESS. Intergroupe européen d’études coopératives sur le sarcome d’Ewing. Annals of oncology : official journal of the European Society for Medical Oncology/ESMO 1998 ; 9 : 275-281.
- Oberlin O, et al. : Impact de busulfan à haute dose plus melphalan comme consolidation dans les tumeurs d’Ewing métastatiques : une étude par la Société Française des Cancers de l’Enfant. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2006 ; 24 : 3997-4002.
- Ladenstein R, et al : Impact de la mégatherapy chez les enfants atteints de tumeurs d’Ewing à haut risque en rémission complète : un rapport de l’EBMT Solid Tumour Registry. Bone marrow transplantation 1995 ; 15 : 697-705.
- Dirksen U, et al : Efficacité de la consolidation par chimiothérapie à haute dose de busulfan-melphalan (BuMel) comparée à la chimiothérapie conventionnelle combinée à l’irradiation pulmonaire dans le sarcome de ewing (ES) avec métastases pulmonaires primaires : Résultats de l’essai randomisé EURO-EWING 99-R2pulm (EE99R2pul). Journal of Clinical Oncology 2016 ; 34(15) Suppl : 11001-11001.
- Weston CL, et al : Établir une survie à long terme et une guérison chez les jeunes patients atteints du sarcome d’Ewing. British journal of cancer 2004 ; 91 : 225-232.
- Stahl M, et al : Risk of recurrence and survival after relapse in patients with Ewing sarcoma. Pediatric blood & cancer 2011 ; 57 : 549-553.
- Bacci G, et al : Résection de métastases pulmonaires métachrones chez des patients atteints du sarcome d’Ewing initialement traités par chimiothérapie adjuvante ou néoadjuvante. Eur J Cancer 1995 ; 31A : 999-1001.
- Rasper M, et al : The value of high-dose chemotherapy in patients with first relapsed Ewing sarcoma. Pediatric blood & cancer 2014 ; 61 : 1382-1386.
- Hunold A, et al : Topotecan et cyclophosphamide chez les patients atteints de tumeurs d’Ewing réfractaires ou en rechute. Pediatric blood & cancer 2006 ; 47 : 795-800.
- van Maldegem AM, et al : Etoposide and carbo-or cisplatin combination therapy in refractory or relapsed Ewing sarcoma : a large retrospective study. Pediatric blood & cancer 2015 ; 62 : 40-44.
- Casey DA, et al : Irinotecan et temozolomide pour le sarcome d’Ewing : l’expérience du Memorial Sloan-Kettering. Pediatric blood & cancer 2009 ; 53 : 1029-1034.
- Ginsberg JP, et al : Survivants à long terme du sarcome d’Ewing de l’enfance : rapport de l’étude sur les survivants du cancer de l’enfance. Journal of the National Cancer Institute 2010 ; 102 : 1272-1283.
InFo ONKOLOGIE & HÉMATOLOGIE 2018 ; 6(5) : 13-16