Par analogie avec la ligne directrice S3 de la DKG 2014, des recommandations peuvent être faites en fonction du stade. Stade I : L’excision totale mésorectale (ETM) seule est la norme dans ce cas. Stades II et III : la radio(chimiothérapie) préopératoire est la norme dans le traitement du cancer du rectum localement avancé. Ce traitement réduit de moitié le taux de récidive locale, quelle que soit la procédure chirurgicale. Si un traitement à long terme est prévu sous forme de radiochimiothérapie, la chimiothérapie doit être à base de 5-FU. La radiochimiothérapie à long terme entraîne un downsizing et un downstaging et permet ainsi une meilleure opérabilité.
Dans le traitement multimodal du cancer du rectum, la radiochimiothérapie/radiothérapie de courte durée fait partie intégrante des stades II et III. Au cours des dernières décennies, on est passé d’une approche adjuvante à une approche néoadjuvante en raison de la minimisation des effets secondaires et du taux de récidive locale.
Classification
La définition internationale est la suivante : Les tumeurs mesurées à l’aide d’un endoscope rigide et situées à 16 cm ou moins de la ligne anocutanée sont considérées comme des cancers du rectum. On distingue le tiers inférieur : 0-6 cm, le tiers moyen : 6-12 cm et le tiers supérieur 12-16 cm.
Facteurs de risque
L’obésité, le manque d’activité physique et le tabagisme sont considérés comme des facteurs de risque pour le développement d’un cancer du rectum. Il est également prouvé que les régimes pauvres en fibres et riches en graisses augmentent l’incidence du cancer du rectum. Aucune mesure diététique spécifique ne peut être recommandée à ce jour [1,2].
Tout adénome histologiquement prouvé augmente le risque de cancer colorectal, en particulier les adénomes multiples (≥3) ou de grande taille (>1 cm).
Les parents au premier degré atteints d’un cancer colorectal constituent également un facteur de risque. Dans ce cas, les proches doivent effectuer un dépistage du cancer colorectal dix ans avant le patient index.
La colite ulcéreuse entraîne une augmentation de la probabilité de développer un cancer colorectal par rapport à la population normale. Les recommandations correspondantes pour le diagnostic et le traitement sont disponibles dans une ligne directrice S3 [3].
Dépistage du cancer colorectal
Le dépistage du cancer colorectal est généralement recommandé à partir de 50 ans. La coloscopie complète possède la meilleure sensibilité et spécificité pour la détection des carcinomes et des adénomes et devrait donc être utilisée comme procédure standard [3]. Il n’y a pas de limite d’âge supérieure claire [4]. Il faut également tenir compte des maladies associées [5].
Diagnostic
L’IRM et l’endosonographie sont considérées comme des techniques d’imagerie de choix pour évaluer le statut ganglionnaire préopératoire et l’extension de la tumeur primaire. Un problème fondamental est le potentiel “overstaging” dans le diagnostic préopératoire, en particulier lors de l’évaluation du statut nodal. Un diagnostic en coupe permet de déterminer la présence éventuelle de métastases. La confirmation histologique se fait par biopsie lors de la rectoscopie.
Concepts thérapeutiques
Le traitement multimodal du cancer du rectum est interdisciplinaire. L’emplacement de la tumeur a une influence. Le traitement du cancer du rectum du tiers inférieur et du tiers moyen est largement standardisé [3], alors que le traitement du cancer du rectum du tiers supérieur est soit identique à celui du cancer du rectum du tiers moyen et du tiers inférieur, soit également analogue à celui du cancer du côlon [3]. Ce dernier point est étayé par les résultats de l’étude TME, qui n’a pas montré de bénéfice significatif de la radiothérapie dans le tiers supérieur (10-15 cm à partir de l’anocutane) par rapport à la chirurgie seule [6]. En revanche, l’étude allemande CAO/ARO/AIO-94 n’a montré aucune différence en termes de taux de récidive locale dans les tiers respectifs, de sorte que, par analogie, le traitement de tous les cancers du rectum serait identique [7].
Radio/radiochimiothérapie néoadjuvante
L’indication de radiothérapie doit être posée à partir du stade préopératoire uT3 ou de tout stade N+ (UICC stades II et III). En principe, dans cette situation, une radiochimiothérapie néoadjuvante , éventuellement une seule irradiation de courte durée, doit être recommandée à chaque patient [3]. Une analyse Cochrane publiée en 2011, incluant 9410 patients et 12 études randomisées, a montré une réduction de 50% du risque relatif de récidive locale par une radiothérapie néoadjuvante à court terme et également par une radiochimiothérapie néoadjuvante par rapport à l’excision totale mésorectale (ETM) seule dans les stades II et III selon UICC.
[8].
Irradiation à court terme vs. à long terme
Le schéma à court terme 5× 5 Gy n’entraîne pas de réduction de la tumeur. La toxicité tardive a tendance à être plus élevée par rapport à une chirurgie seule ou à un traitement à long terme. L’opération a lieu après une radiothérapie de courte durée, une semaine après la fin de la radiothérapie. Cette option de traitement réduit donc l’intervalle de prétraitement. En cas de chimiothérapie intensive planifiée, par exemple en présence de métastases étendues dans les ganglions lymphatiques ou de métastases à distance, ce concept n’entraîne donc aucun retard dans le traitement systémique [3]. La radiothérapie de courte durée est également envisageable lorsqu’aucun downstaging n’est souhaité ou nécessaire, par exemple pour les tumeurs T3 N0 bien opérables [3,9,10].
Une étude polonaise a comparé l’irradiation préopératoire à long terme à l’irradiation à court terme et a montré une amélioration significative de la réponse au traitement à long terme, tant en termes de réduction de l’étendue et de la taille de la tumeur qu’en termes de préservation du sphincter et de résection R0 [11].
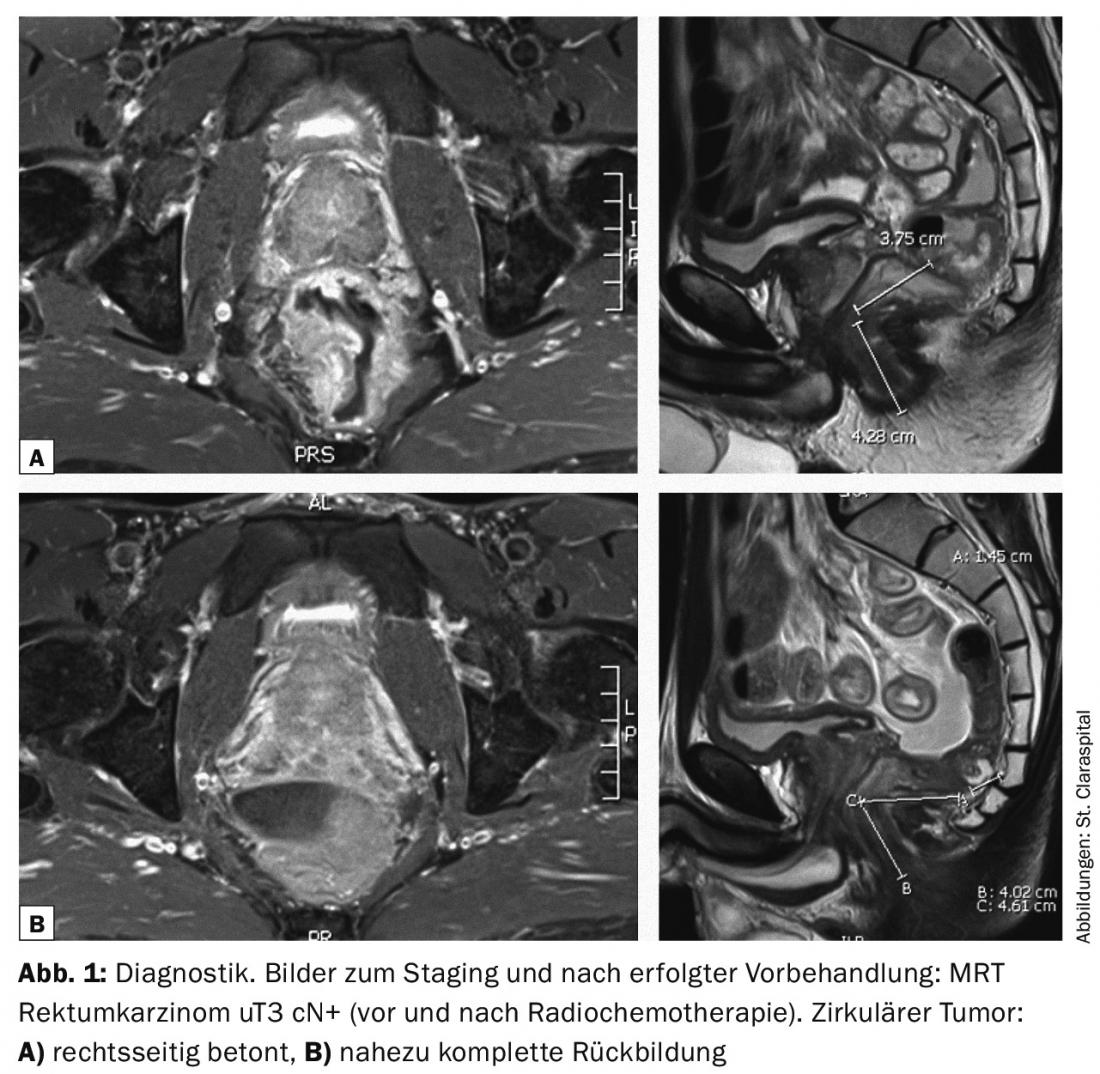
La radiochimiothérapie préopératoire à long terme, d’une durée de cinq semaines à cinq semaines et demie, a donc pour objectif de réduire la tumeur (fig. 1 et 2) et donc d’améliorer l’opérabilité ; dans le cas des tumeurs rectales profondes, elle a également pour objectif de préserver le sphincter [3]. L’opération est alors réalisée à intervalles de six à huit semaines. Des intervalles plus longs après un traitement préopératoire semblent également raisonnables.

La radiochimiothérapie néoadjuvante doit inclure du 5-FU
être basé [3]. Deux grandes études ont examiné les avantages supplémentaires de la chimiothérapie par rapport à la radiothérapie néoadjuvante, toutes deux avec le 5-FU. Des études récentes ont combiné la capécitabine avec l’oxaliplatine et/ou l’irinotécan et n’ont pas démontré de bénéfice supplémentaire en cas de toxicité accrue [12–14].
Radio/radiochimiothérapie adjuvante
La radiochimiothérapie postopératoire , recommandée depuis de nombreuses années, présente une toxicité plus élevée et une efficacité moindre par rapport aux méthodes préopératoires [15]. Elle n’est généralement envisagée que si la chirurgie primaire révèle un stade tumoral plus avancé, avec alors l’indication d’une radiochimiothérapie [3].
La radiothérapie postopératoire seule réduit le taux de récidive locale, mais n’a aucun effet sur la survie globale [16].
La chimiothérapie postopératoire seule, en cas de contre-indication à la radiothérapie (par ex. irradiation antérieure de la prostate ou en cas d’irradiation postopératoire de tumeurs gynécologiques), réduit également le risque de récidive, mais elle est inférieure à la radiochimiothérapie combinée postopératoire [17].
Volume cible et dosage
La position d’irradiation en décubitus ventral présente souvent des avantages par rapport à l’irradiation en décubitus dorsal en raison d’une meilleure protection de l’intestin grêle en cas de “ventroposition” / déplacement de l’intestin grêle dans l’évidement de la planche à trous (fig. 3). Il faut également veiller à ce que la vessie soit bien remplie, car cela peut permettre de déplacer l’intestin grêle en direction crânienne.

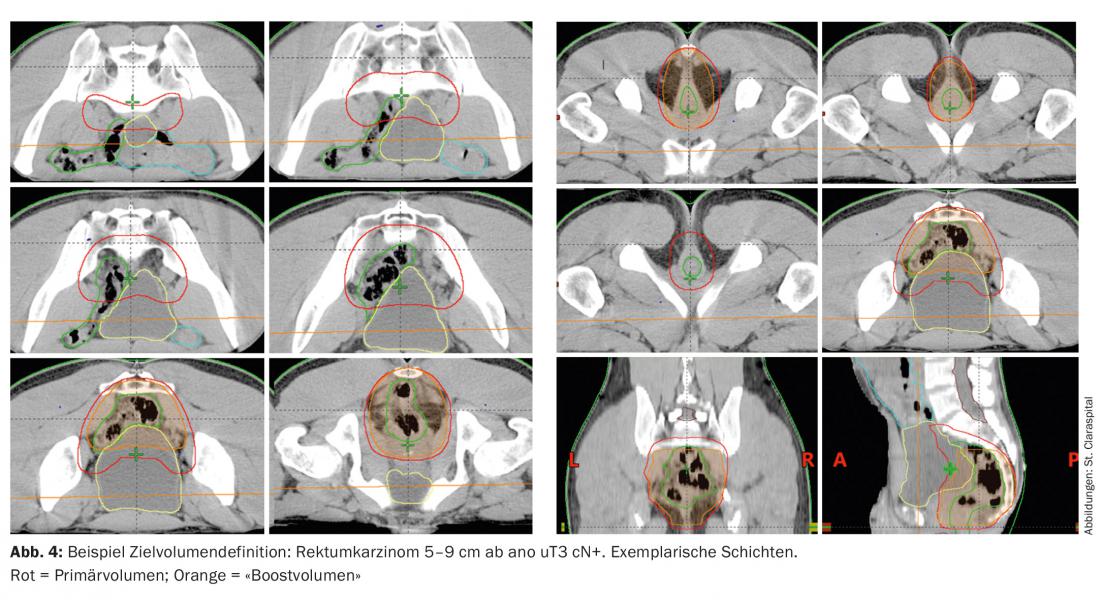
Le volume cible inclut la totalité de la tumeur, y compris le mésorectum avec les ganglions lymphatiques présacrés et iliaques (définition du volume cible Fig. 4). Pour les tumeurs du haut et du moyen rectum, le sphincter doit être épargné afin d’éviter les insuffisances post-thérapeutiques et l’incontinence [3]. En cas de tumeurs profondes et d’infiltration de la peau, l’irradiation des ganglions lymphatiques inguinaux doit être envisagée, car dans ce cas, des infiltrations ganglionnaires inguinales peuvent se produire.
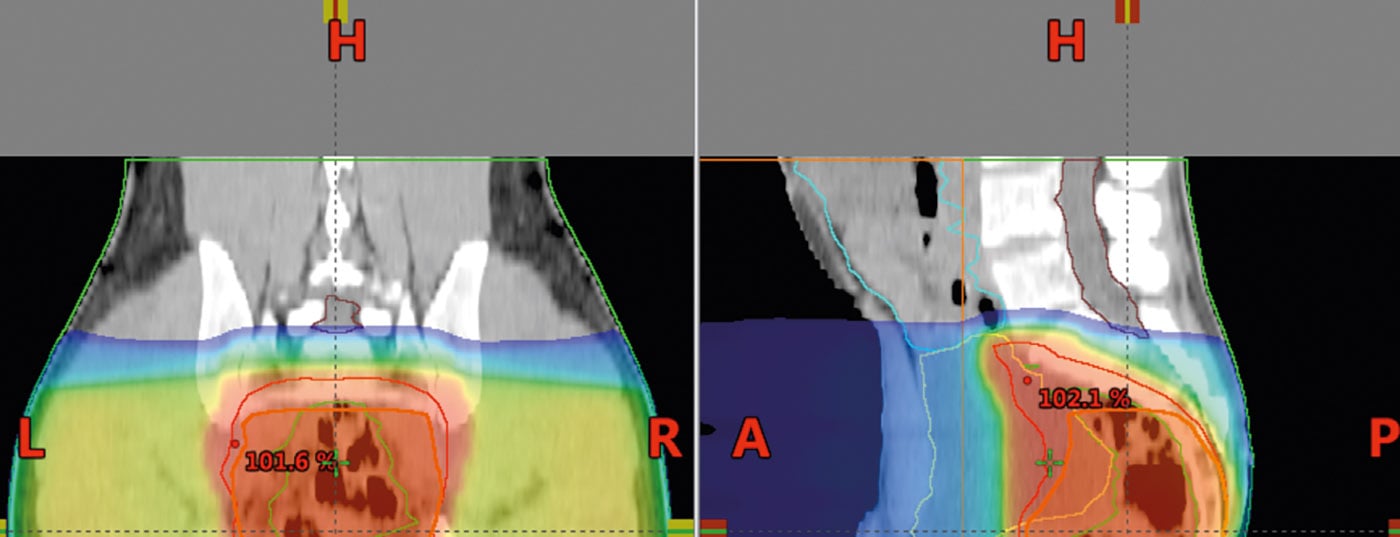
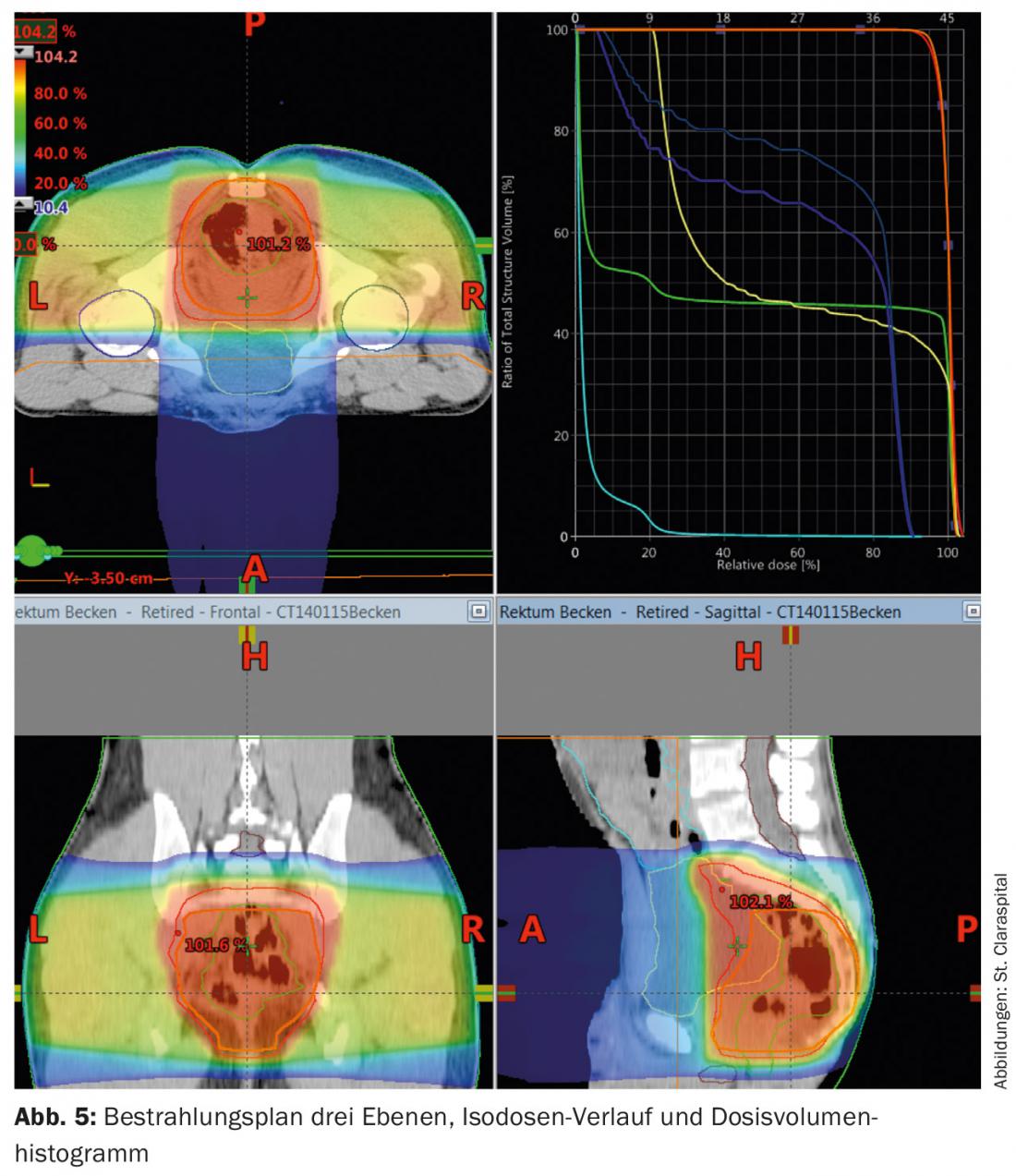
La tomographie assistée par ordinateur est utilisée pour la planification de la radiothérapie. Les calculs de dose et la détermination de la zone à irradier (“définition du volume cible”) sont effectués sur la base de ces données. La dose pour l’irradiation à long terme est de 45-50,4 Gy avec des doses individuelles de 1,8 Gy, en postopératoire également 45-50,4 Gy (Fig. 5). Un concept de “boost” et une éviction des structures à risque après 45 Gy offrent la possibilité de réduire la toxicité.
La radiothérapie avec modulation d’intensité (IMRT) peut, dans certaines circonstances, réduire la toxicité au niveau de l’intestin grêle ou d’autres structures et organes à risque par rapport à la technique à trois champs et doit être utilisée dans cette situation [18,19].
Opération
Pour les cancers du rectum moyen et distal, la TME (micro résections endoscopiques transanales) est recommandée comme opération radicale [3]. Celle-ci réduit le taux de récidive par rapport aux autres procédures chirurgicales non radicales [20,21]. La TME partielle avec une marge de sécurité suffisante en distal de 5 cm est une possibilité pour les carcinomes du tiers supérieur en raison de la morbidité moindre (consensus ESMO 2011) [3]. Plus récemment, les TEM sont également évalués pour les petites tumeurs de stade T1-2 N0 [22,23].
Chimiothérapie adjuvante
En postopératoire, la recommandation de chimiothérapie doit être faite en fonction du staging préopératoire [3]. Cette recommandation est étayée par l’étude allemande CAO/ARO/AIO-94 et l’étude EORTC 22921, qui ont montré un bénéfice de survie de 6% en valeur absolue et de 4% pour la survie sans progression [15]. Une étude néerlandaise de phase III étudie actuellement une chimiothérapie adjuvante à la capécitabine vs. l’observation après 5× 5 Gy de radiothérapie à court terme et de chirurgie. Des schémas de chimiothérapie plus intensifs, par exemple l’association avec l’oxaliplatine, sont encore en cours d’évaluation.
Effets secondaires
Ceux-ci apparaissent localement lors de l’irradiation : diarrhées, constipations, troubles proctologiques pour des doses à partir de 20-30 Gy, dysurie, saignements, pertes de muqueuses ainsi que, pour les tumeurs profondes, épithéliolyse et, à plus long terme, rarement incontinence et impuissance, en plus d’adhérences et de fibroses d’autres organes ainsi que de troubles de l’équilibre hormonal (en particulier des œstrogènes chez la femme). Le taux de risque de toxicité de grade III (CTC) est de 3 à 11% avec l’utilisation des techniques modernes de radiothérapie. L’association à une chimiothérapie peut entraîner des effets secondaires systémiques tels que des modifications de la formule sanguine et une augmentation du taux d’infection, des réactions allergiques, des nausées et des vomissements. De nombreux symptômes peuvent être atténués par des médicaments contre les nausées/vomissements, la diarrhée et les soins de la peau.
Littérature :
- Ning Y, Wang L, Giovannucci EL : A quantitative analysis of body mass index and colorectal cancer : findings from 56 observational studies. Obes Rev 2010 ; 11(1) : 19-30.
- Austin GL, et al : Une consommation modérée d’alcool protège contre les adénomes colorectaux chez les fumeurs. Dig Dis Sci 2008 ; 53(1) : 116-122.
- Ligne directrice S3 de la DKG : www.krebsgesellschaft.de/leitlinien-onkologie.de, version août 2014.
- Pox CP, et al : Efficacité d’un programme national de dépistage du cancer colorectal par coloscopie. Gastroentérologie 2012.
- Whitlock EP, et al : Screening for colorectal cancer : a targeted, updated systematic review for the U.S. Preventive Services Task Force. Ann Intern Med 2008 ; 149(9) : 638-658.
- Peeters KC, et al : The TME trial after a median follow-up of 6 years : increased local control but no survival benefit in irradiated patients with resectable rectal carcinoma. Ann Surg 2007 ; 246(5) : 693-701.
- Sauer R, et al : Chimioradiothérapie préopératoire versus postopératoire pour le cancer rectal localement avancé : résultats de l’essai randomisé allemand CAO/ARO/AIO-94 phase III après un suivi médian de 11 ans. J Clin Oncol 2012 ; 30 : 1926-1933.
- Fleming FJ, Påhlman L, Monson JR : Traitement néoadjuvant dans le cancer rectal. Dis Colon Rectum 2011 Jul ; 54(7) : 901-912.
- Junginger T, et al : [Carcinome rectal : y a-t-il trop de traitement néoadjuvant administré ? Propositions pour une indication plus sélective basée sur l’IRM]. Zentralbl Chir 2006 ; 131(4) : 275-284.
- Smith N, Brown G : Stadification préopératoire du cancer rectal. Acta Oncol 2008 ; 47(1) : 20-31.
- Bujko K, et al : Sphincter preservation following preoperative radiotherapy for rectal cancer : report of a randomised trial comparing short-termotherapy vs. conventionally fractionated radiochemotherapy.Radiotherm Oncol 2004 ; 72(1) : 15-24.
- Bosset JF, et al : Chimiothérapie avec radiothérapie préopératoire dans le cancer rectal. N Engl J Med 2006 ; 355(11) : 1114-1123.
- Gerard JP, et al : Radiothérapie préopératoire avec ou sans fluorouracil et leucovorine concomitants dans les cancers rectaux T3-4 : résultats de FFCD 9203. J Clin Oncol 2006 ; 24(28) : 4620-4625.
- Rödel C, Sauer R : Intégration de nouveaux agents dans un traitement combiné pour les patients atteints de cancer rectal. Strahlenther Onkol 2007 ; 183(5) : 227-235.
- Sauer R, et al : Chimioradiothérapie préopératoire versus postopératoire pour le cancer rectal. N Engl J Med 2004 ; 351(17) : 1731-1740.
- Rödel C, Sauer R : Radiothérapie et radiochimiothérapie concomitante pour le cancer rectal. Surg Oncol 2004 ; 13(2-3) : 93-101.
- Conférence de consensus des NIH. Traitement adjuvant pour les patients atteints de cancer du côlon et du rectum. Jama 1990 ; 264(11) : 1444-1450.
- Parekh A, et al : Toxicité gastro-intestinale aiguë et réponse tumorale avec la radiothérapie préopératoire à intensité modulée pour le cancer rectal. Gastrointest Cancer Res 2013 Sep ; 6(5-6) : 137-143.
- Engels B, et al : Radiothérapie préopératoire à intensité modulée et guidée par l’image avec un boost intégré simultané dans le cancer rectal localement avancé : rapport sur la toxicité tardive et les résultats. Radiother Oncol 2014 Jan ; 110(1) : 155-159.
- Brown CJ, Fenech DS, McLeod RS : Techniques de reconstruction après résection rectale pour cancer rectal. Cochrane Database Syst Rev 2008 ; (2) : CD006040.
- Fazio VW, et al : A randomized multicenter trial to compare long-term functional outcome, quality of life, and complications of surgical procedures for low rectal cancers. Ann Surg 2007 ; 246(3) : 481-488 ; discussion 488-490.
- Moore JS, et al : La microchirurgie endoscopique transanale est plus efficace que l’excision transanale traditionnelle pour la résection des masses rectales. Dis Colon Rectum 2008 ; 51(7) : 1026-1030 ; discussion 1030-1031.
- Kuhry E, et al : Résultats à long terme de la résection laparoscopique du cancer colorectal. Cochrane Database Syst Rev 2008 ; (2) : CD003432.
InFo ONKOLOGIE & HÉMATOLOGIE 2015 ; 3(8) : 16-19