Les maladies glomérulaires sont des causes importantes d’insuffisance rénale terminale. Sur le plan pathogénique, les processus à médiation immunitaire sont au premier plan. Grâce aux progrès des connaissances sur la physiopathologie et aux méthodes modernes de génie génétique, l’espoir d’un traitement le plus ciblé possible et avec le moins d’effets secondaires est permis. Les nouvelles approches de traitement des maladies glomérulaires sont brièvement examinées dans cet article et quelques substances sont présentées à titre d’exemple.
Les glomérulopathies (GP) sont une cause importante d’insuffisance rénale chronique et terminale. Aux États-Unis, la néphropathie diabétique est la première étiologie de l’insuffisance rénale terminale (IRT), la GP non diabétique la troisième. La pathogenèse de ce groupe hétérogène de maladies est généralement à médiation immunitaire. Les principes thérapeutiques généraux incluent, outre un traitement de soutien, un traitement spécifique dans certains cas. Celle-ci se compose généralement d’immunosuppresseurs à l’action relativement peu ciblée et à la toxicité parfois cumulative, ce qui s’avère problématique dans le cas des GP souvent récidivantes. Grâce à l’élucidation croissante des processus pathogéniques de différents GP au cours des dernières décennies et aux méthodes modernes de génie génétique, l’espoir d’une thérapie ciblée sur le mécanisme pathologique existe.
Cet aperçu a pour but d’identifier, sans être exhaustif, les développements récents dans le traitement des maladies glomérulaires. Des sujets pertinents pour la pratique ainsi que des approches et des concepts thérapeutiques innovants seront mis en lumière.
Thérapie de soutien
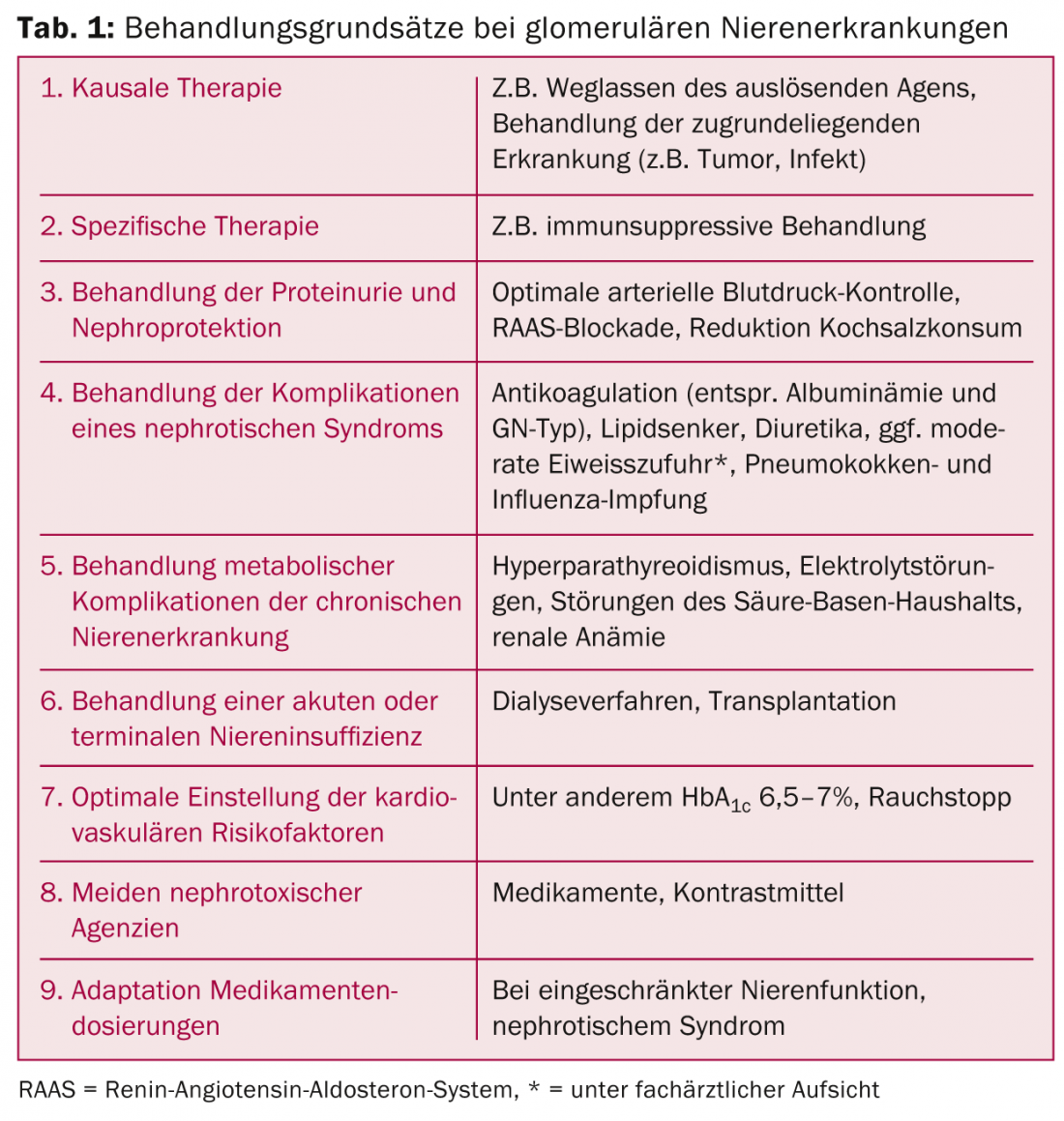
Comme pour toutes les maladies rénales chroniques, un traitement de soutien optimal est essentiel. Il est parfois possible d’éviter les traitements immunosuppresseurs et d’améliorer le pronostic rénal et/ou global. Le prestataire de soins primaires a un rôle clé à jouer dans ce domaine. Les pierres angulaires thérapeutiques sont présentées dans le tableau 1.
Dans le traitement de la protéinurie, outre un contrôle strict des valeurs de la pression artérielle (<130/90 mmHg chez les non-diabétiques, <130/ 85 mmHg pour les diabétiques) [1] et une consommation limitée de sel de cuisine (5-6 g/d), l’inhibition médicamenteuse du système rénine-angiotensine-aldostérone (SRAA) est indiquée. Les inhibiteurs de l’ECA et les sartans sont administrés à dose maximale après tolérance (dose maximale plus élevée que pour le traitement de l’hypertension). Les preuves de ces dernières années ont remis en question l’intérêt d’un double blocage du SRAA [2,3]. En effet, malgré un effet additif sur la protéinurie, les risques d’hyperkaliémie et d’insuffisance rénale aiguë sont plus élevés, en particulier chez les diabétiques, et le pronostic cardiovasculaire n’est pas amélioré. Il n’est donc actuellement plus possible de recommander de manière générale la réintroduction d’une telle médication chez les patients atteints de maladies rénales. L’association d’un IEC ou d’un sartan avec des antagonistes de l’aldostérone a un effet synergique sur la protéinurie avec toutefois un risque accru d’épisodes d’hyperkaliémie sévère, en particulier en cas de fonction rénale altérée.
Thérapie ciblée sur les cellules B
En raison de leur rôle central dans la pathogenèse des maladies auto-immunes (production d’auto-anticorps pathogènes, présentation d’antigènes, production de cytokines pro-inflammatoires), les lymphocytes B ont été étudiés en tant que cible thérapeutique dans plusieurs GP au cours des dernières années.
Rituximab
Le rituximab (RTX) est un anticorps monoclonal chimérique (souris/homme) dirigé contre l’antigène de surface CD20 des lymphocytes B (tableau 2). La liaison à cet antigène induit une lyse cellulaire et entraîne une déplétion des lymphocytes B dans le sang périphérique. Depuis son introduction dans le traitement du lymphome non hodgkinien en 1997, l’utilisation du RTX s’est étendue aux maladies auto-immunes telles que la polyarthrite rhumatoïde et à la médecine de transplantation. Le RTX a été utilisé jusqu’à présent dans le traitement de divers GP [4]. Les principales indications étudiées actuellement sont les vascularites associées aux ANCA, la néphrite lupique et la glomérulopathie membraneuse idiopathique.
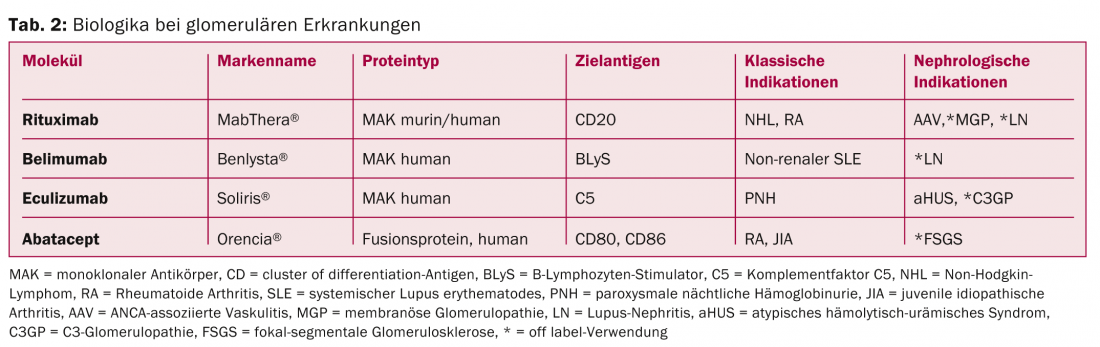
Vascularites associées aux ANCA (AAV) : Le traitement des AAV par RTX a été approuvé en Suisse en 2012. L’autorisation de mise sur le marché est basée sur deux études randomisées contrôlées (RCT) incluant des patients avec une implication rénale d’une AAV ; les études ont montré une efficacité comparable (peut-être même une efficacité supérieure en cas de récidive) avec un taux d’effets secondaires (inattendu) comparable à celui du traitement standard par cyclophosphamide et stéroïdes à haute dose [5,6]. Selon les directives internationales, cette thérapie peut être considérée comme une alternative au traitement standard. En raison du manque de données à long terme, la substance est actuellement utilisée en pratique notamment en cas de contre-indications au traitement conventionnel (p. ex. désir d’enfant), de récidives ou de cas réfractaires.
Lupus néphrétique (LN) : le RTX a été utilisé avec succès dans le traitement du LN dans de nombreuses études observationnelles et séries de cas (principalement lors de poussées sévères, de récidives, dans des situations réfractaires et en cas de contre-indications au traitement conventionnel). Deux ECR portant sur le RTX en tant que traitement d’appoint chez des patients atteints de lupus érythémateux systémique rénal ou extrarénal actif montrent des taux de rémission comparables à ceux du traitement placebo [7,8]. Malgré ces résultats décevants, que les experts attribuent entre autres à la conception de l’étude, et encouragés par les données de suivi et l’expérience pratique, de nombreux cliniciens continuent de traiter hors étiquette avec le RTX, en particulier dans les situations mentionnées. D’autres études sont prévues pour évaluer le RTX dans le traitement de la LN sur la base de différents schémas immunosuppresseurs.
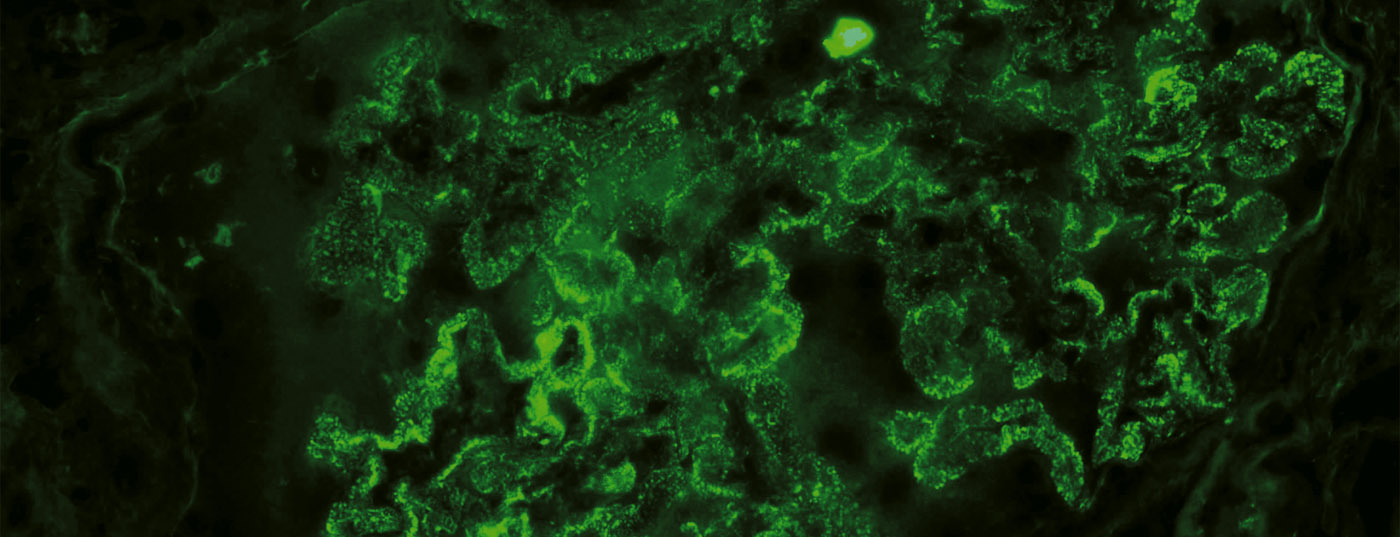
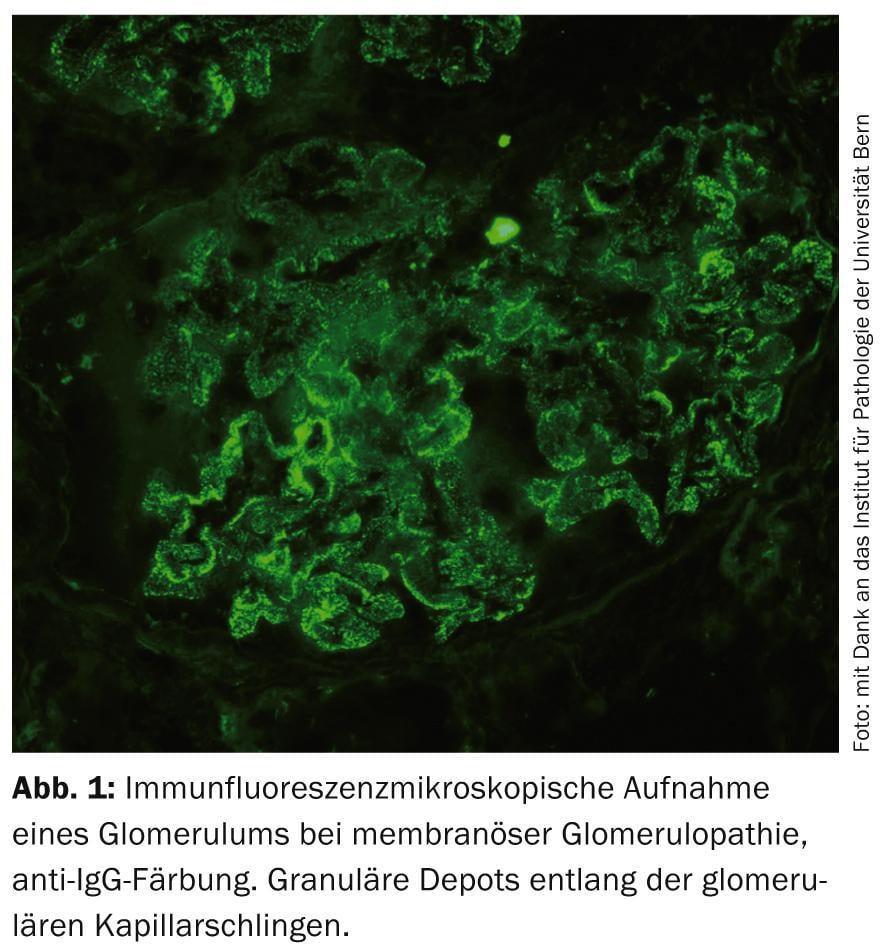
Glomérulopathie membraneuse idiopathique (GMP) : La GMP est l’une des GP primaires les plus fréquentes (figure 1). Au cours de la dernière décennie, des recherches révolutionnaires ont apporté la preuve que la MGP est une maladie auto-immune caractérisée par la formation d’auto-anticorps dirigés contre des antigènes podocytaires [9]. Dans ce contexte, un traitement par RTX est intéressant d’un point de vue physiopathologique. Jusqu’à présent, le RTX a été utilisé avec succès dans de nombreuses études observationnelles avec différents schémas d’administration pour traiter les cas, surtout ceux qui résistent au traitement [10]. Des données contrôlées et à long terme font défaut à l’heure actuelle, mais plusieurs ECR comparant cette substance à des traitements de soutien ou à d’autres traitements immunosuppresseurs sont en cours. En pratique, le RTX est actuellement utilisé hors étiquette dans la MGP, principalement en cas d’auto-anticorps détectés.
L’utilisation généralisée du RTX montre une bonne tolérance générale. Les effets secondaires les plus fréquents sont les réactions à la perfusion (d’où la nécessité d’une prémédication), la neutropénie, l’hypogammaglobulinémie et les infections ; des cas isolés de leucoencéphalopathie multifocale progressive ont été décrits.
Les plasmocytes ne sont pas déplétés par le RTX, les cellules B tissulaires ne le sont éventuellement que partiellement. Un effet limité subsiste en cas de syndrome néphrotique, de polymorphisme du récepteur Fc-γ et de taux élevés de facteur de stimulation des cellules B (BLyS). De plus, une petite partie des cellules B, des cellules B régulatrices ayant un effet anti-inflammatoire, est également déplétée.
Belimumab
Le belimumab (BEL) est un anticorps monoclonal humanisé qui se lie à la BLyS soluble et inhibe ainsi la survie des cellules B et leur différenciation en plasmocytes. BEL a récemment été approuvé pour le traitement du LED extrarénal. Des analyses posthoc des données montrent une possible réduction du taux de récidives rénales chez les patients traités par BEL [11]. Des études sur le LES rénal avec ou sans administration de RTX (comme immunomodulation synergique des cellules B) aideront à définir le rôle de BEL pour les néphrologues.
Eculizumab
L’éculizumab (ECU) est un anticorps monoclonal humanisé dirigé contre le facteur C5 du complément, qui se trouve à l’extrémité commune de la cascade d’activation du complément. Initialement utilisé pour le traitement de l’hémoglobinurie paroxystique nocturne, le produit est autorisé depuis 2011 pour le traitement du syndrome hémolytique et urémique atypique. Les glomérulopathies en C3 (C3GP), qui ont été récemment distinguées des glomérulonéphrites membranoprolifératives classiques à médiation par des complexes immuns (par ex. lors d’infections ou de néoplasies) grâce à de nouvelles connaissances, constituent une autre entité pathologique liée à une dérégulation de la voie alternative du complément [12]. Dans ce contexte, l’utilisation réussie de l’ECU a été documentée dans des descriptions de cas. En raison des lésions souvent médiées par le complément, ECU a également été testé dans d’autres GN comme la néphropathie à IgA, la LN et la MGP. Les espoirs d’une utilisation à grande échelle sont actuellement freinés par le coût extrêmement élevé d’un tel traitement, qui pourrait durer toute la vie.
Abatacept
La protéine de fusion abatacept (ABT) se lie à l’antigène CD80 sur les cellules T, inhibant ainsi la costimulation des cellules T par les cellules présentatrices d’antigène. Jusqu’à présent, les données disponibles concernent principalement la LN (RCT, négatif) et l’AAV (observationnel, positif). Il est intéressant de noter que l’induction de molécules de surface CD80 dans les podocytes a récemment été démontrée dans le cas de la maladie rénale protéinurique. ABT a ainsi été utilisé avec succès chez cinq patients atteints de glomérulosclérose segmentaire focale primaire (FSGS) ainsi que de FSGS récurrente après une transplantation rénale [13]. Ces données prometteuses attendent d’être confirmées par d’autres études.
Stéroïdes topiques pour la néphropathie à IgA
La néphropathie à IgA (IgA-NP) est la GP la plus fréquente au monde. Les dépôts mésangiaux d’anticorps IgA insuffisamment glycosylés, associés à des auto-anticorps induits, entraînent une inflammation glomérulaire. On pense que la cause est une dérégulation du système immunitaire muqueux, qui entraîne un défaut de tolérance immunitaire, par exemple aux antigènes alimentaires ou bactériens. Dans une étude suédoise de preuve de principe, le budésonide a été utilisé dans une nouvelle formulation à libération dans la région iléo-caecale pour traiter les patients atteints d’IgA-NP et une réduction de la protéinurie a été observée. Outre ce nouveau concept thérapeutique, il est intéressant de noter que les effets systémiques induits par les stéroïdes sont minimisés [14]. Une étude de phase II est actuellement en cours.
Hormone adrénocorticotrope
L’hormone adrénocorticotrope (ACTH) a été utilisée dès les années 1950 pour traiter le syndrome néphrotique, puis abandonnée au profit des glucocorticoïdes oraux, plus faciles à administrer. Grâce à une redécouverte fortuite dans le cadre d’une étude sur les lipides chez des patients atteints de MGP néphrotique, son utilisation s’est accrue ces dernières années dans les GP protéinuriques (ACTH synthétique en Europe, ACTH d’origine animale sous forme de gel aux États-Unis). Le mécanisme d’action semble aller au-delà de l’induction de la production de cortisol et être médiatisé par la liaison aux récepteurs de la mélanocortine sur les podocytes. Pour la maladie du changement minimal et la FSGS primaire, il existe à ce jour des données observationnelles, tandis que pour la MGP, il existe en outre un ECR pilote dont les résultats sont prometteurs [15]. Des effets secondaires de type stéroïde ont été décrits. Là encore, le coût élevé des thérapies est un facteur limitant.
Eprodisate
L’amylose AA est une maladie multisystémique qui peut survenir lors d’infections chroniques ou de maladies inflammatoires et qui se caractérise par des dépôts fibrillaires d’amyloïde A sérique, une protéine de phase aiguë. L’implication rénale fréquente se manifeste par une protéinurie et une insuffisance rénale. Outre le traitement de la maladie sous-jacente, une nouvelle cible thérapeutique consiste en des dépôts fibrillaires. L’éprodisate est une molécule sulfonée présentant des similitudes structurelles avec l’héparane sulfate, qui se lie aux sites de liaison des glycosaminoglycanes sur la protéine amyloïde A sérique et inhibe la polymérisation des fibrilles. Un ECR récent a montré un ralentissement du déclin de la fonction rénale [16].
D’autres études doivent confirmer ces résultats.
Conclusion pour la pratique
- Il n’y a pas d’indication générale pour un double blocage du SRAA dans le traitement de la protéinurie.
- Le rituximab est autorisé dans le traitement d’induction des vascularites associées aux ANCA et est utilisé hors étiquette dans la néphrite lupique et la glomérulopathie membraneuse idiopathique.
- L’éculizumab est autorisé dans le traitement du syndrome hémolytique et urémique, et les premières études sur son utilisation dans les glomérulopathies C3 sont en cours.
- L’utilisation réussie de l’abatacept dans la glomérulosclérose segmentaire focale primaire et de l’hormone adrénocorticotrope dans les glomérulopathies protéinuriques a été récemment décrite.
- Les premiers résultats de l’étude sur l’administration de stéroïdes topiques dans la néphropathie à IgA sont intéressants.
Littérature :
- Mancia G, et al. : 2013 ESH/ESC Practice Guidelines for the Management of Arterial Hypertension. Blood Press 2014 ; 23(1) : 3-16.
- Mann JF, et al : Résultats rénaux avec le telmisartan, le ramipril, ou les deux, chez les personnes à haut risque vasculaire (l’étude ONTARGET) : un essai contrôlé multicentrique, randomisé, en double aveugle. Lancet 2008 ; 372(9638) : 547-553.
- Parving HH, et al : Cardiorenal end points in a trial of aliskiren for type 2 diabetes. N Engl J Med 2012 ; 367(23) : 2204-2213.
- Mani LY, et al. : [Rationale and clinical evidence for the use of rituximab in glomerular diseases]. Rev Med Suisse 2011 ; 7(290) : 819-824.
- Specks U, et al : Efficacité des régimes d’induction de la rémission pour la vascularite associée aux ANCA. N Engl J Med 2013 ; 369(5) : 417-427.
- Jones RB, et al : Rituximab versus cyclophosphamide dans la vascularite rénale associée à l’ANCA. N Engl J Med 2010 ; 363(3) : 211-220.
- Rovin BH, et al : Efficacité et sécurité du rituximab chez les patients atteints de néphrite lupique proliférative active : l’étude Lupus Nephritis Assessment with Rituximab. Arthritis Rheum 2012 ; 64(4) : 1215-1226.
- Merrill JT, et al : Efficacité et sécurité du rituximab dans le lupus érythémateux systémique modérément à sévèrement actif : l’évaluation randomisée, en double aveugle, phase II/III SLE de l’essai rituximab. Arthritis Rheum 2010 ; 62(1) : 222-233.
- Beck LH, et al : Le récepteur de la phospholipase A2 de type M comme antigène cible dans la néphropathie membraneuse idiopathique. N Engl J Med 2009 ; 361(1) : 11-21.
- Ruggenenti P, et al : Rituximab in idiopathic membranous nephropathy. J Am Soc Nephrol 2012 ; 23(8) : 1416-1425.
- Dooley MA, et al : Effect of belimumab treatment on renal outcomes : results from the phase 3 belimumab clinical trials in patients with SLE. Lupus 2013 ; 22(1) : 63-72.
- Fakhouri F, et al : Glomérulopathie C3 : une nouvelle classification. Nat Rev Nephrol 2010 ; 6(8) : 494-499.
- Yu CC, et al : Abatacept in B7-1-positive proteinuric kidney disease. N Engl J Med 2013 ; 369(25) : 2416-2423.
- Smerud HK, et al : Nouveau traitement pour la néphropathie à IgA : le budésonide entérique ciblé sur la région iléo-cæcale améliore la protéinurie. Nephrol Dial Transplant 2011 ; 26(10) : 3237-3242.
- Ponticelli C, et al : A randomized pilot trial comparing ethylprednisolone plus a cytotoxic agent versus synthetic adrenocorticotropic hormone in idiopathic membranous nephropathy. Am J Kidney Dis 2006 ; 47(2) : 233-240.
- Dember LM, et al : Eprodisate for the treatment of renal disease in AA amyloidosis. N Engl J Med 2007 ; 356(23) : 2349-2360.
CARDIOVASC 2015 ; 14(1) : 9-12