De nouvelles thérapies sous forme d’anticorps spécifiques et de “petites molécules” ont ouvert une nouvelle ère. Les médicaments biologiques interviennent dans le processus inflammatoire de la dermatite atopique en ciblant certaines cytokines. Les inhibiteurs de JAK, en revanche, sont des agents de faible poids moléculaire qui agissent en inhibant la voie de signalisation JAK/STAT. Dans l’esprit de la médecine personnalisée, il s’agit de plus en plus de choisir le médicament le plus adapté à chaque individu.
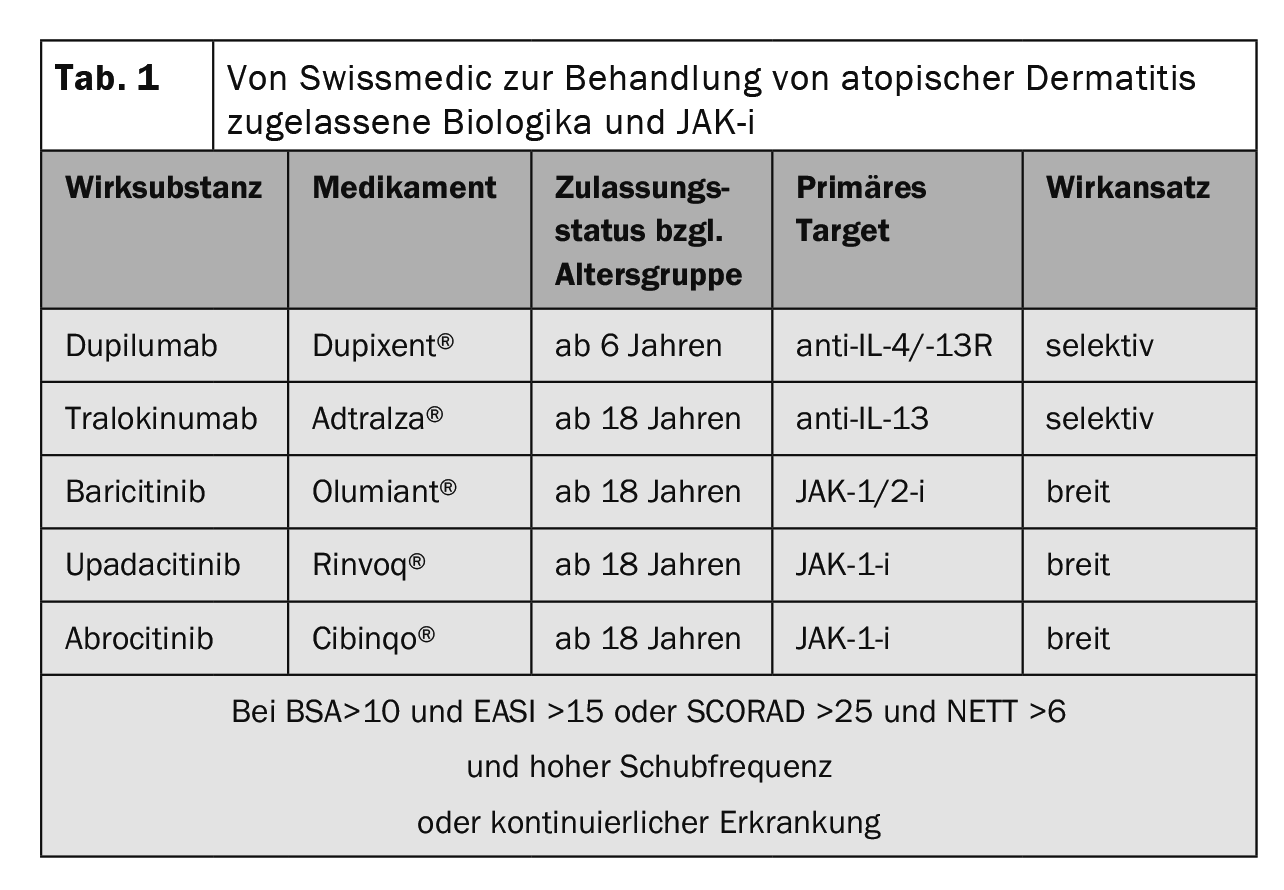
La physiopathologie complexe de la dermatite atopique (DA) fait intervenir une prédisposition génétique, des facteurs environnementaux et une dérégulation de l’immunité innée et adaptative. Les réactions immunitaires de type 2 ne constituent pas seulement le corrélat cellulaire de l’inflammation de la peau dans la DA, mais influencent également de manière significative le dysfonctionnement de la barrière et la dysbiose microbienne [1,2]. Le “Severity Scoring of Atopic Dermatitis” (SCORAD) peut être utilisé pour définir la sévérité de la DA. En dessous de 25 points, l’eczéma atopique est classé comme léger, entre 25 et 60 points comme modéré et au-delà de 60 points comme sévère [3,4]. Dans environ un cinquième des cas de MA, les évolutions sont modérées à sévères. Les objectifs principaux du traitement sont la réduction du prurit, l’amélioration de la réponse inflammatoire et la restauration d’une barrière cutanée intacte [5]. Les directives internationales recommandent d’adapter le traitement de la MA aux différentes phases, à la gravité et à la chronicité selon un schéma de traitement par étapes [6]. Ces dernières années, des progrès significatifs ont été réalisés, en particulier dans le domaine des traitements systémiques [7]. Outre les anticorps monoclonaux tralokinumab et dupilumab administrés par injection sous-cutanée, les inhibiteurs de la Janus kinase (JAK) baricitinib, upadacitinib et abrocitinib sont disponibles sous forme d’administration orale (tableau 1).
Produits biologiques actuellement autorisés – IL-4 et IL-13 comme cytokines clés
Les cytokines Th2, l’interleukine (IL)-4 et l’IL-13, sont largement impliquées dans les réactions allergiques médiées par les IgE et jouent un rôle physiopathologique clé dans les réactions inflammatoires et le dysfonctionnement de la barrière dans la MA [10,14,25]. Une boucle de rétroaction positive se traduit par une diminution de la différenciation des kératinocytes et une augmentation de l’hyperplasie épidermique.
Le dupilumab bloque spécifiquement les voies de signalisation IL-4/IL-13 et est le premier anticorps monoclonal approuvé dans le domaine de la dermatite atopique. En Suisse, le dupilumab (Dupixent®) est autorisé depuis 2019 pour le traitement de la dermatite atopique modérée à sévère chez les adultes, puis l’indication a été étendue aux adolescents et, depuis juin 2022, le dupilumab peut également être utilisé chez les enfants à partir de 6 ans [24].
Chez les adultes, la dose initiale recommandée est de 600 mg de dupilumab (deux injections de 300 mg) et la dose d’entretien est de 300 mg toutes les deux semaines. Pour les enfants et les adolescents de 6 à 17 ans, la posologie recommandée dépend du poids corporel.
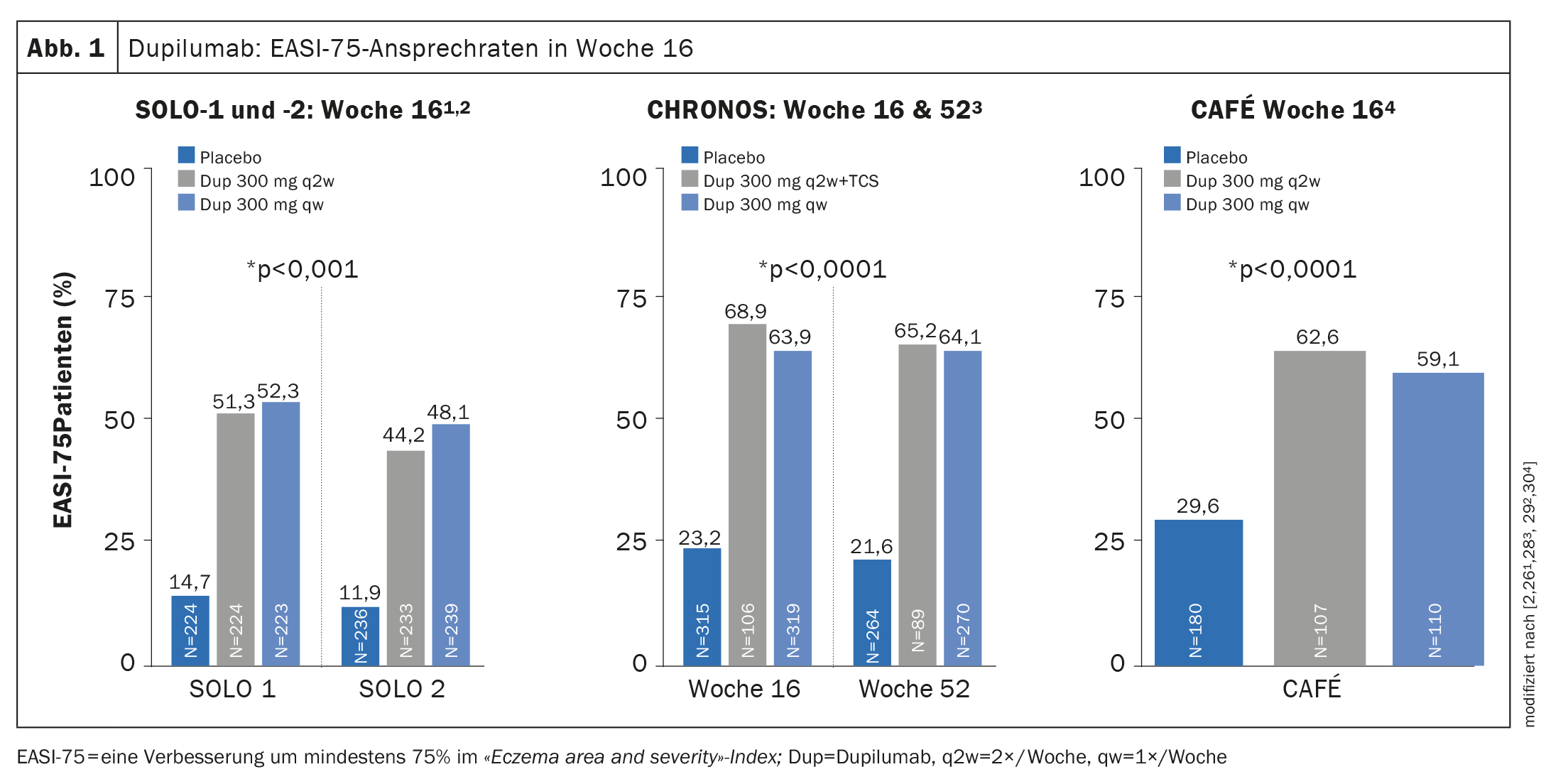
Preuves d’efficacité dans les études de phase III : dans SOLO-1 et -2 (monothérapie) ainsi que dans CHRONOS (thérapie combinée avec TCS concomitants), plus de 35% des patients ont obtenu un score IGA (Investigator’s Global Assessment) de 0 ou 1 à la semaine 16, ce qui correspond à une peau sans ou presque sans apparition [26,28]. Le taux de réponse EASI-75 a été atteint à la fois dans SOLO-1 et -2 et dans CAFÉ à la semaine 16 (Fig. 1) et, dans CHRONOS, également à la semaine 52 [26,28–30]. Dans l’étude OLE, le taux de réponse IGA 0/1 a atteint un plateau d’environ 60% à la semaine 48, qui s’est maintenu jusqu’au point final de l’étude à la semaine 76 [31,43].
En outre, le dupilumab a montré un soulagement rapide du prurit par rapport au placebo, avec une amélioration des moindres carrés moyens d’environ 20% dans les deux semaines suivant le début du traitement [26,28–31].
L’approbation du dupilumab pour les adolescents est basée sur les données cliniques du programme LIBERTY AD. L’efficacité et la sécurité d’une monothérapie par dupilumab à la dose de 200 mg ou 300 mg toutes les deux semaines ont été évaluées dans une étude randomisée en double aveugle chez 251 patients de 12 à 17 ans atteints de MA modérée à sévère [32].
Sous dupilumab, 42% ont obtenu une réponse EASI-75 et 24% une réponse IGA 0/1. Dans le groupe placebo, les valeurs correspondantes étaient respectivement de 8% et 2%. Pour la population pédiatrique des 6-11 ans, l’efficacité et la sécurité du dupilumab en association avec des corticostéroïdes topiques (TCS) ont été évaluées dans les études AD-1652 et AD-1434 [33].
Profil de sécurité : les effets secondaires les plus fréquents du dupilumab sont les réactions au site d’injection et la conjonctivite, ainsi que les douleurs articulaires, l’herpès oral et l’éosinophilie [33]. Dans la plupart des cas, la conjonctivite peut être traitée avec succès par des médicaments topiques (gouttes ophtalmiques à base d’acide hyaluronique ou de fluorométholone (0,1%) ou pommade ophtalmique au tacrolimus (0,03)) [34]. Les signaux de sécurité du dupilumab chez les enfants et les adolescents se sont révélés globalement comparables à ceux observés chez les adultes.
Contre-indications : Aucune contre-indication connue, à l’exception de très rares réactions générales d’hypersensibilité systémique [24].
Suivi du traitement et précautions : Il est recommandé de mettre à jour le statut vaccinal des patients conformément aux recommandations actuelles en matière de vaccination avant de commencer le traitement par dupilumab [24]. Les vaccins vivants et les vaccins vivants atténués ne doivent pas être utilisés en même temps que le dupilumab, car la sécurité et l’efficacité cliniques n’ont pas été établies.
Le tralokinumab est un anticorps monoclonal humain qui neutralise spécifiquement l’IL-13. En Suisse, le tralokinumab (Adtralza®) est autorisé depuis juin 2022 pour les patients adultes atteints de DA modérée à sévère lorsqu’un traitement avec des médicaments topiques n’est pas efficace [24].
La dose initiale chez l’adulte est de 600 mg (4 injections de 150 mg), suivie d’une dose d’entretien de 300 mg (2 injections de 150 mg), l’intervalle entre les doses étant de 2 semaines. A partir de la semaine 16, l’intervalle peut être étendu à 4 semaines.
Contrairement au dupilumab, le tralokinumab ne se lie pas au récepteur, mais à la partie soluble de l’IL-13, ce qui empêche l’interaction avec le récepteur IL-13Rα1 [35,36]. L’IL-13 est une cytokine clé dans la pathogenèse de la dermatite atopique [35]. Une surexpression de l’IL-13 a été observée à la fois dans les peaux atopiques lésionnelles et non lésionnelles, et il a également été découvert que les niveaux d’IL-13 étaient corrélés à la sévérité de la DA [37].
Preuve d’efficacité dans les études de phase III : dans ECZTRA-1 et -2, 15,8% et 22,2% des patients traités toutes les deux semaines (q2w) avec 300 mg de tralokinumab ont obtenu une IGA 0/1 (absence ou quasi-absence de lésion) à la semaine 16, contre 7,1% et 10,9% dans le groupe placebo comparatif [39,40]. L’EASI-75 a été atteint par 25% des participants à l’étude traités par tralokinumab 300 mg q2w à la semaine 16 dans ECZTRA-1 et par 33,2% dans ECZTRA-2 (Fig. 2) [39,40].
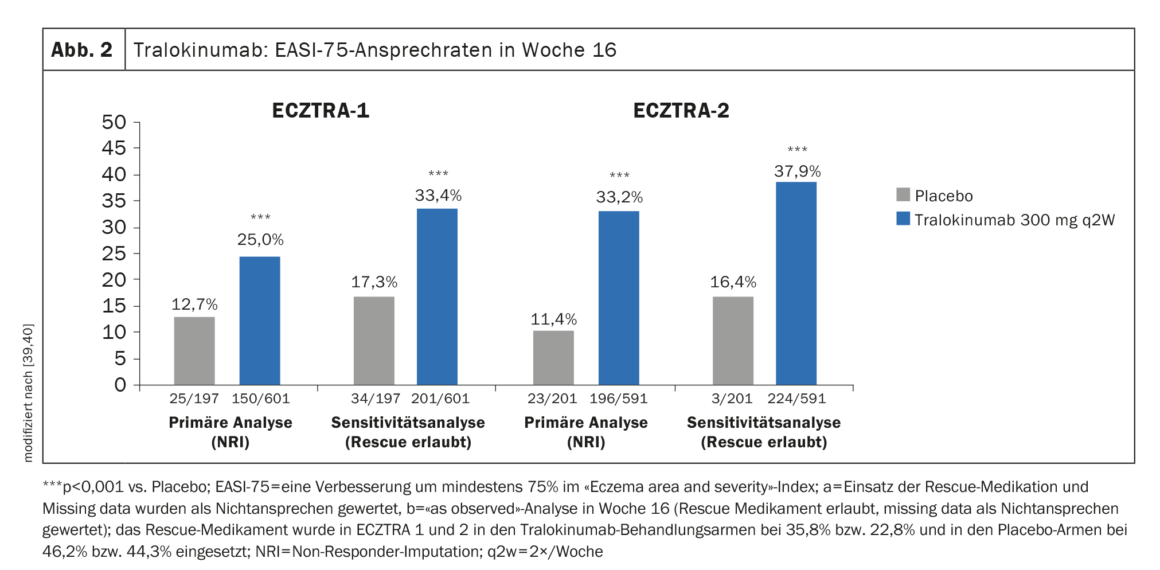
Dans ECZTRA-3, le tralokinumab 300 mg q2w plus TCS a permis à un nombre significativement plus élevé de participants à l’étude d’atteindre l’EASI-75 à la semaine 16 (56,0%) que le placebo, où ce taux était de 35,7%. En ce qui concerne l’IGA 0/1, le bras tralokinumab s’est également révélé significativement supérieur au placebo (38,9% vs 26,2%) [37].
Profil de sécurité : les effets secondaires les plus fréquents sont les infections des voies respiratoires supérieures/le rhume et les réactions au site d’injection. Les conjonctivites ont été légèrement moins fréquentes que sous dupilumab [41].
Contre-indications : Aucune contre-indication connue, à l’exception de très rares réactions générales d’hypersensibilité systémique [24].
Monitiorisation du traitement et précautions : Les vaccins vivants et les vaccins vivants atténués ne doivent pas être administrés en même temps que le tralokinumab, car la sécurité et l’efficacité cliniques n’ont pas été établies. Les intervalles de temps entre une vaccination vivante et un traitement par tralokinumab sont indiqués dans les recommandations actuelles en matière de vaccination.
Les inhibiteurs JAK ont également le vent en poupe
Les inhibiteurs de la Janus kinase (JAK) empêchent la réponse cytokinique intracellulaire (mécanisme JAK-STAT). Le mécanisme d’action des inhibiteurs de JAK consiste à utiliser des “petites molécules” pour bloquer les JAK dont dépendent les récepteurs de cytokines. Avec le baricitinib, l’upadacitinib et l’abrocitinib, trois JAK-i administrés par voie orale sont actuellement autorisés en Suisse pour le traitement systémique de la MA modérée à sévère [24]. Les cytokines centrales du point de vue pathogénique, qui déclenchent leur réponse cytokinique par la voie de signalisation JAK-STAT, sont l’IL-4, l’IL-13 et l’IL-31 [44].
Ce qui est particulièrement intéressant avec JAK-i en tant qu’option thérapeutique, c’est la rapidité d’action. Le profil d’effets secondaires des JAK-i dépend de la substance et de la dose, les infections étant plus fréquentes et certains paramètres de laboratoire étant modifiés sous traitement par rapport aux médicaments biologiques, ce qui nécessite un suivi intensif des patients.
Le baricitinib est un inhibiteur sélectif des JAK1 et JAK2 par voie orale. Les signaux des cytokines clés adaptatives et innées IL-4, IL-13, IL-22, IL-31, TSLP, IFN-γ et IL-6 sont transmis via JAK1 et JAK2 est nécessaire à la fonction du récepteur IL-5, requis lors du recrutement des granulocytes éosinophiles [1].
Le baricitinib (Olumiant®) est autorisé en Suisse depuis février 2021 pour le traitement des patients adultes atteints de dermatite atopique modérée à sévère [24,45]. La posologie standard est de 4 mg (1×/d p.o.). La dose de 2 mg (1×/d p.o.) est envisageable chez les patients âgés de 75 ans et plus ou chez les patients souffrant d’infections chroniques/récurrentes ou dont la clairance de la créatinine est comprise entre 30 et 60 ml/min. Si aucun bénéfice thérapeutique du baricitinib n’est visible après 8 semaines, l’arrêt du traitement doit être envisagé.
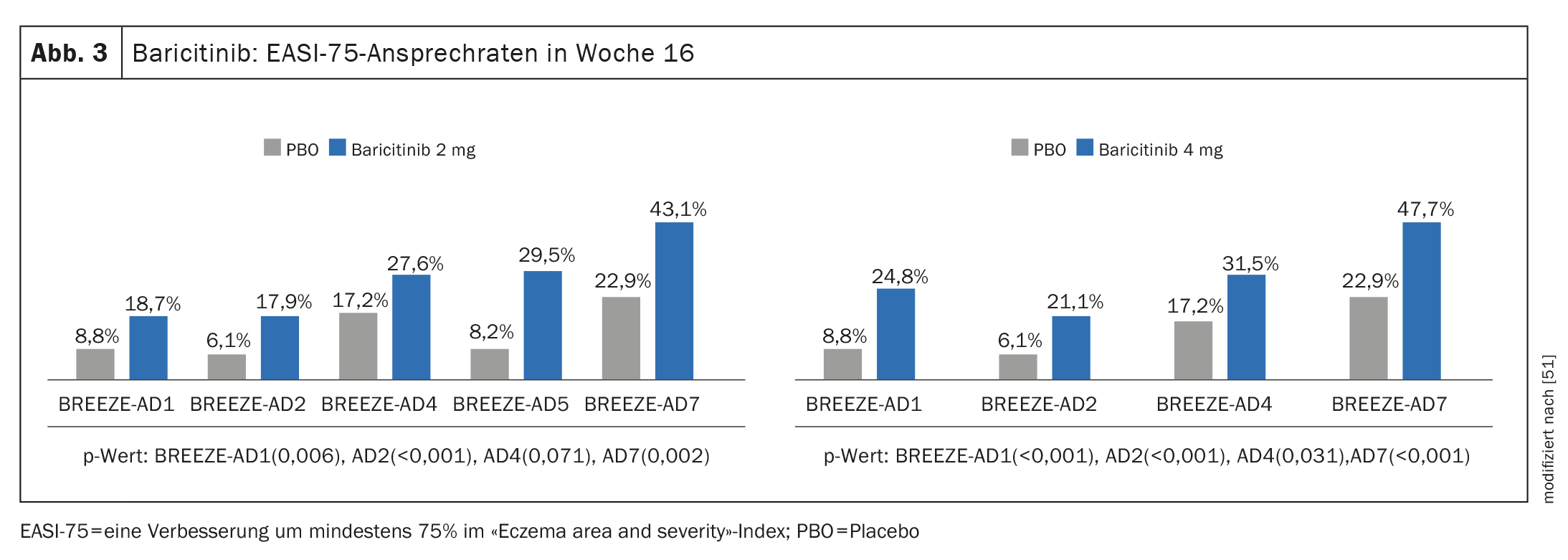
Preuves d’efficacité dans des études de phase III : Dans le cadre du programme d’études pivots de phase III, outre BREEZE-AD1 et BREEZE-AD2, dans lesquels le baricitinib en monothérapie a entraîné une réduction significative des symptômes, l’étude pratique BREEZE-AD7 a notamment été menée pour évaluer l’efficacité et la sécurité du baricitinib en association avec des corticostéroïdes topiques (TCS) [45–47]. 329 patients adultes atteints de DA modérée à sévère ont été randomisés dans BREEZE-AD7 selon un rapport 1:1:1 pour recevoir du baricitinib 4 mg plus TCS ou du baricitinib 2 mg plus TCS ou un placebo. A la semaine 16, environ 47,7% des patients traités par baricitinib 4 mg en association avec TCS ont présenté une réponse EASI-75, contre 22,9% dans le groupe placebo (p<0,001) (Fig. 3). Dans le bras baricitinib 2 mg, les valeurs correspondantes étaient respectivement de 43,1% et 22,9%. (Fig. 3).
Une amélioration du prurit de ≥4 points sur l’échelle de notation numérique (NRS) au cours des 16 premières semaines a été obtenue chez 44% des patients traités par baricitinib (4 mg plus TCS), contre 20% sous placebo plus TCS (p<0,01) [48]. Des données d’étude complètes sur la tolérance du baricitinib dans la MA sont disponibles à partir d’un total de 8 études randomisées portant sur 2531 patients et 2247 patients-années [49].
Profil de sécurité : les effets indésirables les plus fréquemment rapportés lors d’un traitement par baricitinib sont l’augmentation du cholestérol LDL, les infections des voies respiratoires supérieures, les céphalées, l’herpès simplex et les infections urinaires [50]. L’incidence des infections graves sous baricitinib était similaire à celle observée sous placebo.
Contre-indications : Le baricitinib est contre-indiqué pendant la grossesse. Les femmes en âge de procréer doivent utiliser une méthode de contraception fiable pendant l’utilisation du baricitinib et pendant au moins une semaine supplémentaire après l’arrêt du traitement L’utilisation du baricitinib n’est pas recommandée chez les patients présentant un trouble sévère de la fonction hépatique ou une clairance de la créatinine <30 ml/min [50].
Suivi du traitement et précautions : Avant de commencer le traitement, les patients doivent être évalués pour détecter des troubles sévères de la fonction hépatique et rénale ainsi que des antécédents de facteurs de risque de thrombose veineuse profonde ou d’embolie pulmonaire. Les taux de lipides (cholestérol total, HDL, LDL, triglycérides) doivent également être relevés et contrôlés 12 semaines plus tard ou conformément aux lignes directrices sur l’hyperlipidémie. En outre, les patients doivent être testés pour la tuberculose (TB) avant le début du traitement par baricitinib. Le baricitinib ne doit pas être utilisé en cas de tuberculose active. En cas de tuberculose latente non traitée auparavant, un traitement antituberculeux doit être envisagé avant d’instaurer le baricitinib. Si un patient développe une infection par herpès-zoster, le traitement par baricitinib doit être temporairement interrompu jusqu’à ce que l’infection ait disparu. Un dépistage de l’hépatite virale doit être effectué avant le début du traitement par baricitinib. Les patients dont l’infection par l’hépatite B ou l’hépatite C était avérée et active étaient exclus des études cliniques. Il est recommandé de mettre à jour toutes les immunisations avant le traitement par baricitinib, conformément aux recommandations de vaccination en vigueur. L’utilisation de vaccins vivants atténués n’est pas recommandée pendant ou juste avant un traitement par baricitinib.
L‘upadacitinib est un inhibiteur de Janus kinase biodisponible par voie perorale, sélectif et réversible, qui inhibe principalement JAK1. En Suisse, l’upadacitinib (Rinvoq®) est autorisé depuis novembre 2021 pour le traitement de la MA modérée à sévère chez l’adulte [52]. La dose orale recommandée d’upadacitinib est de 15 mg une fois par jour.
Preuves d’efficacité dans les études de phase III : l’efficacité de l’upadacitinib dans la MA a été évaluée dans les études de phase III MEASURE Up-1, MEASURE Up-2 et AD Up, avec un total de 2584 patients inclus dans le programme d’étude. Dans les trois études, les participants ont reçu 15 mg ou 30 mg d’upadacitinib ou un placebo une fois par jour pendant 16 semaines et une amélioration significative des scores SCORAD et EASI a été démontrée par rapport au placebo. (Fig. 4). Une amélioration plus rapide de l’apparence de la peau et des démangeaisons a également été obtenue. [52].
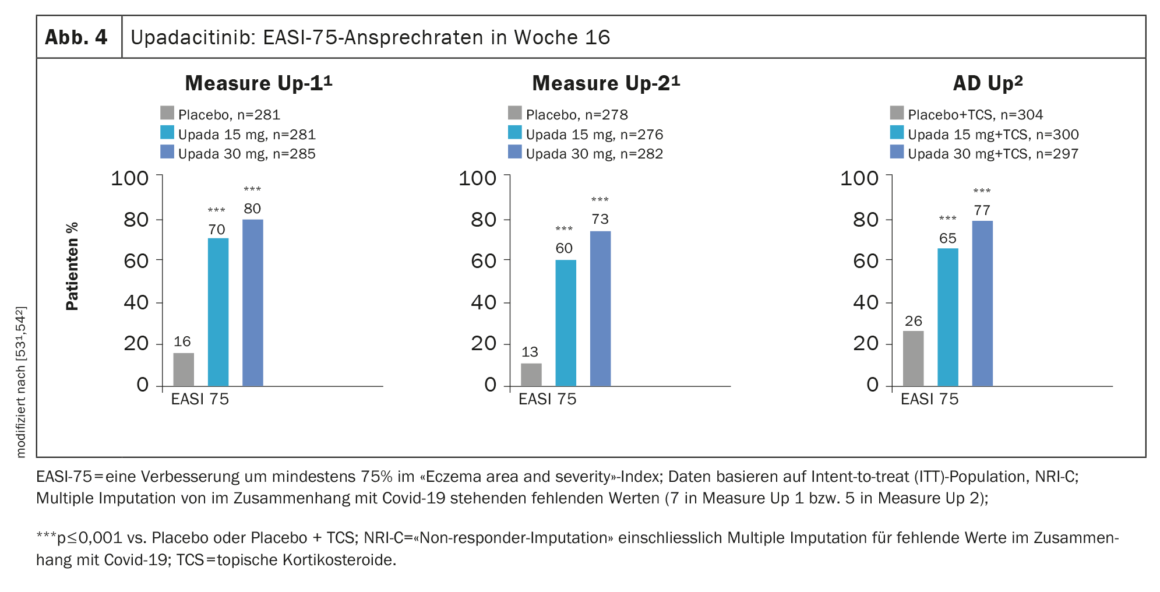
Dans MEASURE Up-1 et -2, l’upadacitinib a été évalué en monothérapie dans la MA modérée à sévère sur un panel de 1683 patients au total. Après 16 semaines, plus de 40% des patients sous upadacitinib 15 mg (1×/j) ont obtenu une réponse EASI 90 et un soulagement significatif du prurit, alors que dans les groupes placebo, ces deux résultats n’ont été observés que chez environ un patient sur dix [53,54]. Dans une analyse intégrée des deux études Measure Up-1 et-2, 62% des patients sous upadacitinib ont présenté une réponse EASI-90 et 65% une amélioration significative du prurit à la semaine 52. [55]. Une réponse EASI-75 a été obtenue par environ 80% [55]. De plus, le traitement par upadacitinib s’est accompagné d’une réponse rapide : une amélioration du prurit a été observée dès 2 jours [53].
Profil de sécurité : le profil des effets secondaires de l’upadacitinib est similaire à celui des autres inhibiteurs de JAK. Les infections des voies respiratoires supérieures et l’acné sont les plus fréquentes, l’herpès simplex, les maux de tête et l’augmentation de la créatine phosphokinase dans le sang sont moins fréquents [52].
Contre-indications : L’upadacitinb est contre-indiqué pendant la grossesse, les femmes en âge de procréer doivent utiliser des méthodes de contraception fiables aussi bien pendant le traitement que jusqu’à quatre semaines après la dernière dose d’upadacitinib. Il est recommandé de ne pas utiliser l’upadacitinib chez les patients ayant un nombre absolu de lymphocytes inférieur à 500 cellules/mm3, un nombre absolu de neutrophiles inférieur à 1000 cellules/mm3 ou un taux d’hémoglobine inférieur à 8 g/dl [24].
Aucun ajustement de la dose n’est nécessaire chez les patients présentant un trouble léger ou modéré de la fonction hépatique. L’utilisation d’upadacitinib n’est pas recommandée en cas de dysfonctionnement hépatique sévère (Child-Pugh C). L’insuffisance rénale n’a pas d’effet cliniquement significatif sur l’exposition à l’upadacitinib [52].
Suivi du traitement et précautions : Un dépistage de la tuberculose (TB) doit être effectué avant le début du traitement par upadacitinib. L’upadacitinib ne doit pas être utilisé chez les patients atteints de tuberculose active. Chez les patients atteints de tuberculose latente non traitée, un traitement antituberculeux doit être envisagé avant l’instauration du traitement par upadacitinib. Si un patient présente un zona, il faut envisager d’interrompre le traitement par upadacitinib jusqu’à la disparition de l’infection. Avant le début et pendant le traitement par upadacitinib, il convient de procéder à un dépistage de l’hépatite virale et de surveiller une éventuelle réactivation. Les patients ayant obtenu un résultat positif au test de détection des anticorps contre l’hépatite C et de l’ARN du virus de l’hépatite C ont été exclus des études cliniques.
Avant l’instauration du traitement par upadacitinib, il est recommandé de vérifier le statut vaccinal des patients conformément aux lignes directrices actuelles en matière de vaccination et d’effectuer les rappels de tous les vaccins requis. L’utilisation de vaccins vivants atténués pendant ou juste avant un traitement par upadacitinib n’est pas recommandée [52].
L’abrocitinib est un inhibiteur sélectif des JAK-1 par voie orale. En Suisse, l’abrocitinib (Cibinqo®) est autorisé depuis avril 2022 pour le traitement de la dermatite atopique chez l’adulte [24].
Preuves d’efficacité dans des études de phase III : l’efficacité et la sécurité de l’abrocitinib en monothérapie et en association avec des traitements de fond contenant le principe actif et appliqués par voie topique sur une période de 12 à 16 semaines ont été évaluées chez 1616 patients dans les études de phase III contrôlées par placebo MONO-1, MONO-2 et COMPARE. Dans l’étude pivot REGIMEN, l’abrocitinib a été étudié pendant 52 semaines sur un total de 1 233 participants [56].
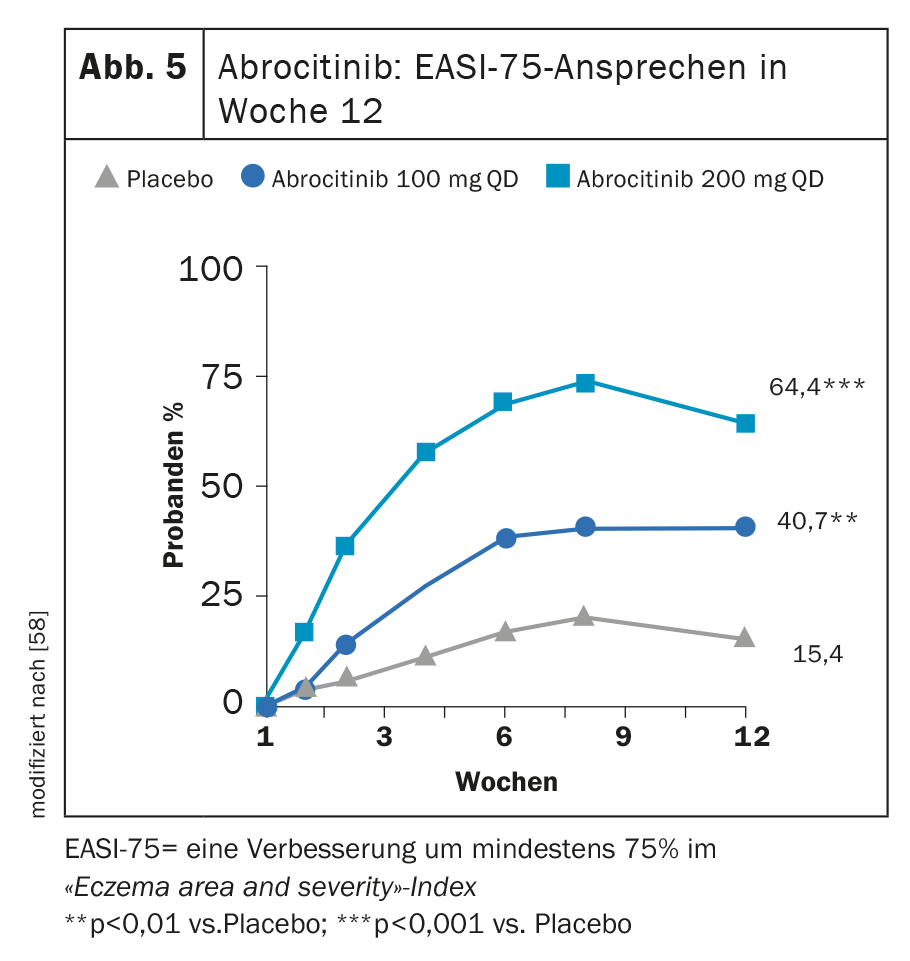
Dans MONO-1 et MONO-2, les deux critères d’évaluation primaires IGA 0 ou 1 et/ou EASI-75 ont été atteints à la semaine 12 chez une proportion significativement plus élevée de patients traités par abrocitinib 100 mg (1× d) ( figure 5) [24]. Dans l’étude COMPARE, l’inhibiteur JAK associé aux TCS s’est avéré significativement supérieur au placebo à la semaine 16 pour ces deux critères d’évaluation. Une réduction du prurit de ≥4 points sur le NRS du prurit s’est manifestée dès la semaine 2 chez une proportion significativement plus élevée de participants à l’étude sous abrocitinib par rapport au placebo. [57]. À la dose élevée de 200 mg, 43,8% des patients ont présenté une amélioration de l’IGA et 64,6% un EASI-75 après 12 semaines dans une étude de phase IIb [58].
Profil de sécurité : les effets indésirables les plus fréquemment signalés sont les nausées, les maux de tête, l’acné, l’herpès simplex, l’augmentation de la créatine phosphokinase dans le sang, les vomissements, les vertiges et les douleurs abdominales supérieures. Les effets indésirables graves les plus fréquents (0,3%) sont des infections [56].
Contre-indications : L’abrocitinib est contre-indiqué pendant la grossesse. Les femmes en âge de procréer doivent être informées de la nécessité d’utiliser une contraception efficace pendant le traitement et pendant un mois après l’arrêt de la prise per os d’upadacitinib. L’abrocitinib est contre-indiqué en cas de dysfonctionnement hépatique sévère (classe C de Child-Pugh). Aucun ajustement de la dose n’est nécessaire en cas de dysfonctionnement rénal léger. En cas de dysfonctionnement rénal modéré (eGFR 30 ml/min à <60 ml/min ou eGFR <30 ml/min), une réduction de la dose doit être effectuée conformément à l’information professionnelle du médicament [56].
Suivi du traitement et précautions : Les patients doivent être testés pour la tuberculose (TB) avant le début du traitement par abrocitinib. L’abrocitinib ne doit pas être administré aux patients atteints de tuberculose active. Chez les patients atteints de tuberculose latente non traitée, un traitement préventif de la tuberculose latente doit être initié avant l’introduction du traitement.
Si un patient développe une infection par herpès-zoster, il faut envisager d’interrompre temporairement le traitement par abrocitinib jusqu’à ce que l’infection ait disparu. Avant le début et pendant le traitement, un dépistage de l’hépatite virale doit être effectué conformément aux directives cliniques. Les patients dont l’infection par l’hépatite B ou l’hépatite C était avérée et active étaient exclus des études cliniques. En outre, il est recommandé de mettre à jour toutes les immunisations conformément aux recommandations de vaccination en vigueur avant de commencer un traitement par abrocitinib. L’utilisation de vaccins vivants atténués doit être évitée pendant ou juste avant le traitement par abrocitinib [56].
D’autres molécules prometteuses sont dans le pipeline
Parmi les autres substances actives actuellement étudiées pour une utilisation dans la MA, on trouve [2] :
- Lebrikizumab : anticorps monoclonal qui se lie spécifiquement à l’IL-13 circulant librement. En plus des deux études de phase III en monothérapie ADvocate 1 et 2, ADhere étudie la combinaison du lébrikizumab avec le TCS [62].
- Némolizumab : anticorps monoclonal qui bloque la sous-unité α du récepteur de l’IL-31. Les données des études menées à ce jour démontrent notamment un fort soulagement des démangeaisons [63]. Dans une étude randomisée de 16 semaines avec randomisation 2:1, le groupe némolizumab (n=143) a montré un pourcentage moyen de variation du score EVA de -42,8% à la semaine 16 contre -21,4% pour le placebo (n=72) [64].
- Tezepelumab : anticorps dirigé contre la TSLP (Thymic stromal lymphoprotein). La TSLP est une cytokine dérivée des cellules épithéliales qui est particulièrement associée aux démangeaisons dans la MA [65]. Dans l’étude de phase IIa ALLEVIAD, à la semaine 12, le pourcentage moyen d’amélioration du pic de prurit NRS tezelumab plus TCS vs placebo était de 33,54 (SD 6,02) vs 25,41 (SD 6,06) ; p=0,258) [68].
- Anticorps anti-Ox-40 : Ox-40 est un récepteur costimulateur sur les lymphocytes T activés [65]. Dans une étude de phase IIa randomisée, en double aveugle et contrôlée par placebo, l’administration de l’anticorps anti Ox-40 à des intervalles de 4 semaines a entraîné des améliorations cliniques significatives jusqu’au jour 71 [70].
- Brepocitinib : inhibiteur topique de TYK2/JAK1
- Modulateurs des récepteurs arylhydrocarbonés : système de récepteurs cytoplasmiques qui affectent le mécanisme de l’inflammation et les molécules de la barrière.
Messages Take-Home
- De nouvelles thérapies sous forme d’anticorps spécifiques et de ce que l’on appelle les petites molécules ont ouvert une nouvelle ère. L’interleukine (IL-)4 et l’IL-13 sont les deux principales cytokines pro-inflammatoires dans la MA. En outre, il existe d’autres médiateurs de l’inflammation qui jouent un rôle.
- Les médicaments biologiques interviennent dans le processus inflammatoire de la MA en ciblant certaines cytokines. Les inhibiteurs JAK, en revanche, sont des agents de faible poids moléculaire qui agissent en inhibant la voie de signalisation JAK/STAT.
- Lorsqu’une cytokine se lie au domaine extracellulaire de son récepteur, les Janus kinases activent des facteurs de transcription intracellulaires qui contrôlent la lecture d’un grand nombre de gènes dans le noyau cellulaire [1].
- Les principales différences entre les médicaments systémiques modernes très efficaces concernent la forme galénique, la fréquence d’utilisation, le profil d’effets secondaires et le suivi du traitement. Dans l’esprit de la médecine personnalisée, il s’agit de plus en plus de choisir le médicament le mieux adapté aux caractéristiques de la maladie et à d’autres caractéristiques liées à la personne et au contexte.
Littérature :
- Lauffer F, Biedermann T : Dtsch Arztebl 2021 ; 118(24) : [24]; DOI : 10.3238/PersDerma.2021.06.18.04
- “Dermatite atopique, quoi de neuf ?”, professeur universitaire Dr Paul-Gunther Sator, DermAlpin Salzburg, 30-31.10.2021
- Deutsche Haut- und Allergiehilfe e.V., www.dha-neurodermitis.de/therapie/grundlagen-der-therapie.html,(dernière consultation, 06.01.2023)
- Scoring de la sévérité de la dermatite atopique : l’indice SCORAD. Dermatologie 1993 ; 186(1) : 23-31.
- Nygaard U, Deleuran M, Vestergaard C : Dermatology 2017 ; 233 : 333-343.
- AWMF : Ligne directrice sur la dermatite atopique, numéro d’enregistrement 013-027, classification S2k Date : 31.03.2015.
- Étude de la littérature DFP : Dermatite atopique, www.oeadf.at/files/E-Learning/ClinicumDerma_12_032017.pdf,(dernière consultation 06.01.2023)
- .Leung DYM, Guttman-Yassky E : J Allergy Clin Immunol 2014 ; 134 : 769-779.
- Kim BE, Leung DY, Boguniewicz M, Howell MDl : Clin Immunol 2008 ; 126 : 332-337.
- Akdis CA, et al : Allergy 2020 ; 75(7) : 1582-1605.
- Hoffjan S, Stemmer S : Arch Dermatol Res 2015 ; 307 : 659-670.
- Darsow U, et al : J Eur Acad Dermatol Venereol 2010 ; 24 : 317-328.
- Williams MR, Gallo RL : Curr Allergy Asthma Rep 2015 ; 15 : 65.
- Nguyen JK, et al : Arch Dermatol Res 2020 ; 312(2) : 81-92.
- Weidinger S, et al. : Nat Rev Dis Primers 2018 ; 4(1) : 2.
- Clark JD, et al : J Med Chem 2014 ; 57 : 5023-5038.
- Howell MD, et al : Front Immunol 2019 ; 10 : 2342.
- Chiesa Fuxench ZC, Ong P : Poster présenté à l’AAD 2018. Affiche 6236.
- Drucker AM, et al. : J Invest Dermatol 2017 ; 137(1) : 26-30.
- Ronnstad ATM, et al : JAAD 2018 ; 79 : 448-456.
- Reich K, et al : International Society of Atopic Dermatitis 2021.
- Brunner PM, et al : J Invest Dermatol 2017 ; 137 : 18-25.
- Silverberg JI : Ann Allergy Asthma Immunol 2019 ; 123(2) : 144-151.
- Information professionnelle, www.swissmedicinfo.ch, (dernière consultation 06.01.2022)
- 25 Silverberg J : Clin Dermatol 2017 ; 35 : 360-366.
- Simpson EL, et al : N Engl J Med 2016 ; 375 : 2335-2348.
- Paller AS et al : J Am Acad Dermatol. 2016;75(3) : 494-503.
- Blauvelt A, et al : The Lancet 2017 ; 389(10086) : 2287-2303.
- Simpson EL, et al. Late-breaking abstract, EADV 2016 abstract D3T01.1C.
- de Bruin-Weller, M. et al : Br J Dermatol 2018 ; 178(5) : 1083-1101.
- Deleuran M et al : J Am Acad Dermatol 2020 ; 82(2) : 377-388.
- Simpson EL, et al : JAMA Dermatol 2020 ; 156(1) : 44-56.
- European Medicines Agency : Dupilumab, Product Information, https://ec.europa.eu/healthhttps://ec.europa.eu/health, dernière consultation 06/01/2023)
- Wollenberg A, et al : J Allergy Clin Immunol Pract. 2018 Sep-Oct ; 6(5) : 1778-1780.e1.
- Schmid-Grendelmeier P : Dermatologie Pratique 2021 ; 31(4) : 10-14.
- Wollenberg A, et al : JDDG 2021 ; 19(10) : 1435-1442.
- Silverberg JI, et al : Br J Dermatol 2021 ; 184 : 450-463.
- Petronelli M : Tralokinumab meets endpoints for all phase 3 studies, Dermatology Times, Dec 16, 2019, www.dermatologytimes.com, (dernière consultation 06.01.2023)
- Simpson E, et al. : Présentation à l’AAD VMX, 12-14 juin et à la demande, 2020, USA
- Wollenberg A, et al : Br J Dermatol 2021 ; 184(3) : 437-449.
- European Medicines Agency, Tralokinumab, Product Information,https://ec.europa.eu/healthhttps://ec.europa.eu/health, dernière consultation 06.01.2023)
- “Welt-Neurodermitis-Tag am 14. September Neurodermitis : Systemischwirkende Therapeutika verbessern Behandlung”, Berufsverband der Deutschen Dermatologen e.V. (BVVD), Berlin 03.09.2021.
- Futamura MJ : Am Acad Dermatol 2016 ; 74 : 288-294.
- Klein B, Treudler R, Simon JC : JDDG 2022 ; 20(1) : 19-25.
- Simpson EL, et al. Présenté à : 24th World Congress of Dermatology ; June 10-15, 2019 ; Milan, Italy.
- Melo A, Carrascosa JM, Torres T : J Dermatolog Treat 2021 Aug 23 : 1-10. Epub ahead of print.
- Wollenberg A, et al : JEADV 2021 ; 35(7) : 1543-1552.
- Reich K, et al : JAMA Dermatol 2020 ; 156(12) : 1333-1343.
- Silverberg JI, et al : JAMA Dermatol 2021, 157 : 691-699.
- European Medicines Agency : Baricitinib, Product Information, https://ec.europa.eu/health, dernière consultation 06/01/2023)
- 51. Radi G, et al. : Healthcare (Bâle) 2021 Nov 18 ; 9(11):1575. healthcare-09-01575-v2.pdf.
- European Medicines Agency : Upadacitinib, Product Information, https://ec.europa.eu/health, dernière consultation 06/01/2023)
- Guttman-Yassky E, et al : Lancet 2021 ; 397(10290) : 2151-2168.
- Reich K, et al : Lancet 2021 ; 397(10290) : 2169-2181.
- Simpson EL, et al. : Présentation à la réunion des ressources essentielles de la Fondation pour l’éducation en dermatologie (DEF) 2021 (DERM2021), 5-8 août 2021, Las Vegas NV
- Agence européenne des médicaments : Abrocitinib, Information sur le produit, https://ec.europa.eu/health/, (dernière consultation 06/01/2023)
- “Dermatite atopique : la voie JAK/STAT comme cible thérapeutique ” https://medizinonline.com/der-jakstat-signalweg-als-therapeutische-zielstruktur,(dernière consultation 16.02.2023)
- Gooderham MJ, et al : JAMA Dermatol 2019 ; 155(12) : 1371-1379.
- Guttman-Yassky E, et al : JAMA Dermatol 2020 ; 156(4) : 411-420.
- Moyle M, et al : Exp Dermatol 2019 ; 28(7) : 756-768.
- 61. Loh TY, et al : J Asthma Allergy 2020 ; 13 : 109-114.
- 62. “Eli Lilly Submit BLA for Lebrikizumab AD Treatment”,
www.dermatologytimes.com/view/eli-lilly-submits-bla-for-lebrikizumab-ad-treatment,(dernier appel 06.01.2023) - Ruzicka T, et al : N Engl J Med 2017 ; 376 : 826-835.
- Kabashima K, et al : N Engl J Med 2020 ; 383 : 141-150.
- 65. Quint T, Bangert C : à fleur de peau 2021 ; 20 : 37-44.
- 66. Ziegler SF, et al : Adv Pharmacol 2013 ; 66 : 129-155.
- Shikotra A, et al : J Allergy Clin Immunol 2012 ; 129 : 104-111.e1-9.
- Simpson EL, et al : J Am Acad Dermatol 2019 ; 80 : 1013-1021.
- Suga H, Sato S : Nouveaux traitements topiques et systémiques de la dermatite atopique. Immunol Med 2019 ; 42(2) : 84-93.
- Guttman-Yassky E, et al : J Allergy Clin Immunol 2019 ; 144(2) : 482-493.e487.
- Ami Y, et al : FEBS Lett 2012 ; 586 : 3410-3414.
- Dong C, et al : J Pharmacol Exp Ther 2016 ; 358 : 413-422.
- Jarnagin K, et al : J Drugs Dermatol 2016 ; 15(4) : 390-396.
- Zane LT, et al : Pediatr Dermatol 2016 : 33(4) : 380-387.
DERMATOLOGIE PRAXIS 2023 ; 30(1) : 5–11