La curiethérapie (BT) est une forme de radiothérapie dans laquelle une source radioactive est placée avec précision dans la tumeur ou dans le lit tumoral pendant une durée généralement courte. Elle est indiquée pour un large éventail d’entités tumorales. Le mode d’irradiation de haute précision se limite à la région à risque et permet d’administrer une dose élevée tout en préservant les tissus environnants.
La curiethérapie (BT) est une forme de radiothérapie dans laquelle une source radioactive est placée avec précision dans la tumeur ou dans le lit tumoral pendant une durée généralement courte. Elle est indiquée pour un large éventail d’entités tumorales [1]. La forte dose de radiation focale associée à une faible exposition des tissus sains environnants explique le succès du traitement. La première partie de cet article de synthèse a pour but d’expliquer les aspects physiques et pratiques généraux de la BT. La deuxième partie vise à mettre en lumière l’utilisation de la BT fondée sur des preuves pour les principales indications et le processus de traitement correspondant.
Terminologie
Le préfixe “brachy” vient du grec et signifie “court”, comme le rayonnement à courte portée qui caractérise cette forme de traitement. En France, on utilise le terme de “curiethérapie”, du nom de Marie et Pierre Curie, qui ont posé des jalons importants de la TB avec la découverte du radium et la proposition, vers 1901, d’introduire une source de rayonnement dans une tumeur. La BT doit être distinguée des thérapies par radionucléides de la médecine nucléaire (par exemple la thérapie au lutécium-PSMA) ; à la différence de ces formes de thérapie, la radio-oncologie utilise des sources fermées (et non ouvertes) et les applique de manière contrôlée localement (et non de manière systémique).
Irradiation “de l’intérieur vs. de l’extérieur” – BT vs. EBRT
Schématiquement, on peut distinguer deux formes d’application de dose en radio-oncologie ; l’irradiation percutanée (External-beam radiotherapy, EBRT) et la BT. Dans les techniques EBRT (comme la radiothérapie à modulation d’intensité, la radiothérapie stéréotaxique ou la protonthérapie), le faisceau thérapeutique est généré à l’extérieur du patient et l’appareil de radiothérapie peut être allumé et éteint. La BT consiste à introduire une source radioactive de quelques millimètres dans la tumeur ou le lit tumoral, généralement pour une courte durée. Dans ce cas, la source est active en continu, elle peut être rentrée ou sortie mais ne peut pas être activée ou désactivée. L’intensité du rayonnement diminue avec le temps en fonction de la décroissance naturelle du radionucléide choisi (pour l’iridium-192, la moitié de l’activité initiale est encore présente après environ 2,5 mois). Afin de maintenir le temps de traitement à un niveau bas, la clinique de l’iridium-192, par exemple, utilise un système d’injection de l’iridium dans le sang. un changement de source est effectué tous les 3-4 mois
En radiothérapie, les incertitudes liées au positionnement ou aux mouvements intrinsèques des organes sont compensées par une marge de sécurité supplémentaire, mesurant généralement 3 à 5 millimètres autour du volume de traitement souhaité (appelée “marge PTV”). Comme l’applicateur ou la source d’irradiation se déplace avec la tumeur (ou le lit) lors de la BT, cette marge de sécurité est supprimée – le volume d’irradiation est donc plus petit. L’influence de la marge de sécurité sur le volume total est bien illustrée par l’exemple souvent cité d’une orange [2]. Si l’on retire à une orange sa peau de quelques millimètres, son volume est divisé par deux (le volume de la sphère diminue à la puissance 3 du rayon). Dans le cas de la BT, il est possible de renoncer à la bordure de sécurité (c’est-à-dire à la “peau d’orange”), ce qui permet de limiter le volume d’irradiation à la région réellement à risque.
Formes de BT
Selon le type d’application choisi, l’instrumentation utilisée ou le débit de dose, la BT peut être classée différemment. En fonction de l’emplacement du tissu tumoral qui doit être recouvert par l’applicateur, on distingue la curiethérapie de contact, la BT intracavitaire et la BT interstitielle :
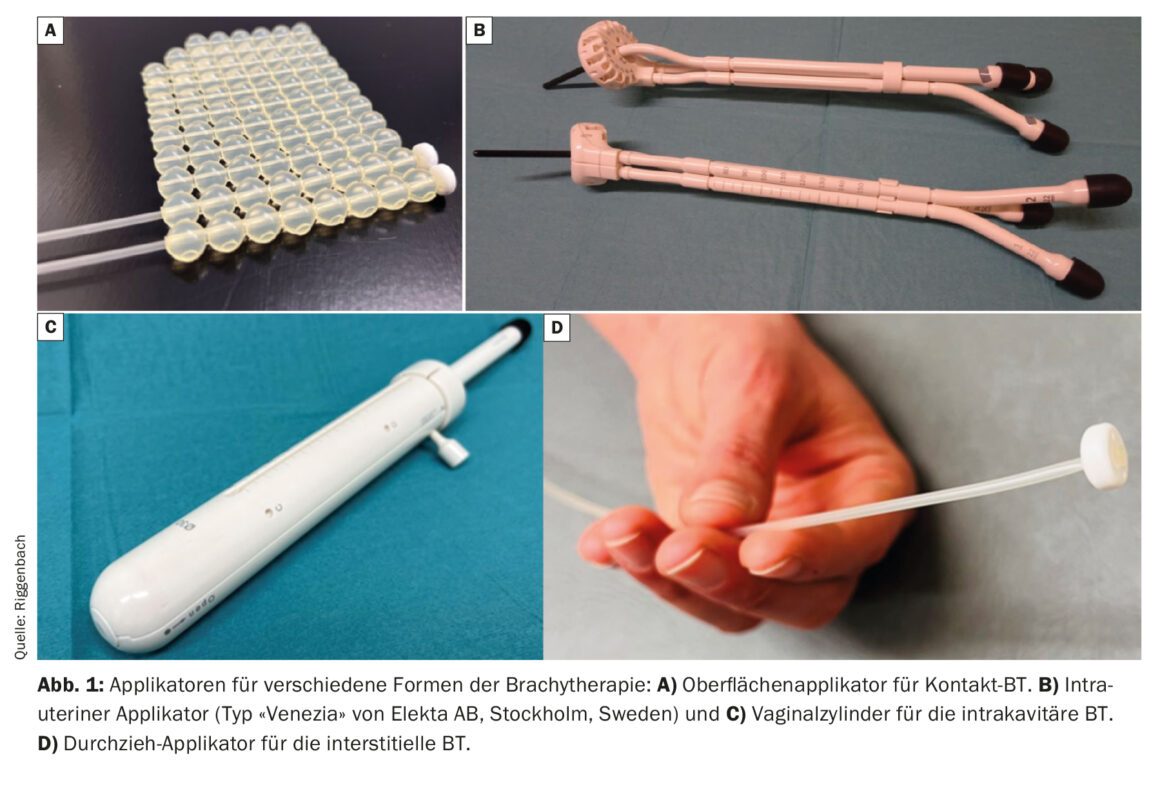
La curiethérapie de contact permet de fixer des moulages personnalisés à la peau. Des cathéters sont intégrés dans ces moulages, espacés d’environ 1 cm et situés à environ 5 mm de la peau [3]. La radiothérapie peropératoire constitue une forme particulière de thérapie de contact ; dans ce cas, le site opératoire d’où la tumeur a été préalablement réséquée peut être traité comme une surface portant encore la tumeur au microscope (fig. 1) [4,5].
Dans le cas de la BT intracavitaire, la source de rayonnement est amenée à proximité du volume cible via des cavités naturelles du corps. Les indications fréquentes sont les tumeurs de l’appareil génital féminin (mise en place d’un cylindre vaginal pour le traitement du dôme vaginal dans le cas d’un cancer de l’endomètre opéré ou mise en place d’un applicateur intra-utérin dans le cas d’une radiothérapie définitive du cancer du col de l’utérus) [6,7]. Il existe des applicateurs spéciaux de différents diamètres et longueurs pour les BT des cavités allongées (œsophage [8], bronches, nasopharynx ou rectum).
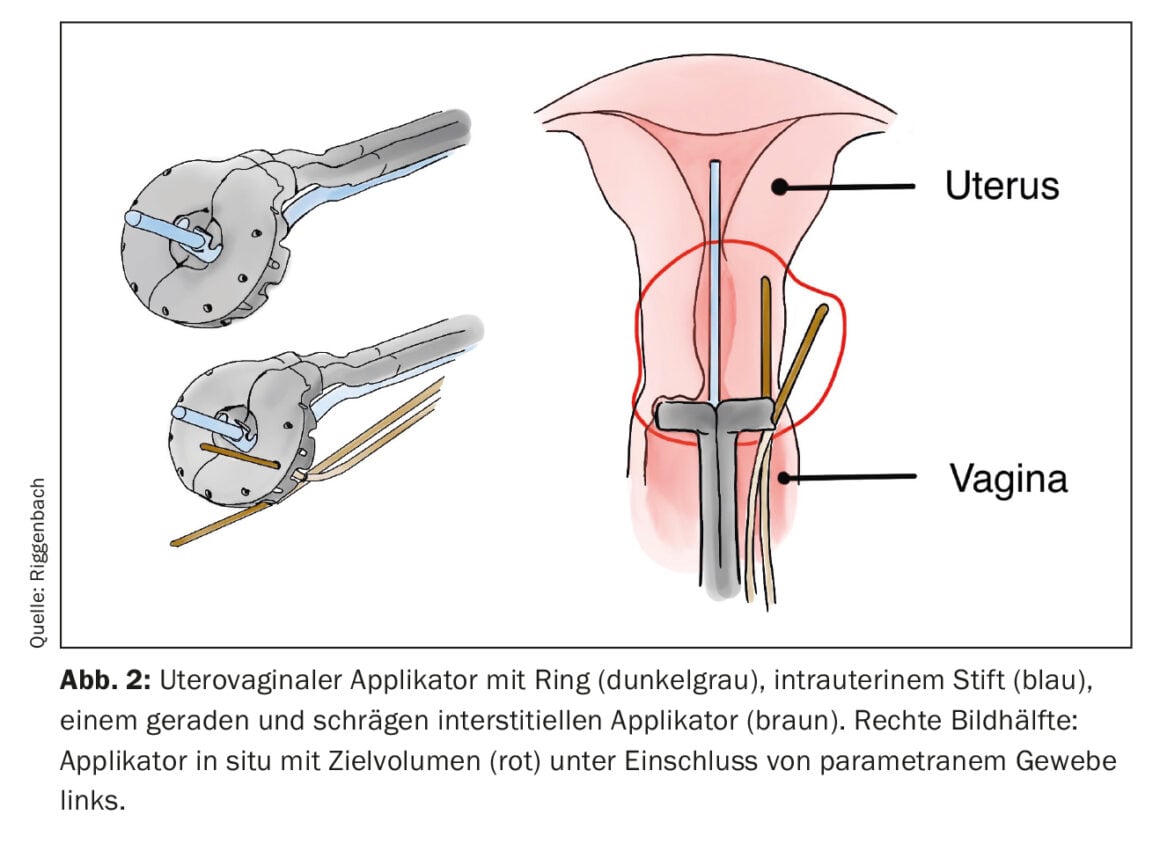
Si la région cible à traiter est plus éloignée de la peau ou de la muqueuse, ou si la tumeur dépasse une certaine épaisseur, la BT interstitielle est plus appropriée. Pour ce faire, des tubes en plastique souple sont introduits directement dans la tumeur ou le lit tumoral via des guides en métal ou en plastique rigide (c’est ce qu’on appelle l’embrochage). Des exemples fréquents d’utilisation de la BT interstitielle sont l’irradiation partielle du sein ou le traitement supplémentaire du parametrium via des aiguilles interstitielles en cas de cancer du col de l’utérus. Avec une disposition parallèle et équidistante des applicateurs insérés de manière interstitielle, il est possible d’obtenir une distribution de dose plus homogène. Pour obtenir une disposition régulière, il est possible d’utiliser des dispositifs de perforation industriels (par ex. à la surface de l’anneau des applicateurs utéro-vaginaux) (Fig. 2). Il est également possible de procéder à l’insertion à main levée en s’aidant de l’imagerie.
On peut distinguer l’irradiation continue à long terme (LDR, low-dose rate BT) de l’irradiation fractionnée à court terme (HDR, high-dose rate BT) en fonction du débit de dose (nombre de Gray par temps). Elle détermine le radionucléide choisi. La LDR-BT, qui est encore essentiellement utilisée pour le traitement de la prostate, utilise généralement l’iode-125 comme source radioactive. Des graines d’iode 125 encapsulées sont placées de manière permanente dans le tissu interstitiel.
Pour le HDR-BT temporaire, l’émetteur le plus souvent utilisé est l’iridium-192. Grâce au débit de dose élevé, la source dépose la dose souhaitée dans la tumeur (ou le lit) en peu de temps et est retirée juste après. Pour que l’insertion et l’extraction puissent se faire à la seconde et au millimètre près, il faut d’abord placer un applicateur, une aiguille ou un cathéter dans la cavité duquel la source peut être introduite lors de la procédure de rechargement (afterloading).
Une forme particulière de BT HDR est le BT PDR (pulsed dose rate), dans lequel une impulsion thérapeutique est généralement émise toutes les heures par une source HDR, par exemple par le biais d’un appareil de radiographie. une semaine de traitement en milieu hospitalier. Bien que favorable du point de vue de la biologie tumorale, la PDR est de plus en plus remplacée par la HDR-BT au niveau international pour des raisons logistiques et n’est actuellement proposée dans aucun centre en Suisse non plus.
Principes physiques
La raison physique pour laquelle les rayonnements utilisés dans la BT sont dits à courte portée est la loi de la distance quadratique – si la distance à la source est doublée, la dose est réduite d’un quart. Étant donné que dans la BT, la source se trouve juste à côté de la zone à irradier (la distance est donc petite), cette loi a beaucoup plus de poids que dans le cas de l’irradiation percutanée sur l’accélérateur linéaire (où la distance entre la tumeur et la “source” ou la tête de l’accélérateur est typiquement d’environ un mètre). En augmentant la distance de 1 cm à 2 cm ou 3 cm, la dose diminue de 75% et 90% respectivement pour la BT, alors qu’elle ne diminue que de quelques pourcents pour la thérapie percutanée. Bien entendu, dans le cas de l’irradiation percutanée, il faudrait tenir compte de nombreux autres facteurs, tels que l’atténuation du rayonnement par les tissus, pour pouvoir expliquer la répartition réelle de la dose. En revanche, pour la BT, la loi des carrés de distance représente la plus grande contribution à la dose, en particulier à proximité de la source. La dose diminue donc très rapidement dans le cas de la BT, le gradient de dose est abrupt, ce qui entraîne d’une part des pics de dose très élevés à proximité immédiate de la source ou de la tumeur, et d’autre part une faible exposition des organes à risque environnants.
Déroulement pratique d’une curiethérapie HDR
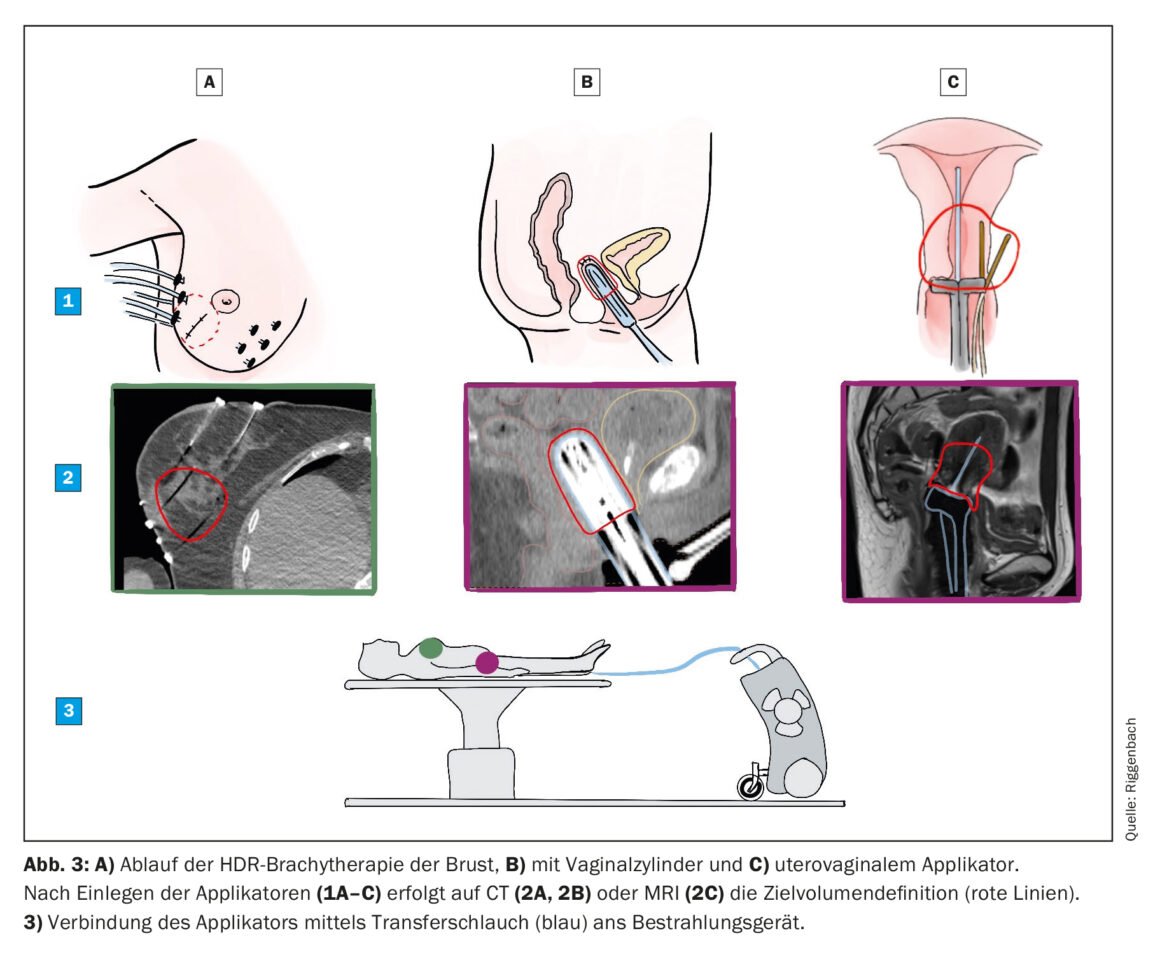
Pour des raisons de logistique et de radioprotection, la plupart des traitements de BT sont aujourd’hui réalisés en rechargement. Pour ce faire, un applicateur inactif est d’abord inséré de manière non irradiante. Chaque applicateur est doté d’une cavité à travers laquelle la source de rayonnement est passée lors d’une étape ultérieure. La source d’iridium 192 a à peu près la taille d’un grain de riz et est fixée au bout d’un fil fin stocké dans un coffre-fort mobile. Après la mise en place de l’applicateur, un scanner et/ou une IRM est réalisé(e) sur lequel/laquelle le volume cible et les organes à risque sont dessinés. Le physicien médical est donc responsable de l’élaboration du plan d’irradiation. La position de la source (dans la longueur de l’applicateur) et le temps d’irradiation à chaque position peuvent être choisis librement et sont optimisés par le logiciel de planification. Une fois les objectifs atteints, le plan d’irradiation est envoyé à la console d’irradiation, le patient est accompagné dans la salle de traitement et l’applicateur qui s’y trouve est relié au coffre-fort (figure 3). Le traitement est lancé et contrôlé à distance depuis la salle voisine. Elle ne dure que quelques minutes, après quoi la source de rayonnement est automatiquement rétractée dans le coffre-fort et l’applicateur retiré.
Défis et perspectives
La complexité de la curiethérapie ne réside pas dans la technique, mais dans les compétences manuelles de l’insertion et dans l’interaction entre les professionnels de la radio-oncologie et de l’interdisciplinarité. Elle nécessite beaucoup de personnel, mais reste rentable grâce à sa technique simple, ce qui lui vaut d’être très prisée dans les pays à faibles ressources. Avec plus de 100 ans d’expérience, il s’agit de l’une des options de traitement les plus anciennes en oncologie, ce qui lui vaut parfois d’être considéré comme historique ou obsolète. La curiethérapie actuelle, avec ses applicateurs modernes, sa pose guidée par l’image et son optimisation de la dose par logiciel, a mis en œuvre les progrès de la médecine et s’intègre parfaitement dans les approches de la “médecine individualisée”. Comme toutes les modalités de radiothérapie, elle permet de préserver les organes, mais son approche peu invasive, l’implémentation moderne des images et son utilisation à grande échelle nécessitent une équipe d’experts dédiée et interdisciplinaire.
Messages Take-Home
- La curiethérapie est une forme de traitement de haute précision dans laquelle
le volume d’irradiation est limité à la région à risque réel. - Le gradient de dose abrupt permet d’obtenir une dose élevée dans la région cible tout en préservant au mieux les tissus environnants.
- Elle peut être appliquée sur la surface (BT de contact), dans une cavité du corps (BT intracavitaire) ou dans les tissus (BT interstitielle).
- L’utilisation la plus courante est le HDR-BT temporaire, où une dose élevée de
est appliqué en quelques séances par rechargement. - La large utilisation de la curiethérapie en fait une technique interdisciplinaire.
Forme de traitement.
Littérature :
- Chargari C, Deutsch E, Blanchard P, et al : Brachytherapy : An overview for clinicians. CA Cancer J Clin 2019 ; 69(5) : 386-401.
- Verellen D, Ridder M De, Linthout N, et al : Innovations in image-guided radiotherapy. Nat Rev Cancer 2007;7(12) : 949-960.
- Guinot JL, Rembielak A, Perez-Calatayud J, et al : GEC-ESTRO ACROP recommendations in skin brachytherapy. Radiother Oncol 2018 ; 126(3) : 377-385.
- Roeder F, Krempien R : Radiothérapie peropératoire (IORT) dans le sarcome des tissus mous. Radiat Oncol 2017.
- Tom MC, Joshi N, Vicini F, et al : The American Brachytherapy Society consensus statement on peroperative radiation therapy. Brachytherapy 2019;18(3) : 242-257.
- Harkenrider MM, Block AM, Alektiar KM, et al : American Brachytherapy Task Group Report : Adjuvant vaginal brachytherapy for early-stage endometrial cancer : A comprehensive review. Brachytherapy 2017 ; 16(1) : 95-108.
- Schmid MP, Fokdal L, Westerveld H, et al : Recommendations from gynaecological (GYN) GEC-ESTRO working group – ACROP : Target concept for image guided adaptive brachytherapy in primary vaginal cancer. Radiother Oncol 2020;145 : 36-44.
- Rovirosa Á, Tagliaferri L, Chicheł A, et al. : Pourquoi une technique très simple, utile et ancienne est-elle sous-utilisée ? An overview of esophageal brachytherapy – interventional radiotherapy. J Contemp Brachytherapy 2022;14(3) : 299-309.
InFo ONKOLOGIE & HÉMATOLOGIE 2023 ; 11(2) : 6-9