Les patients atteints d’AOPV asymptomatiques et symptomatiques présentent tous deux un risque cardiovasculaire accru. Un diagnostic, une prévention et un traitement précoces sont donc essentiels. Les recommandations de l’ European Society of Cardiology (ESC) ont été mises à jour en 2024. Depuis peu, l’AOMI fait office de sous-chapitre d’un document d’orientation complet sur les maladies artérielles et aortiques périphériques (PAAD).
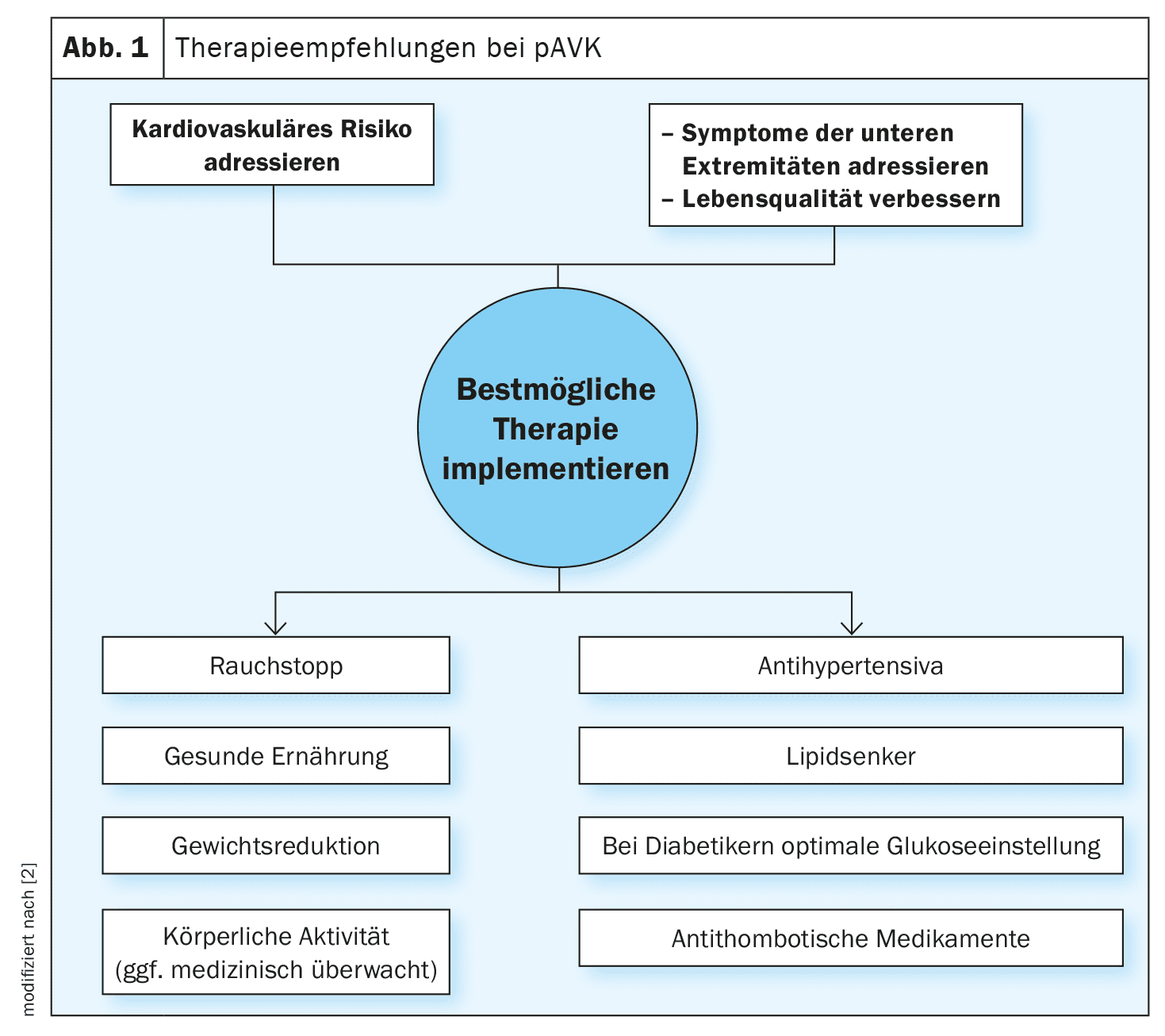
La prévalence mondiale des maladies artérielles et aortiques périphériques (PAAD) est de 1,5% et augmente avec l’âge, touchant 15 à 20% des personnes de plus de 70 ans et 20 à 30% des personnes de plus de 80 ans [1,2]. Les patients atteints de maladies aortiques présentent un risque accru de maladies vasculaires périphériques et vice versa. Une proportion importante de patients étant asymptomatiques, il est essentiel de procéder à un dépistage du PAAD sur la base de facteurs de risque tels que l’âge, les antécédents familiaux et d’autres facteurs prédisposants. Le diagnostic de PAAD peut être établi au moyen d’un test vasculaire non interventionnel ou d’une imagerie. Les lignes directrices (encadré) soulignent que la prise en charge de l’hypertension, de l’hyperlipidémie et du diabète est essentielle pour prévenir les complications graves. Selon les cas, outre les facteurs liés au mode de vie, des interventions médicamenteuses (p. ex. traitement hypolipémiant/hypertenseur/antidiabétique/antithrombotique) peuvent être indiquées pour prévenir les complications. Le LDL-C (cholestérol à lipoprotéines de basse densité) est un facteur clé de l’athérosclérose, le diabète et le tabac multipliant par 2 à 4 le risque d’AOP. Environ 20 à 30 % des diabétiques présentent une AOPV [3,21].
| La nouvelle ligne directrice de l’ESC sur le PAAD met l’accent sur une approche holistique L’intégration des recommandations sur la prise en charge des maladies artérielles et aortiques périphériques (PAAD) dans un seul document de guidance vise à refléter le fait que l’aorte et les artères périphériques font partie intégrante du même système artériel. La Société européenne de cardiologie (ESC) a maintenant introduit cette mise à jour car des progrès considérables ont été réalisés dans la compréhension et le traitement du PAAD depuis la publication des guides respectifs en 2014 et 2017. Les principales recommandations de la ligne directrice publiée en 2024 concernent le caractère chronique du PAAD, l’importance du dépistage précoce et la nécessité de stratégies de traitement globales. L’objectif est de mettre en place un traitement cohérent et coordonné pour les différentes maladies vasculaires, ce qui devrait permettre de réduire la fragmentation et d’améliorer les résultats globaux du traitement. |
| vers [1,2] |
L’indice cheville-bras est significatif
Le guide précise que la “maladie artérielle périphérique” (MAP), ou “artériopathie oblitérante périphérique” (AOP), fait uniquement référence à la maladie athérosclérotique des membres inférieurs. “Les patients atteints d’AOPV ont le plus grand risque de subir des événements cardiovasculaires”, a expliqué le professeur Thomas Zeller, du Centre cardiaque universitaire de Fribourg-Bad Krozingen (Allemagne) [3]. L’APVP peut être symptomatique ou asymptomatique et être associée ou non à des plaies aux membres. Tous les patients atteints d’APVP présentent un risque élevé d’événement cardiaque majeur (MACE) et de maladie cérébrovasculaire. L’incidence cumulée sur 5 ans de la mortalité cardiovasculaire est de 9% chez les patients atteints d’AOPV asymptomatiques et de 13% chez les patients symptomatiques. L’indice cheville-bras (ankle-brachial-index, ABI) est le premier test diagnostique non invasif proposé pour confirmer un statut circulatoire réduit des membres inférieurs et doit être indiqué séparément pour chaque jambe. Un ABI ≤0,90 confirme le diagnostic de l’AOPV.
Le dépistage des maladies coronariennes est obligatoire
Outre l’évaluation de la perfusion des extrémités, l’ABI sert de marqueur de substitution pour la mortalité cardiovasculaire et totale. La douleur à la marche, qui s’atténue au repos, est un symptôme typique de l’AOPV. L’évaluation de la difficulté à marcher et de l’état fonctionnel est obligatoire. Et tous les patients atteints d’AOPV doivent être dépistés pour la présence d’une maladie coronarienne. “Le dépistage de la maladie coronarienne est essentiel chez ces patients”, a déclaré le professeur Zeller [3]. L’échographie duplex permet de distinguer les lésions athéroscléreuses (même subcliniques) des lésions non athéroscléreuses. Le cardio-CT est considéré comme la principale technique d’imagerie pour le diagnostic, le pronostic et la planification du traitement des maladies aortiques (pour un syndrome aortique aigu, la sensibilité est de 100% et la spécificité de 98%). L’IRM cardiaque est utile pour une évaluation complète de l’aorte, y compris la forme, le diamètre et les caractéristiques des tissus. Chez les patients atteints d’AOP et souffrant de diabète et/ou d’infection, il faut garder à l’esprit que la cicatrisation des plaies peut être compromise, ce qui est associé à un risque accru d’amputation. Le risque d’amputation doit donc être systématiquement évalué chez ces patients en utilisant la classification des plaies, des ischémies et des infections du pied.
Entraînement à la marche structuré recommandé
Un document de consensus sur l’activité physique et l’APVP a récemment été publié dans l’European Heart Journal [15]. L’activité physique est une mesure importante du mode de vie dans l’APVP pour améliorer les symptômes et promouvoir la qualité de vie. Des améliorations de la distance de marche de six minutes (6MWD), ainsi que de la qualité de vie liée à la santé (HRQoL) et de la condition cardiorespiratoire ont été démontrées chez des patients souffrant d’une AOPV symptomatique. Le mieux est de pratiquer régulièrement la marche, éventuellement en groupe sous la direction d’un spécialiste, a expliqué l’orateur [3]. En cas de “claudication intermittente”, un entraînement structuré à la marche de 30 à 60 minutes trois fois par semaine a fait ses preuves. Les patients symptomatiques doivent subir un examen médical avant de commencer l’entraînement et, si possible, suivre des séances d’entraînement sous surveillance médicale. En outre, il est recommandé aux fumeurs d’arrêter de fumer et aux hypertendus de réduire leur tension artérielle. Chez la plupart des adultes, il faut viser une valeur systolique cible de 120-129 mm Hg si le traitement s’avère bien toléré. Si cette valeur cible ne semble pas pouvoir être atteinte, le principe ALARA (“As Low As Reasonably Achievable”) peut être mis en œuvre. L’utilisation d’inhibiteurs de l’ECA ou d’antagonistes des récepteurs de l’angiotensine (ARA) en première ligne fait l’objet d’une recommandation IIa. En ce qui concerne la gestion des lipides, la ligne directrice actuelle conseille de viser si possible un taux de cholestérol LDL <55 mg/dl (1,4 mmol/l).
Envisager un traitement antithrombotique en cas d’AOPV symptomatique
Chez les patients atteints d’AOP symptomatique, un traitement antithrombotique améliore le pronostic cardiovasculaire [4–8]. Pour ces patients, il existe une recommandation de classe Ia pour un traitement antiplaquettaire par aspirine (75-160 mg, 1×/jour) ou clopidogrel (75 mg, 1×/jour) afin de réduire le risque de MACE [4–6]. Des études indiquent que le clopidogrel peut présenter un avantage modeste par rapport à l’aspirine [9,10]. Dans l’étude EUCLID (Examining Use of tiCagreLor In peripheral artery Disease) , une monothérapie antithrombotique par ticagrelor n’a pas montré de bénéfice supérieur à celui du clopidogrel en termes de réduction des MACE ou des événements hémorragiques majeurs. La bithérapie antithrombotique par aspirine et rivaroxaban (2,5 mg, 2×/jour) est plus efficace que l’aspirine seule chez les patients atteints d’AOP, car elle réduit la fréquence des accidents vasculaires cérébraux (MACE) et des ischémies aiguës des membres ; elle s’accompagne toutefois d’un risque accru d’hémorragies majeures. Un traitement antithrombotique ne doit pas être systématiquement administré aux patients souffrant d’une AOPV asymptomatique. Bien que les patients atteints d’APVP présentent un risque cardiovasculaire très élevé, une étude portant sur l’effet des antiplaquettaires chez des patients asymptomatiques avec un ABI ≤0,95 n’a montré aucun effet sur l’AMCA ou les revascularisations [11,12]. Une autre étude menée chez des patients présentant un ABI ≤0,99 et un diabète n’a pas non plus montré de différence sur le MACE ou les amputations [13]. Cependant, ces données n’ont pas été conçues pour analyser des sous-groupes et n’excluent pas que l’aspirine puisse avoir un bénéfice chez les patients présentant un risque accru d’événements cardiovasculaires.
Vérifier l’indication de revascularisation
Chez les patients souffrant d’une AOP symptomatique et dont la qualité de vie liée à l’AOP est altérée, une revascularisation peut être envisagée après trois mois du meilleur traitement médicamenteux possible et de la thérapie par l’exercice (recommandation IIb). Il est recommandé d’adapter le mode et le type de revascularisation à la localisation anatomique de la lésion, à la morphologie de la lésion et à l’état général du patient. Chez les patients qui subissent une revascularisation endovasculaire, une thérapie d’entraînement surveillée est utile en tant que mesure d’accompagnement. Certaines études indiquent qu’après un traitement de revascularisation endovasculaire, une double inhibition des plaquettes pendant 1 à 3 mois est bénéfique [16,17]. L’association d’aspirine 100 mg et de rivaroxaban (2,5 mg, 2 fois par jour) après revascularisation a montré une incidence modérée mais significativement plus faible de MALE et de MACE par rapport à l’aspirine seule, sans augmentation des hémorragies graves dues à la thrombolyse en cas d’infarctus du myocarde, mais avec une augmentation des hémorragies graves selon l’International Society on Thrombosis and Haemostasis, en particulier lorsque le clopidogrel a été administré pendant 1 mois > [6,18,19] . Il est recommandé d’effectuer un suivi régulier des patients atteints d’APVP, c’est-à-dire au moins une fois par an, en évaluant non seulement l’état clinique et fonctionnel, mais aussi l’adhésion au traitement, les symptômes des membres et tous les facteurs de risque cardiovasculaire, si nécessaire par échographie duplex. L’AVPC est l’un des facteurs de risque cliniques pris en compte dans le score CHA2DS2-VASc– un outil de diagnostic permettant d’évaluer le risque d’accident vasculaire cérébral (AVC) chez les patients atteints de fibrillation auriculaire (FAV) [20]. La prévalence de la FVH est d’environ 12% chez les patients atteints d’AVP.
Congrès : swissESCupdate.24
Littérature :
- “Les nouvelles directives de l’ESC combinent pour la première fois les maladies artérielles périphériques et aortiques, soulignant l’interconnectivité de l’ensemble du système artériel”, European Society of Cardiology (ESC), 30 août 2024.
- Mazzolai L, et al ; ESC Scientific Document Group. 2024 ESC Guidelines for the management of peripheral arterial and aortic diseases. Eur Heart J 2024 ; 45(36) : 3538-3700.
- “2024 ESC Guidelines for the management of peripheral arterial and aortic diseases”, Prof. Dr Thomas Zeller, Swiss ESC Update 2024, Bâle, 05.09.2024
- Collaboration des trialistes antithrombotiques. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002 ; 324 : 71-86.
- De Carlo M, et al : Efficacité et sécurité des traitements antiplaquettaires dans les artériopathies périphériques symptomatiques : une revue systématique et une méta-analyse en réseau. Curr Vasc Pharmacol 2021 ; 19 : 542-555.
- Willems LH, et al : Traitement antithrombotique pour l’artériopathie périphérique symptomatique : une revue systématique et une méta-analyse en réseau. Drugs 2022 ; 82 : 1287-1302.
- Katsanos K, et al : Efficacité et sécurité comparatives de différents agents antiplaquettaires pour la prévention des événements cardiovasculaires majeurs et des amputations de jambe chez les patients atteints de maladie artérielle périphérique : une revue systématique et une méta-analyse en réseau. PLoS One 2015 ; 10 : e0135692.
- Basili S, et al. : Comparaison de l’efficacité des traitements antiplaquettaires pour les patients atteints de claudication. Une méta-analyse. Thromb Haemost 2010 ; 103 : 766-773.
- Comité directeur de CAPRIE. Un essai randomisé en aveugle de clopidogrel versus aspirine chez les patients à risque d’événements ischémiques (CAPRIE). Comité directeur de CAPRIE. Lancet 1996 ; 348 : 1329-1339.
- 10. Berger JS, et al : Aspirine for the prevention of cardiovascular events in patients with peripheral artery disease : a meta-analysis of randomized trials. JAMA 2009;301 : 1909-1919.
- Dorn A, et al : Low and high ankle-brachial index are both associated with mortality in German nursing home residents-the five-year follow-up of the “allo-study” Cohort. J Clin Med 2023 ; 12 : 4411. doi : 10.3390/jcm12134411
- Fowkes FG, et al : Aspirine pour la prévention des événements cardiovasculaires dans une population générale dépistée pour un faible indice brachial de la cheville : un essai contrôlé randomisé. JAMA 2010 ; 303 : 841-848.
- Belch J, et al : The prevention of progression of arterial disease and diabetes (POPADAD) trial : factorial randomised placebo controlled trial of aspirin and antioxidants in patients with diabetes and asymptomatic peripheral arterial disease. BMJ 2008 ; 337 : a1840.
- Bowman L, et al : Effects of aspirin for primary prevention in persons with diabetes mellitus. N Engl J Med 2018 ; 379 : 1529-1539.
- Mazzolai L, et al : Exercise therapy for chronic symptomatic peripheral artery disease. Eur Heart J 2024 ; 45 : 1303-1321.
- Strobl FF, et al : Twelve-month results of a randomized trial comparing mono with dual antiplatelet therapy in endovascularly treated patients with peripheral artery disease. J Endovasc Ther 2013 ; 20 : 699-706.
- Tsai SY, et al : Mono ou bithérapie antiplaquettaire pour le traitement des patients atteints d’artériopathie périphérique après une revascularisation de l’extrémité inférieure : une revue systématique et une méta-analyse. Pharmaceuticals (Bâle) 2022 ; 15:596. https://doi.org/10.3390/ph15050596.
- Bonaca MP, et al : Rivaroxaban dans l’artériopathie périphérique après revascularisation. N Engl J Med 2020 ; 382:1994-2004.
- Hiatt WR, et al : Rivaroxaban et aspirine dans la revascularisation de l’extrémité inférieure des maladies artérielles périphériques : impact du clopidogrel concomitant sur l’efficacité et la sécurité. Circulation 2020 ; 142 : 2219-2230.
- Olesen JB, et al : Am J Med 2012;125 : 826.e13-23.
- Criqui MH, Aboyans V : Circ Res 2015;116 : 1509-1526.
HAUSARZT PRAXIS 2024 ; 19(11) : 28-29 (publié le 22.11.24, ahead of print)