Tanto los pacientes asintomáticos como los sintomáticos con arteriopatía periférica presentan un mayor riesgo cardiovascular. Por lo tanto, el diagnóstico precoz, la prevención y el tratamiento son cruciales. Las recomendaciones de la Sociedad Europea de Cardiología (ESC) se actualizaron en 2024. Recientemente, la EAP se ha convertido en un subcapítulo de un amplio documento de directrices sobre la enfermedad arterial periférica y aórtica (EAP).
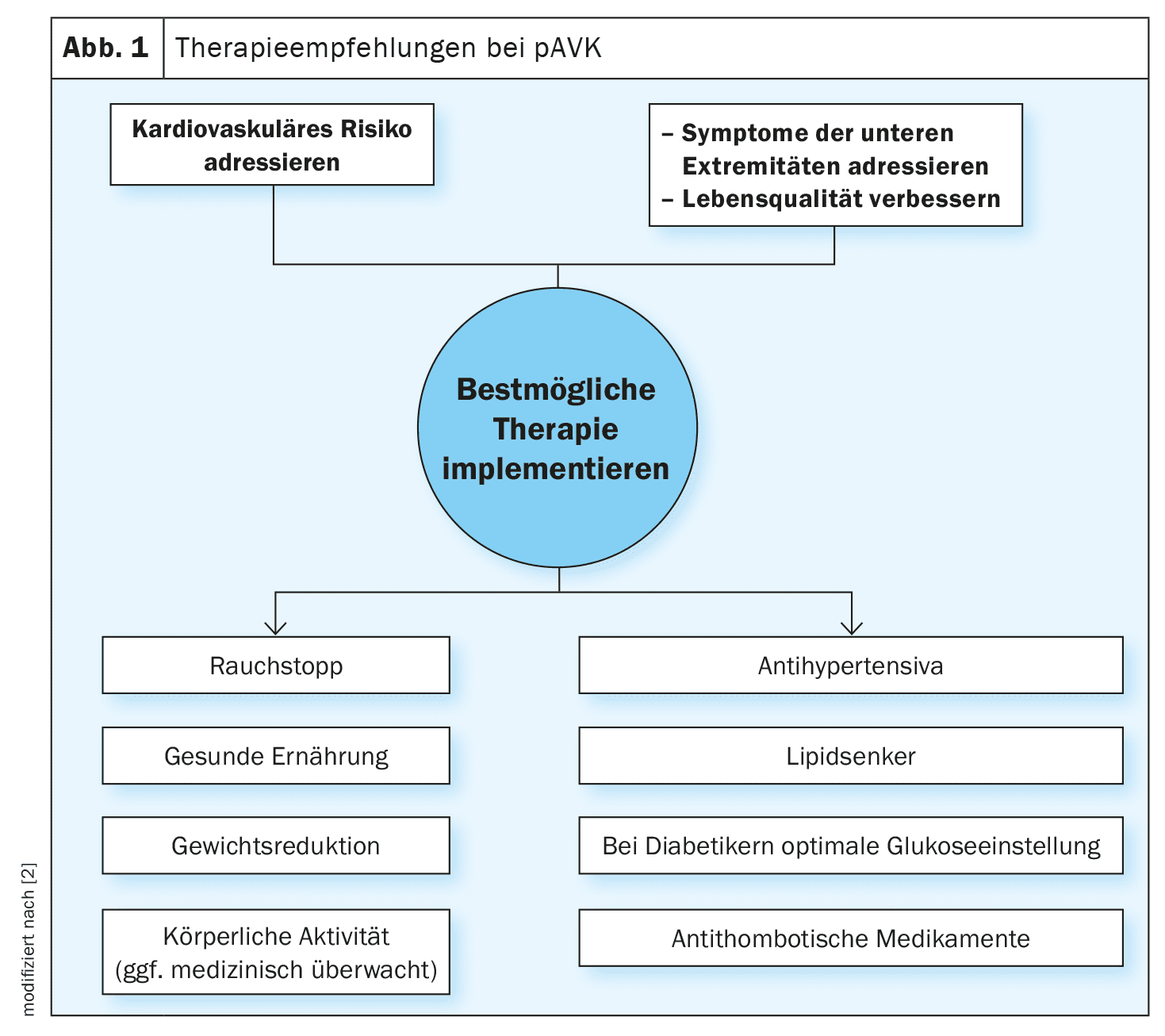
[1,2]La prevalencia global de la enfermedad arterial y aórtica periférica (EAAP) es del 1,5% y aumenta con la edad, afectando al 15-20% de los mayores de 70 años y al 20-30% de los mayores de 80 . Los pacientes con enfermedad aórtica corren un mayor riesgo de sufrir una enfermedad vascular periférica y viceversa. Una proporción significativa de pacientes son asintomáticos, por lo que resulta crucial el cribado de la PAAD basado en factores de riesgo como la edad, los antecedentes familiares y otros factores predisponentes. La DAAP puede diagnosticarse mediante pruebas vasculares no intervencionistas o pruebas de imagen. Las directrices(recuadro) hacen hincapié en que el control de la hipertensión, la hiperlipidemia y la diabetes es clave para prevenir complicaciones graves. Además de los factores relacionados con el estilo de vida, las intervenciones farmacológicas (por ejemplo, la terapia hipolipemiante/hipertensiva/antidiabética/antitrombótica) también pueden estar indicadas para prevenir las complicaciones. El LDL-C (colesterol de lipoproteínas de baja densidad) es un factor clave en la arteriosclerosis, y la diabetes y el consumo de tabaco aumentan el riesgo de EAP entre 2 y 4 veces. [3,21] Alrededor del 20-30% de los diabéticos padecen arteriopatía periférica.| La nueva directriz de la ESC sobre la PAAD hace hincapié en un enfoque holístico La integración de las recomendaciones para el tratamiento de la enfermedad arterial periférica y aórtica (EAP) en un único documento de directrices pretende reconocer que la aorta y las arterias periféricas son partes integrantes del mismo sistema arterial. La Sociedad Europea de Cardiología (ESC) ha introducido ahora esta actualización, ya que se han producido avances significativos en la comprensión y el tratamiento de la PAAD desde que se publicaron las directrices respectivas en 2014 y 2017. Las recomendaciones clave de la directriz 2024 están relacionadas con la naturaleza crónica de la DAAP, la importancia de la detección precoz y la necesidad de estrategias de tratamiento integrales. El objetivo es lograr un tratamiento coherente y coordinado de las diferentes enfermedades vasculares, reduciendo así la fragmentación y mejorando los resultados generales del tratamiento. |
| a [1,2] |
El índice tobillo-brazo es significativo
La directriz señala que la “enfermedad arterial periférica” (EAP) o “enfermedad arterial oclusiva periférica” (EAPO) sólo se refiere a la enfermedad aterosclerótica de las extremidades inferiores. “Los pacientes con EAP tienen el mayor riesgo de sufrir eventos cardiovasculares”, explicó el Prof. Dr. Thomas Zeller, del Centro Universitario del Corazón de Friburgo-Bad Krozingen (Alemania) [3]. La EAP puede ser sintomática o asintomática y puede estar asociada o no a heridas en las extremidades. Todos los pacientes con EAP tienen un alto riesgo de sufrir un acontecimiento cardiaco adverso grave (MACE ) y una enfermedad cerebrovascular. La incidencia acumulada de mortalidad cardiovascular a 5 años es del 9% en la EAP asintomática y del 13% en los pacientes sintomáticos. El índice tobillo-brazo (ITB ) es la primera prueba diagnóstica no invasiva propuesta para confirmar el estado de flujo sanguíneo reducido de las extremidades inferiores y debe notificarse por separado para cada pierna. Un ITB ≤0,90 confirma el diagnóstico de EAP.
El cribado de las enfermedades coronarias es obligatorio
Además de evaluar la perfusión de las extremidades, el ITB sirve como marcador sustitutivo de la mortalidad cardiovascular y por cualquier causa. Un síntoma típico de la EAP es el dolor al caminar, que remite en reposo. La evaluación de la incapacidad para caminar y del estado funcional es obligatoria. Y todos los pacientes con EAP deben someterse a un cribado para detectar la presencia de cardiopatía coronaria. “El cribado de la cardiopatía coronaria es esencial en estos pacientes”, afirma el profesor Zeller [3]. La ecografía dúplex puede utilizarse para diferenciar las lesiones ateroscleróticas (incluidas las subclínicas) de las no ateroscleróticas. La cardio-TC se considera el procedimiento de imagen más importante para el diagnóstico, el pronóstico y la planificación del tratamiento de las enfermedades aórticas (para el síndrome aórtico agudo, la sensibilidad es del 100% y la especificidad del 98%). La cardio-RM es adecuada para una evaluación exhaustiva de la aorta, incluyendo su forma, diámetro y características tisulares. En los pacientes con arteriopatía periférica con diabetes coexistente y/o infecciones, debe tenerse en cuenta que la cicatrización de las heridas puede verse afectada, lo que se asocia a un mayor riesgo de amputación. Por lo tanto, el riesgo de amputación en estos pacientes debe evaluarse sistemáticamente utilizando la clasificación para heridas, isquemia e infecciones del pie.
Se recomienda un entrenamiento estructurado para caminar
[15]Recientemente se ha publicado un documento de consenso sobre el ejercicio y la arteriopatía periférica en la revista European Heart Journal. La actividad física es una intervención de estilo de vida importante en la EAP para mejorar los síntomas y promover la calidad de vida. En pacientes con EAP sintomática, se han demostrado mejoras en la distancia caminada de seis minutos (6MWD), la calidad de vida relacionada con la salud (HRQoL) y la aptitud cardiorrespiratoria. Según el ponente [3], lo más adecuado es un entrenamiento regular de la marcha, a ser posible en grupo y bajo la dirección de un experto. El entrenamiento estructurado de la marcha tres veces por semana durante 30-60 minutos ha demostrado su eficacia para la claudicación intermitente. Los pacientes sintomáticos deben someterse a un examen médico antes de empezar a hacer ejercicio y, si es posible, realizar sesiones de entrenamiento bajo supervisión médica. Además, se recomienda que los fumadores dejen de fumar y que los pacientes hipertensos reduzcan su tensión arterial. Para la mayoría de los adultos, debe fijarse como objetivo un valor sistólico de 120-129 mm Hg, siempre que la terapia se tolere bien. Si este valor objetivo no parece alcanzable, puede aplicarse el principio ALARA (“Tan bajo como sea razonablemente posible”). Existe una recomendación IIa para el uso de inhibidores de la ECA o antagonistas de los receptores de angiotensina (ARA) en primera línea. <En cuanto a la gestión de los lípidos, la directriz actual aconseja aspirar a un valor de colesterol LDL de 55 mg/dl (1,4 mmol/l) si es posible.Considerar la terapia antitrombótica para la EAP sintomática
[4–8]En los pacientes con EAP sintomática, el tratamiento antitrombótico mejora el pronóstico cardiovascular . [4–6] Para estos pacientes, existe una recomendación de clase Ia para la terapia antiplaquetaria con aspirina (75-160 mg, 1× diario) o clopidogrel (75 mg, 1× diario) para reducir el riesgo de MACE . [9,10] Los estudios sugieren que el clopidogrel puede tener una modesta ventaja sobre la aspirina . En el ensayo EUCLID (Examining Use of tiCagreLor In peripheral artery Disease) , la monoterapia antitrombótica con ticagrelor no mostró un beneficio superior en la reducción de los MACE ni de las hemorragias graves en comparación con el clopidogrel. La terapia antitrombótica dual con aspirina y rivaroxaban (2,5 mg, 2× diarios) es más eficaz que la aspirina sola en pacientes con EAP, ya que reduce la incidencia de ictus (MACE) y de isquemia aguda de las extremidades; sin embargo, se asocia a un mayor riesgo de hemorragias graves. La terapia antitrombótica no debe administrarse sistemáticamente a pacientes con EAP asintomática. [11,12] Aunque los pacientes con EAP tienen un riesgo cardiovascular muy elevado, un estudio que investigó el efecto de los antiagregantes plaquetarios en pacientes asintomáticos con un ITB ≤0,95 no mostró ningún efecto sobre los MACE o la revascularización . [13] Otro estudio en pacientes con un ITB ≤0,99 y diabetes tampoco mostró diferencias en los MACE o las amputaciones . Sin embargo, estos datos no se diseñaron para analizar subgrupos y no descartan la posibilidad de que la aspirina pueda tener un beneficio en pacientes con mayor riesgo de eventos cardiovasculares.Comprobar la indicación de revascularización
En los pacientes con arteriopatía periférica sintomática y deterioro de la calidad de vida relacionada con la arteriopatía periférica, puede considerarse la revascularización después de tres meses del mejor tratamiento farmacológico y terapia de ejercicio posibles (recomendación IIb). Se recomienda adaptar el modo y el tipo de revascularización a la localización anatómica de la lesión, la morfología de ésta y el estado general del paciente. Para los pacientes sometidos a revascularización endovascular, se recomienda la terapia de ejercicio supervisada como medida de acompañamiento. [16,17] Existen pruebas procedentes de estudios individuales de que la inhibición plaquetaria dual durante un periodo de 1 a 3 meses es beneficiosa tras la terapia de revascularización endovascular . > [6,18,19] Una combinación de aspirina 100 mg y rivaroxabán (2,5 mg, 2× diarios) tras la revascularización mostró una incidencia moderada pero significativamente menor de MALE y MACE en comparación con la aspirina sola, sin un aumento de las hemorragias graves por trombólisis en el infarto de miocardio, pero con un aumento de las hemorragias graves según la Sociedad Internacional de Trombosis y Hemostasia, especialmente cuando se administró clopidogrel durante 1 mes . Se recomienda que los pacientes con arteriopatía periférica se sometan a exámenes de seguimiento periódicos, es decir, al menos una vez al año, para evaluar su estado clínico y funcional, así como el cumplimiento terapéutico, los síntomas de las extremidades y todos los factores de riesgo cardiovascular, utilizando una ecografía dúplex si es necesario. [20] La arteriopatía periférica es uno de los factores de riesgo clínicos incluidos en la puntuación CHA2DS2-VASc, una herramienta de diagnóstico para evaluar el riesgo de ictus en pacientes con fibrilación auricular (FA) . La prevalencia de FA en pacientes con EAP es de alrededor del 12%.
Congreso: swissESCupdate.24
Literatura:
- «New ESC Guidelines combine peripheral arterial and aortic diseases for first time, emphasising interconnectivity of whole arterial system», European Society of Cardiology (ESC), 30 Aug 2024.
- Mazzolai L, et al.; ESC Scientific Document Group. 2024 ESC Guidelines for the management of peripheral arterial and aortic diseases. Eur Heart J 2024; 45(36): 3538–3700.
- «2024 ESC Guidelines for the management of peripheral arterial and aortic diseases», Prof. Dr. Thomas Zeller, Swiss ESC Update 2024, Basel, 05.09.2024
- Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324: 71–86.
- De Carlo M, et al.: Efficacy and safety of antiplatelet therapies in symptomatic peripheral artery disease: a systematic review and network meta-analysis. Curr Vasc Pharmacol 2021; 19: 542–555.
- Willems LH, et al.: Antithrombotic therapy for symptomatic peripheral arterial disease: a systematic review and network meta-analysis. Drugs 2022; 82: 1287–1302.
- Katsanos K, et al.: Comparative efficacy and safety of different antiplatelet agents for prevention of major cardiovascular events and leg amputations in patients with peripheral arterial disease: a systematic review and network meta-analysis. PLoS One 2015; 10: e0135692.
- Basili S, et al.: Comparison of efficacy of antiplatelet treatments for patients with claudication. A meta-analysis. Thromb Haemost 2010; 103: 766–773.
- CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996; 348: 1329–1339.
- Berger JS, et al.: Aspirin for the prevention of cardiovascular events in patients with peripheral artery disease: a meta-analysis of randomized trials. JAMA 2009;301: 1909–1919.
- Dorn A, et al.: Low and high ankle-brachial index are both associated with mortality in German nursing home residents–the five-year follow-up of the «allo-study» Cohort. J Clin Med 2023; 12: 4411. doi: 10.3390/jcm12134411
- Fowkes FG, et al.: Aspirin for prevention of cardiovascular events in a general population screened for a low ankle brachial index: a randomized controlled trial. JAMA 2010; 303: 841–848.
- Belch J, et al.: The prevention of progression of arterial disease and diabetes (POPADAD) trial: factorial randomised placebo controlled trial of aspirin and antioxidants in patients with diabetes and asymptomatic peripheral arterial disease. BMJ 2008; 337: a1840.
- Bowman L, et al.: Effects of aspirin for primary prevention in persons with diabetes mellitus. N Engl J Med 2018; 379: 1529–1539.
- Mazzolai L, et al.: Exercise therapy for chronic symptomatic peripheral artery disease. Eur Heart J 2024; 45: 1303–1321.
- Strobl FF, et al.: Twelve-month results of a randomized trial comparing mono with dual antiplatelet therapy in endovascularly treated patients with peripheral artery disease. J Endovasc Ther 2013; 20: 699–706.
- Tsai SY, et al.: Mono or dual antiplatelet therapy for treating patients with peripheral artery disease after lower extremity revascularization: a systematic review and meta-analysis. Pharmaceuticals (Basel) 2022; 15:596. https://doi.org/10.3390/ph15050596.
- Bonaca MP, et al.: Rivaroxaban in peripheral artery disease after revascularization. N Engl J Med 2020; 382:1994–2004.
- Hiatt WR, et al.: Rivaroxaban and aspirin in peripheral artery disease lower extremity revascularization: impact of concomitant clopidogrel on efficacy and safety. Circulation 2020; 142: 2219–2230.
- Olesen JB, et al.: Am J Med 2012;125: 826.e13–23.
- Criqui MH, Aboyans V: Circ Res 2015;116: 1509–1526.
HAUSARZT PRAXIS 2024; 19(11): 28–29 (publicado el 22.11.24, antes de impresión)