Le système nerveux périphérique (SNP) a une grande capacité de régénération après lésion. Cependant, cette régénération est souvent inefficace en cas de grande lésion (distance entre point de lésion et fibre musculaire ou récepteur sensoriel à ré-innerver). En effet, une reconnexion rapide des axones à leur cible antérieure est essentielle pour une régénération fonctionnelle. La vitesse de repousse des axones après lésion est donc un paramètre clé pour la régénération du SNP après lésion.
Comment peut-on accélérer la repousse axonale après lésion? Nos travaux de recherche sur cette question, réalisés grâce au généreux soutien de la Fondation internationale pour la recherche en paraplégie (IRP), l’OPO-Stiftung et le Fonds national suisse de la recherche scientifique (FNS), ont récemment été publiés dans Nature Communications [1]. Voici en bref les points majeurs de nos résultats.
Au contraire du SNP, le système nerveux central (SNC) a une très faible capacité de régénération après lésion. Cette différence est due en grande partie aux différentes cellules gliales qui soutiennent la fonction des neurones dans ces deux systèmes: les cellules de Schwann (cellules gliales qui forment la myéline du SNP) stimulent la repousse axonale après lésion, alors que les oligodendrocytes (cellules gliales formant la myéline du SNC) inhibent la repousse axonale.
Ceci est dû à la différente composition de leur myéline et à la différente plasticité de ces deux types de cellules après lésion. En effet, les cellules de Schwann réagissent rapidement à une lésion du SNP en changeant leur cycle cellulaire et leur identité: elles se débarrassent de leur myéline et se convertissent en cellules spécialisées dans la réparation des axones. Ces cellules stimulent la repousse des axones en produisant des facteurs de croissance axonale et reconduisent les axones régénérés vers leur cible antérieure; ce qui mène à une régénération fonctionnelle. Au contraire, après une lésion du SNC, les oligodendrocytes restent inactifs dans le site de lésion ou meurent et leur myéline qui contient plusieurs protéines inhibitrices de la croissance axonale empêchent la repousse des axones lésés.
Pour rendre plus efficace la repousse axonale du SNP après lesion, nous avons amélioré la plasticité des cellules de Schwann. Nous avons démontré que des enzymes de remodelage de la chromatine de la famille des histone déacétylases (HDACs) sont essentielles pour la myélinisation durant le développement [2] et la remyélinisation après lésion [1]. Cependant, ces enzymes, HDAC1 et en particulier HDAC2, sont uprégulées (expression augmentée) trop tôt dans les cellules de Schwann après lésion pour que la régénération axonale se fasse de façon optimale.
En effet, l’uprégulation de HDAC2 conduit à la formation d’un complexe protéique qui ralentit la conversion des cellules de Schwann en cellules réparatrices et de ce fait ralentit la repousse axonale après lésion. Ce complexe protéique contient d’autres types d’enzymes de remodelage de la chromatine de la famille des histone déméthylases appelées KDM3A et JMJD2C qui sont nécessaires à la dé-répression de régions régulatrices (enhancers) de gènes induisant la formation de myéline. De plus, ce complexe protéique contient le facteur de transcription Sox10 qui a la capacité de se lier directement aux enhancers des gènes responsables de la production de myéline et d’induire leur activation (Fig. 1). Donc ce complexe protéique a une double fonction: il dé-réprime les gènes pro-myélinisants et induit leur activation. En l’absence de HDAC1 et 2, ce complexe protéique n’est pas capable de se lier à ces gènes pro-myélinisants qui ne sont donc pas activés. Ceci empêche notamment l’uprégulation du facteur de transcription Oct6 qui frêne l’uprégulation de cJun, un facteur de transcription clé pour la conversion des cellules de Schwann en cellules réparatrices. L’absence de HDAC1 et 2 permet donc une uprégulation plus rapide de cJun, une conversion plus rapide en cellules réparatrices et ainsi une stimulation plus rapide de la repousse axonale après lésion.
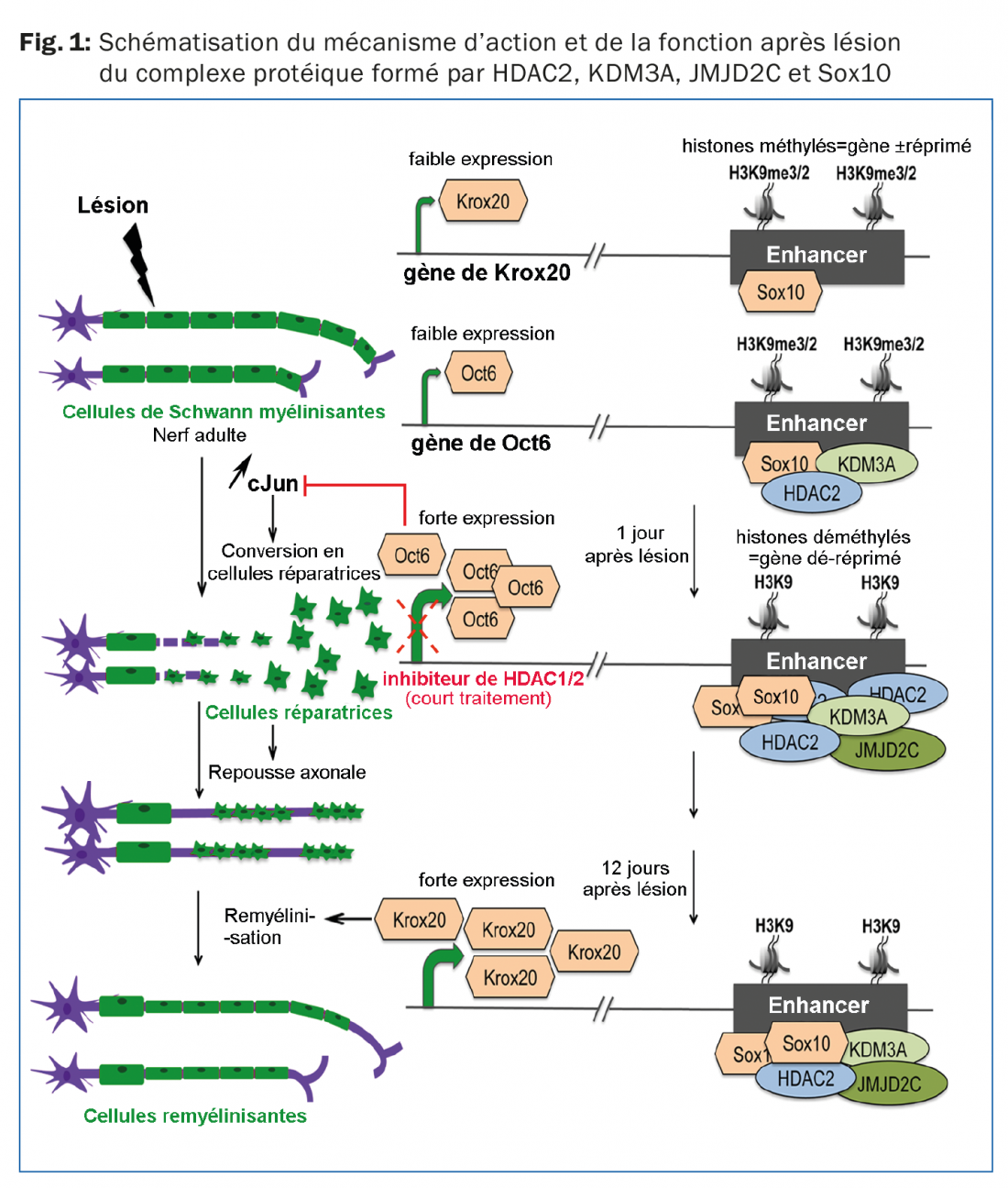
Cependant, si la repousse axonale est plus rapide en l’absence de HDAC1 et 2, la remyélinisation est inefficace car le facteur de transcription Krox20 qui est essentiel pour la formation de myéline (Fig. 1) n’est pas ou peu exprimé; ceci empêche une régénération fonctionnelle. Par contre, l’utilisation de courte durée (pendant 3 jours) d’un inhibiteur de HDAC1 et 2 (Mocétinostat) après lésion du SNP chez la souris permet d’accélérer la repousse axonale sans empêcher la remyélinisation (Fig. 1). Ceci coincide avec une régénération motrice et sensorielle accélérée et une augmentation de la densité des axones régénérés.
Ces résultats sont d’un intérêt majeur pour améliorer la régénération fonctionnelle du SNP après lésion et nous espérons qu’ils pourraient aussi aider à améliorer la repousse axonale du SNC après lésion, une hypothèse que nous sommes en train de tester. A SUIVRE!
Références:
- Brügger V, et al. (2017): Nature Communications, 8: 14272
- Jacob C, et al. (2011): Nature Neuroscience 14: 429–436.
IRP – International Foundation
for Research in Paraplegia
Seestrasse 19
8002 Zürich
www.irp.ch
HAUSARZT PRAXIS 2017; 12(4): 8–9












