La douleur est l’un des symptômes les plus difficiles à appréhender. De nombreux autres signes de la maladie, comme les manifestations cutanées ou les paralysies, sont visibles, palpables et donc objectivables. En revanche, pour évaluer la douleur, nous dépendons entièrement de la description de la personne concernée, le symptôme reste toujours subjectif.
La douleur est l’un des symptômes les plus difficiles à appréhender. De nombreux autres signes de la maladie, comme les manifestations cutanées ou les paralysies, sont visibles, palpables et donc objectivables. En revanche, pour évaluer la douleur, nous dépendons entièrement de la description de la personne concernée, le symptôme reste toujours subjectif.
Définition
La douleur neuropathique est définie comme une “douleur qui survient en conséquence directe d’un dommage ou d’une lésion du système somatosensoriel” [1,2]. Cette définition suppose la mise en évidence d’une telle lésion comme condition inéluctable pour poser le diagnostic de “douleur neuropathique”. En d’autres termes, les informations fournies par le patient ne suffisent pas à établir un diagnostic de certitude. En fonction de la preuve d’une telle lésion, la douleur neuropathique est classée comme certaine, probable, possible ou improbable [3] (Fig. 1). Une lésion importante du système somatosensoriel peut être détectée par des méthodes d’examen spéciales, dont le test sensoriel quantitatif (QST).
Contexte
L’examen QST constitue une extension standardisée de l’examen neurologique de la sensibilité et permet une analyse complète du fonctionnement du système nerveux somatosensoriel [4]. Elle est réalisée selon le protocole du Deutscher Forschungsverbund Neuropathischer Schmerz (DFNS). La QST complète d’autres méthodes de mesure neurologiques et électrophysiologiques déjà existantes, telles que la neurographie. Alors que cette dernière permet d’étudier la fonction des fibres nerveuses plus épaisses, la QST enregistre en outre la fonction des fibres nerveuses plus fines, peu ou pas myélinisées. Des études post-mortem nous apprennent que la proportion de fibres nerveuses de petit calibre dans le système nerveux périphérique est d’environ 80% [5,6].
Des nerfs fins, des effets importants
Les fibres nerveuses fines jouent un rôle particulièrement important dans les maladies qui s’accompagnent d’une diminution de la sensibilité au chaud, au froid ou au toucher, ainsi que dans la douleur. Les terminaisons nerveuses libres se trouvent dans la zone de la peau, captent les stimuli et les transforment en potentiels électriques [7]. Les lésions du système nerveux périphérique ou central sont souvent associées à une augmentation de la sensibilité de la peau à la douleur, les “symptômes plus” (signes plus : hyperalgésie et allodynie), et/ou à une diminution de la perception, les “symptômes négatifs” (signes moins : hypoesthésie, hypalgésie). Des paresthésies non spécifiques avec/sans douleur peuvent se manifester comme les premiers symptômes d’une maladie systémique encore latente en laboratoire, comme le diabète sucré. Ces symptômes caractérisent des mécanismes neurobiologiques impliqués dans le développement de la douleur neuropathique. La QST permet d’enregistrer l’état fonctionnel de tous les systèmes de fibres afférentes primaires qui forment le système somatosensoriel [8]. Il s’agit notamment des fibres nerveuses Aβ, qui sont épaissies par la myéline, ont un grand diamètre et conduisent rapidement les stimuli (proprioception, toucher léger) au thalamus via les voies postérieures et le système lemniscal. Les fibres Aδ, finement myélinisées, et les fibres C, non myélinisées, transmettent lentement les stimuli nociceptifs et thermiques au thalamus via les cordons antérieurs et le tractus spinothalamique. Alors que les fibres Aδ sont responsables de la première douleur, qui est vive, aiguë et bien localisée, les fibres C sont responsables de la deuxième douleur, qui est durable [9].
Une procédure standardisée
Comme mentionné ci-dessus, l’examen QST est réalisé selon le protocole standardisé du Deutscher Forschungsverbund Neuropathischer Schmerz (DFNS) [4]. La validité, la fiabilité (test-retest et fiabilité inter-observateurs) et les possibilités d’assurance qualité de la méthode de mesure ont été évaluées dans le cadre d’études multicentriques, tant sur des patients que sur des sujets sains, et une base de données de valeurs normatives a été créée [10,11]. Des valeurs normales liées à l’âge et au sexe sont disponibles pour la main, le pied, le visage et le dos [10,12]. Pour valider la méthode QST, un site de mesure a été mis en place pour étudier tous les paramètres QST. Ce poste de mesure est utilisé dans le cadre des formations QST afin de s’entraîner à l’application exacte des jauges QST et contribue à l’assurance qualité.
Principe de fonctionnement
La batterie de QST standardisée du DFNS se compose de 7 tests individuels, pour lesquels 13 paramètres au total sont enregistrés. Les tests se font exclusivement sur la peau et une zone test et une zone témoin en miroir sont examinées, ce qui permet d’établir un profil sensoriel complet en une heure [4]. Il s’agit d’appliquer des stimuli calibrés sur la peau afin de déterminer les seuils de perception, de douleur ou de tolérance à la douleur. Cela permet un enregistrement complet de la fonction de toutes les sous-modalités somatosensorielles nociceptives et non nociceptives (signe plus – augmentation de la fonction [Hyperalgesie] ou signe moins – [perte de fonction, hypoesthésie]). Il existe des instructions précises pour l’enquêteur avec un libellé standardisé. Les mêmes stimuli d’essai thermique et mécanique calibrés sont toujours appliqués dans le même ordre d’essai, en commençant par l’essai thermique [4,13,14].
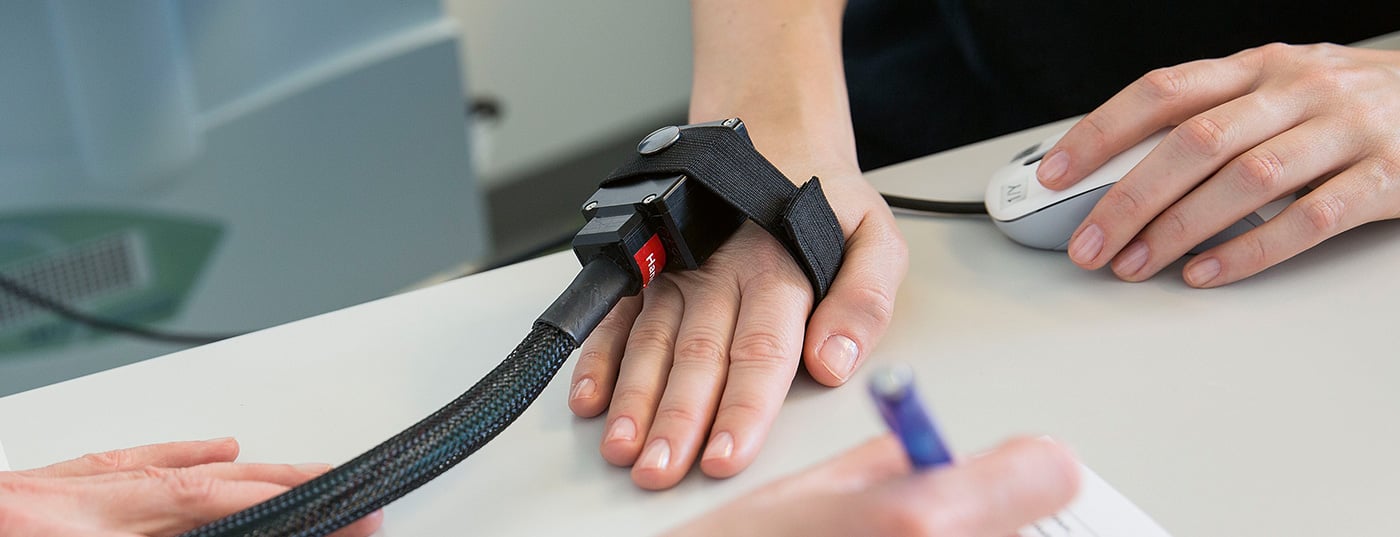
Test thermique
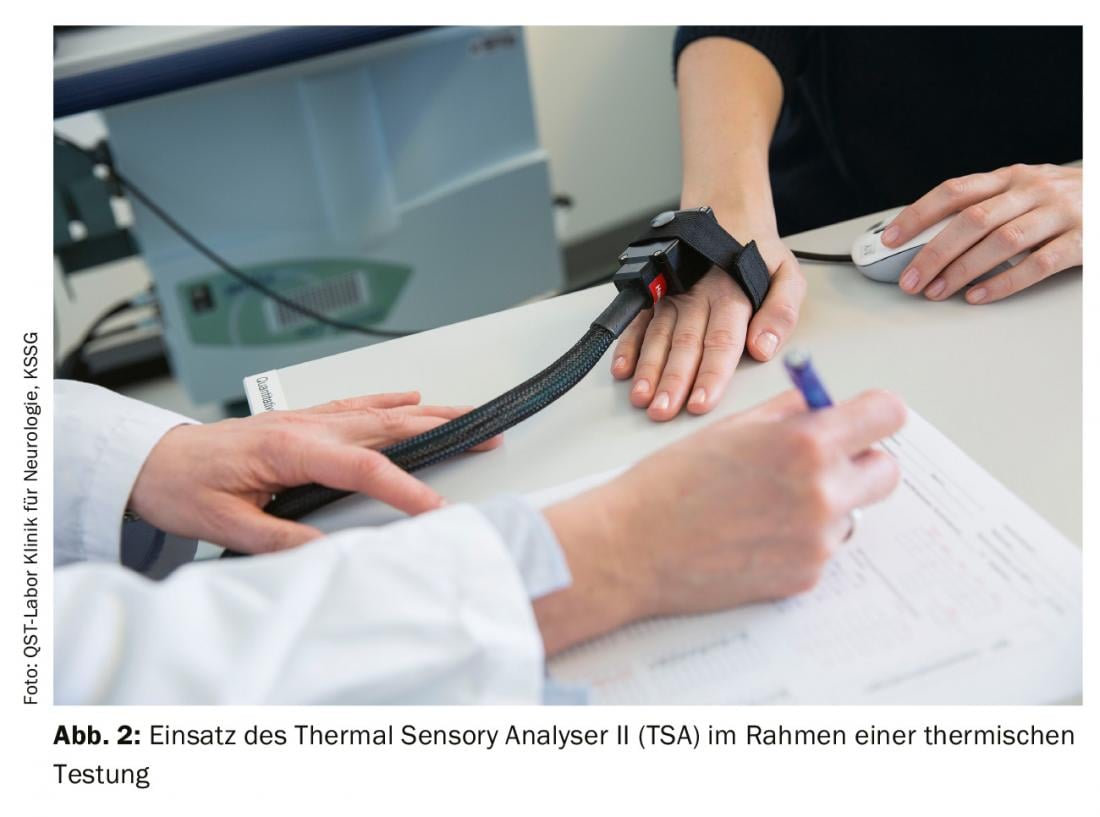
Le test thermique étudie la fonctionnalité des fibres Aδ fines et peu myélinisées et des fibres C non myélinisées ainsi que leurs systèmes de trajectoires. Elle est réalisée à l’aide d’un thermotest informatisé (par exemple, le Thermal Sensory Analyser II [TSA], fig. 2). A l’aide d’un thermode (élément Peltier), des stimuli thermiques contrôlés par ordinateur sont appliqués sur la zone correspondante de la peau et des muqueuses, en commençant par une température de base de 32 °C et en augmentant lentement avec des intervalles de stimuli de 1 °C. La température de base est de 32 °C et les intervalles de stimuli sont de 1 °C. La température de base est de 32 °C. Les seuils sensoriels pour la sensation de froid (CDT), la sensation de chaleur (WDT), la douleur induite par le froid (CPT), la douleur induite par la chaleur (HPT) ainsi que le seuil de différence thermique (TSL) et si les stimuli froids sont perçus comme chauds (sensation de chaleur paradoxale, PHS) sont déterminés [4].
Test mécanique
Le test mécanique se compose de plusieurs tests individuels, comme suit.
Seuil de détection mécanique (MDT, mechanical detection threshold) : Il est réalisé à l’aide d’un ensemble de filaments de fibre de verre standardisés de différents diamètres et de longueurs variables (filaments de von Frey) (Fig. 3A). Les filaments sont placés de la même manière jusqu’à ce qu’ils fléchissent en forme de S afin de garantir un test précis. Des mécanorécepteurs à bas seuil sont alors activés, qui transmettent la perception du toucher via des fibres Aβ [4,14].
Seuil de douleur mécanique (MPT, mechanical pain threshold) : Des stimulateurs à aiguilles (PinPrick) sont utilisés à cet effet (fig. 3B). Il s’agit d’aiguilles émoussées avec une intensité de stimulation fixe et une surface de contact circulaire avec la peau. Ce sont principalement les nocicepteurs Aδ qui sont activés. La peau n’est pas endommagée [4].
Fonctions stimulus-réponse : Les fonctions stimulus-réponse servent à déterminer la sensibilité à la douleur mécanique (MPS, mechanical pain sensitivity) et à détecter une éventuelle allodynie mécanique dynamique (DMA, dynamic mechanical allodynia). Pour ce faire, on utilise un kit composé des stimulateurs à aiguille mentionnés précédemment, d’un coton-tige, d’un pinceau doux et d’une boule de coton (Fig. 3C) [4].

phénomène de wind-up (WUR, wind up ratio) : Les stimulateurs à aiguille sont utilisés à cet effet. Dans la zone de test, la sensibilité de la peau à un stimulus unique est comparée à celle à une série de stimuli. Le quotient de Wind-up est calculé à partir du rapport entre l’intensité de la douleur (sur l’échelle numérique analogique : “0” pas de douleur, “100” douleur maximale imaginable) sur les séries de stimuli, divisé par l’intensité de la douleur après les stimuli individuels [4]. Dans la moelle épinière, le wind-up représente un phénomène de sommation temporelle qui se produit spécifiquement dans les neurones à large gamme dynamique (Wide-dynamic-range neurones, WDR) lorsque leurs entrées de fibres C sont stimulées plus d’une fois en 3 secondes [14]. La présence d’un WUR est toujours pathologique et indique une augmentation persistante de la douleur.
Seuil de détection des vibrations (VDT) : Il est déterminé, comme dans le cadre de l’examen neurologique, à l’aide d’un diapason calibré (Diapason de Rydel-Seiffer®) (Fig. 3C). C’est le seul test dans le cadre de la batterie QST qui détermine un “seuil de disparition” [4,14]. Elle est transmise par les fibres Aβ.
le seuil de douleur à la pression (PPT, pressure pain threshold) : Il s’agit de déterminer le passage de la perception de la qualité de la pression à une impression sensorielle douloureuse [4]. Un algomètre de pression est utilisé à cet effet (Fig. 3D).
Analyse des données
Avant d’être convertis en une distribution normale, les paramètres QST collectés sont transformés de manière logarithmique, répertoriés sous forme de tableau et représentés graphiquement. Les valeurs sont comparées à celles d’un collectif de normes spécifiques à l’âge et au sexe pour l’évaluation des changements pathologiques. Les valeurs en dehors de l’intervalle de confiance de 95% (± 1,96) sont considérées comme pathologiques [14]. Les paramètres non nociceptifs sont CDT, WDT, TSL, MDT, VDT [15].
Paramètres QST
Rolke et al. ont pu montrer dans une étude que la comparaison intra-individuelle des paramètres QST du côté droit et du côté gauche du corps présente une corrélation élevée et qu’il n’y a donc pas de différence entre les deux côtés du corps chez le sujet sain [16]. La dépendance à l’âge et la spécificité du sexe des valeurs QST ont été démontrées dans plusieurs études. Entre autres, il y a une augmentation des seuils de perception et de douleur avec l’âge [16,17].
QST – Force et faiblesse
La QST est une procédure psychophysique et dépend donc toujours de la coopération active du patient. L’expérience de l’examinateur et les conclusions qu’il tire des résultats jouent également un rôle crucial. Le QST ne remplace pas un examen clinique et aucun diagnostic ne peut être établi sur la base du seul QST. L’un des points forts de la QST est qu’il s’agit d’un examen non invasif et sans effets secondaires. Par rapport aux autres méthodes d’examen de la fonction des fibres nerveuses de petit calibre, la QST permet de détecter non seulement les signes moins, mais aussi les signes plus.
La QST ne permet pas de localiser l’altitude ni d’attribuer une lésion à une étiologie [4,18,19]. Un résultat de QST peut être normal malgré une réduction démontrée de la densité des fibres nerveuses intraépidermiques dans la biopsie cutanée [18].
Les données relatives à la sensibilité et à la spécificité du diagnostic de la neuropathie des fibres nerveuses de petit calibre (neuropathie des petites fibres) font l’objet de controverses [20]. Dans ce cas, la préférence est parfois donnée à des méthodes plus objectives telles que l’examen morphométrique de l’innervation cutanée (biopsie cutanée pour déterminer la densité des fibres nerveuses intraépidermiques) et cornéenne (microscopie confocale cornéenne, entre autres, pour déterminer la densité des fibres nerveuses cornéennes). Les deux méthodes se concentrent sur la morphologie des fibres nerveuses de petit calibre, de sorte que les méthodes se complètent mutuellement. Il faut garder à l’esprit qu’un résultat normal à la fois du QST et de la biopsie cutanée n’exclut pas une douleur neuropathique et une atteinte des fibres nerveuses de petit calibre (small-fiber-affection), pas plus qu’il ne prouve l’une ou l’autre [19]. Les résultats doivent toujours être évalués dans le contexte global de l’anamnèse et de l’examen clinique.
Du symptôme au mécanisme
Les changements physiopathologiques à la base de l’apparition des douleurs neuropathiques se produisent généralement indépendamment de l’étiologie de la lésion nerveuse primaire. Le modèle des profils QST avec perte de fonction et augmentation de fonction permet de tirer des conclusions sur les mécanismes sous-jacents. Lorsqu’un stimulus noxique persiste, il entraîne une excitation permanente et donc une sensibilisation [21]. On distingue différents mécanismes.
Désafférentation : des indices de désafférentation sensorielle sont observés en cas de lésion de différents types de fibres ou des systèmes de voies associées dans la moelle épinière. L’expression des canaux sodiques sensibles à la tétrodotoxine (par exemple NaV1.3) est alors augmentée [22]. Cela se traduit dans le profil QST par la présence de signes négatifs.
Sensibilisation périphérique : elle est provoquée par la libération locale de médiateurs inflammatoires (dont l’histamine, la bradykinine, la prostaglandine, le CGRP, la substance P). La transmission du signal et la sensibilisation sont assurées, entre autres, par le glutamate, la substance P, la neurokinine A, le CGRP [9]. Dans l’examen QST, la sensibilisation périphérique est suspectée par la présence, par exemple, d’une hyperalgésie due à la chaleur [22].
Sensibilisation centrale : elle résulte d’une augmentation de la réponse des neurones WDR centraux. Dans la QST, on trouve une hyperalgésie mécanique aux stimuli de l’aiguille et une allodynie mécanique dynamique [22].
Trouble de l’inhibition endogène de la douleur – désinhibition centrale : elle existe lorsqu’une hyperalgésie généralisée est démontrée. Celle-ci est en faveur d’une défaillance de l’inhibition de la douleur (perturbation des modulateurs centraux de la douleur, système RVM gris périaquatique (PAG) (bulbe rachidien dorsal)), tandis qu’une hyperalgésie localisée est en faveur d’une sensibilisation centrale [23].
Possibilités d’utilisation pour les douleurs neuropathiques
Le QST peut être utilisé dans le diagnostic des douleurs neuropathiques, quelle qu’en soit l’origine, en particulier lorsque les méthodes électrophysiologiques conventionnelles ne révèlent aucune anomalie et/ou qu’une affection des fibres nerveuses de petit calibre ou des voies centrales associées est suspectée.
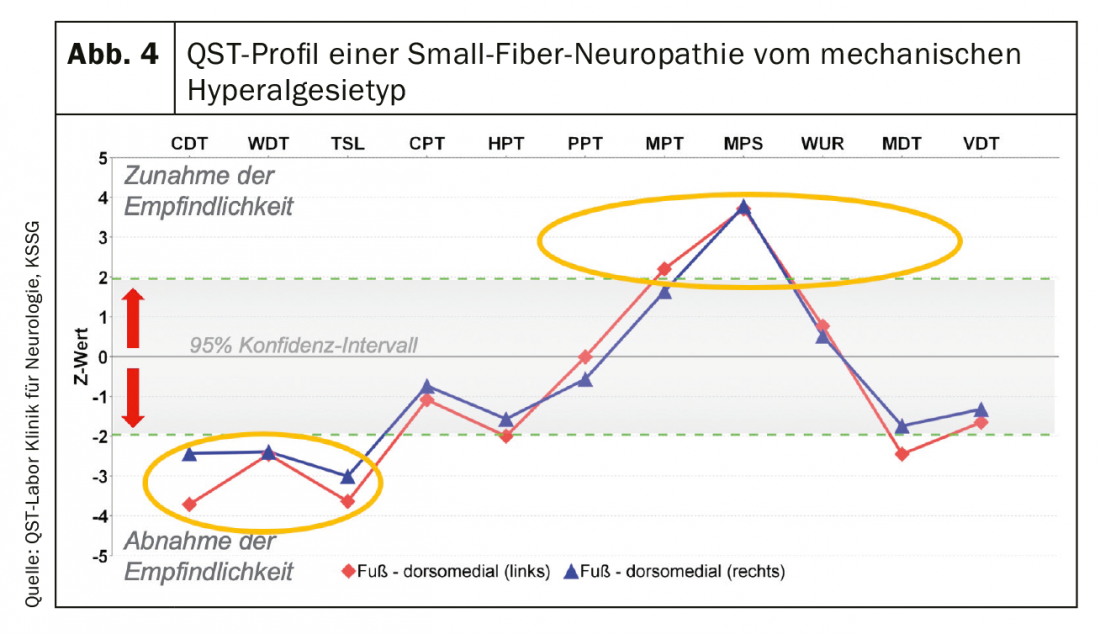
Neuropathie à petites fibres (SFN) : aucun gold standard n’a été défini à ce jour dans le diagnostic de la SFN. Le diagnostic est posé en présence d’au moins deux résultats pathologiques des examens suivants (examen clinique, test fonctionnel et/ou morphologie des fibres nerveuses de petit calibre) (20,24]. De tous les tests fonctionnels spécifiques, le QST est la procédure la mieux établie en clinique. Un résultat typique est illustré dans la figure 4 .
Neuropathie diabétique (DPN) : elle se caractérise par une polyneuropathie sensitivomotrice symétrique chronique dépendant de la longueur [19]. Environ 25% des patients diabétiques développent un DPN douloureux, qui est davantage lié à un dysfonctionnement des fibres nerveuses de petit calibre qu’à un dysfonctionnement des fibres nerveuses épaisses [25,26].
La QST est également utilisée pour les douleurs faciales (douleurs myofasciales DD : neuropathie/neuralgie du trijumeau, syndrome de la bouche brûlée) et dans la région buccale [27], pour les polyneuropathies induites par la chimiothérapie [28], pour la névralgie post-zostérienne [12], pour les douleurs musculo-squelettiques [29] et comme paramètre d’évolution postopératoire [30]. Des profils types des syndromes douloureux neuropathiques les plus courants ont été établis dans le cadre d’une étude multicentrique [15].
La QST est également utilisée dans des études sur la fibromyalgie et la pathologie des petites fibres. Il a été démontré que les résultats du QST et l’examen neurologique clinique diffèrent entre les patients atteints du syndrome de fibromyalgie (FMS) et ceux atteints de SFN idiopathique [31]. La question de la “poule et de l’œuf” se pose pour la fibromyalgie. On ne sait pas si ces mécanismes contribuent à la physiopathologie du SFM ou s’ils sont des conséquences du SFM ou de ses comorbidités. Des recherches sont nécessaires pour identifier les sous-groupes et développer des thérapies spécifiques à ces sous-groupes.
Thérapie basée sur les mécanismes
Le concept de thérapie basée sur les mécanismes repose sur l’hypothèse que les différentes plaintes de douleurs neuropathiques sont dues à différents mécanismes biologiques et nécessitent une thérapie spécifique qui doit être exactement adaptée aux besoins du patient [8]. L’objectif de l’examen QST est d’établir un modèle du profil de la douleur, qui permette de tirer des conclusions sur les mécanismes pathophysiologiques sous-jacents probables et donc de tirer des conclusions sur le concept de traitement du patient concerné [15]. Ce concept n’a pas pu être mis en œuvre jusqu’à présent.
L’une des maladies les plus étudiées pour vérifier la faisabilité du concept de thérapie basée sur les mécanismes est la neuropathie diabétique. Les résultats soulèvent plus de nouvelles questions qu’ils n’en résolvent. Raputova et al. ont constaté que le profil QST et la densité des fibres nerveuses intraépidermiques ne sont pas des valeurs prédictives de la survenue de douleurs chez les patients atteints de polyneuropathie diabétique [32]. Pendant ce temps, Segerdahl et al. montrent que les paramètres QST diffèrent entre les patients avec et sans douleur neuropathique [33]. Les patients atteints de neuropathie diabétique douloureuse et de nocicepteurs irritables génétiquement prouvés par mutation du canal sodique (NaV1.7) présentent des profils sensoriels QST moins remarquables que ceux des patients sans mutation, ce qui soulève des questions quant à la pertinence mécanique des profils QST [34]. Le profil QST ne permet pas de conclure au succès du traitement (par exemple, réponse à l’oxcarbazapine en cas de douleurs neuropathiques dans le cadre d’une neuropathie diabétique) [35].
L’espoir de se rapprocher du concept de thérapie basée sur les mécanismes grâce aux profils QST nécessite des recherches cliniques supplémentaires. C’est la raison pour laquelle nous espérons pouvoir offrir à l’avenir de nouvelles possibilités de traitement aux patients, qui sont souvent gravement et durablement affectés. Il ne faut pas oublier que l’apparition de douleurs neuropathiques ne repose pas uniquement sur des modifications biologiques, mais qu’elle comporte également des aspects psychosociaux.
Messages Take-Home
- Le test sensoriel quantitatif est un examen standardisé et formalisé, non invasif, de la fonction de l’ensemble du système somatosensoriel, y compris les fibres nerveuses de petit calibre.
- Ce test permet de détecter les signes positifs et négatifs sensibles, contrairement à l’électrophysiologie conventionnelle (par ex. la neurographie) qui se limite au déficit fonctionnel.
- La QST est une procédure psychophysique qui requiert la coopération du patient.
Littérature :
- Finnerup NB, et al : Neuropathic pain : an updated grading system for research and clinical practice. Pain 2016 ; 157(8) : 1599-1606.
- Treede RD, et al : Neuropathic pain : redefinition and a grading system for clinical and research purposes. Neurology 2008 ; 70(18) : 1630-1635.
- Schlereth T, et al. : Diagnostic et traitement non interventionnel des douleurs neuropathiques, ligne directrice S2k 2019 ; in : Deutsche Gesellschaft für Neurologie (éd.), Guidelines for Diagnostic and Therapy in the Neurology.
- Rolke R, et al : Quantitative sensory testing in the German Research Network on Neuropathic Pain (DFNS) : standardised protocol and reference values. Pain 2006 ; 123 : 231-243.
- Ahcan U, et al : Composition des fibres nerveuses de la branche cutanée palmaire du nerf médian et implications cliniques. Br J Plast Surg 2003 Dec ; 56(8) : 791-796.
- Hines AE, et al. : Composition du type de fibres des branches articulaires du nerf tibial au niveau de l’articulation du genou chez l’homme. Anat Rec 1996 Dec ; 246(4) : 573-578.
- Klinke, Pape, Kurtz, Silbernagl : Physiologie, Thieme, 2009.
- Baron R, et al : Douleur et QST : “mesurer ce qui est mesurable”. Douleur 2009 fév ; 23(1) : 5-6 ; doi : 10.1007/s00482-009-0775-8.
- Julius D, et al : Mécanismes moléculaires de la nociception. Nature 2001 Sep 13 ; 413(6852) : 203-210.
- Magerl W, et al : Données de référence pour les tests sensoriels quantitatifs (QST) : stratification affinée pour l’âge et une nouvelle méthode de comparaison statistique des données de groupe. Douleur 2010 ; 151 : 598-605.
- Geber C, et al. : Test-retest et fiabilité interobservateur du test sensoriel quantitatif selon le protocole du Réseau allemand de recherche sur la douleur neuropathique (DFNS) : une étude multicentrique. Pain 2011 Mar ; 152(3) : 548-556.
- Pfau DB, et al : Quantitative sensory testing in the German Research Network on Neuropathic Pain (DFNS) : reference data for the trunk and application in patients with chronic postherpetic neuralgia. Pain 2014 May ; 155(5) : 1002-1015 ; doi : 10.1016/j.pain.2014.02.004. Epub 2014 Feb 10.
- Gröne E, et al : Test order of quantitative sensory testing facilitates mechanical hyperalgesia in healthy volunteers. J Pain 2012 Jan ; 13(1) : 73-80. doi : 10.1016
- Mücke M, et al : Test sensoriel quantitatif. Douleur 2014 Dec ; 28(6) : 635-646.
- Maier C, et al : Quantitative sensory testing in the German Research Network on Neuropathic Pain (DFNS) : somatosensory abnormalities in 1236 patients with different neuropathic pain syndromes. Pain 2010 Sep ; 150(3) : 439-450.
- Rolke R : Test sensoriel quantitatif : diagnostic basé sur les mécanismes des syndromes douloureux chroniques. Habilitations à diriger des recherches, édition personnelle Mayence 2010.
- Dimova V, et al. : Utiliser une batterie de tests sensoriels quantitatifs cliniques standardisés pour juger de la pertinence clinique des différences sensorielles entre les zones corporelles adjacentes. Clin J Pain 2017 Jan ; 33(1) : 37-43.
- 18. Scherens A, et al. : Painful or painless lower limb dysesthesias are highly predictive of peripheral neuropathy : comparison of different diagnostic modalities. Eur J Pain 2009 Aug ; 13(7) : 711-718 ; doi : 10.1016.
- Krumova EK, et al : Douleur neuropathique : le test sensoriel quantitatif est-il utile ? Curr Diab Rep 2012 Aug ; 12(4) : 393-402 ; doi : 10.1007/s11892-012-0282-7.
- Devigili G, et al : Les critères de diagnostic de la neuropathie des petites fibres : des symptômes à la neuropathologie. Brain 2008 Jul ; 131(Pt 7) : 1912-1925 ; doi : 10.1093.
- Mense SS, et al : Functional neuroanatomy for pain stimuli. Réception, transmission et traitement. Douleur 2004 juin ; 18(3) : 225-237.
- Treede RD et al : Hyperalgésie et allodynie : taxonomie, évaluation, et mécanismes. Dans : Brune K, Handwerker HO (eds) : Hyperalgesia : molecular mechanisms and clinical implications. IASP Press, Seattle 2004 ; 991-1015.
- Gracely RH, et al : Evoked pain measures in fibromyalgia. Best Pract Res Clin Rheumatol 2003 Aug ; 17(4) : 593-609.
- Blackmore D, et al : Critères de diagnostic de la neuropathie à petites fibres. J Clin Neuromuscul Dis 2017 Mar ; 18(3) : 125-131.
- Pfau DB, et al. : Performance technique et clinique de l’appareil de test thermique “Q-Sense” pour évaluer la fonction des petites fibres : une comparaison tête-bêche avec le “Thermal Sensory Analyzer” TSA chez des patients diabétiques et des volontaires sains. Eur J Pain 2019 Nov ; 23(10) : 1863-1878.
- Ekman L, et al : Evaluation of small nerve fiber dysfunction in type 2 diabetes. Acta Neurol Scand 2020 Jan ; 141(1) : 38-46.
- Hartmann A, et al : Profiling intraoral neuropathic disturbances following lingual nerve injury and in burning mouth syndrome. BMC Oral Health 2017 Mar 23 ; 17(1) : 68.
- Roldan CJ, et al : Les inhibiteurs de l’enzyme de conversion de l’angiotensine et les bloqueurs du récepteur de l’angiotensine modifient la fonction des fibres myélinisées après une chimiothérapie : une étude de test sensoriel quantitatif. Pain Physician 2017 May ; 20(4) : 281-292.
- Georgopoulos V, et al : Quantitative sensory testing and predicting outcomes for musculoskeletal pain, disability, and negative affect : a systematic review and meta-analysis. Pain 2019 Sep ; 160(9) : 1920-1932.
- Huber JL, et al : Récupération des seuils de détection mécanique après réparation directe du nerf digital versus implantation d’un conduit. J Hand Surg Eur 2017 Sep ; 42(7) : 720-730.
- Üceyler N, et al : Small fibre pathology in patients with fibromyalgia syndrome. Brain 2013 Jun ; 136(Pt 6) : 1857-1867.
- Raputova J, et al : Phénotype sensoriel et facteurs de risque pour la neuropathie diabétique douloureuse : une étude observationnelle transversale. Pain 2017 Dec ; 158(12) : 2340-2353.
- Segerdahl AR, et al : Un mécanisme de facilitation de la douleur basé sur le cerveau contribue à la polyneuropathie diabétique douloureuse. Brain 2018 Feb 1 ; 141(2) : 357-364.
- Blesneac I, et al : Variants rares du NaV1.7 associés à une neuropathie périphérique diabétique douloureuse. Pain 2018 Mar ; 159(3) : 469-480.
- Gierthmühlen J, et al : Can self-reported pain characteristics and bedside test be used for the assessment of pain mechanisms ? An analysis of results of neuropathic pain questionnaires and quantitative sensory testing. Pain 2019 Sep ; 160(9) : 2093-2104.
InFo DOULEUR & GERIATRIE 2020 ; 2(1) : 6-11