Pour la majorité des personnes atteintes de mélanome, il existe aujourd’hui des traitements beaucoup plus efficaces qu’il y a quelques années. Cela vaut également pour le traitement adjuvant du mélanome. De nombreuses nouvelles approches thérapeutiques ont été établies et sont progressivement étudiées dans le cadre d’études de plus ou moins grande envergure. Il s’agit notamment de l’analyse intérimaire présentée à l’occasion de la réunion annuelle de l’ADF de cette année.
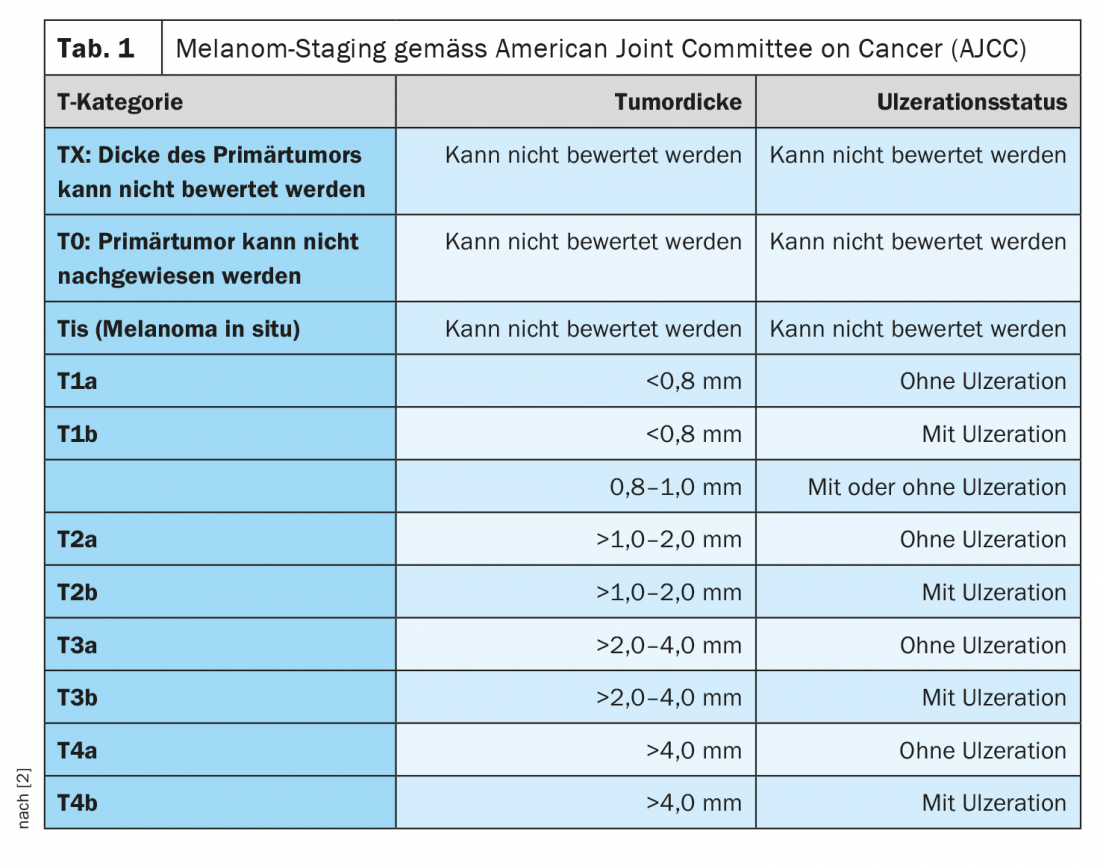
Chaque année, on estime que près de 200 000 personnes dans le monde développent un mélanome malin [1]. L’incidence a augmenté de manière constante au cours des dernières décennies. L’âge moyen de survenue de la maladie est d’environ 60 ans pour les femmes et 64 ans pour les hommes. La classification et la stadification du mélanome malin sont actuellement basées sur la huitième édition de la classification AJCC (tableau 1) [2]. Outre l’épaisseur de la tumeur selon la classification de Breslow au moment du diagnostic initial, la présence d’ulcérations et l’atteinte des ganglions lymphatiques sont considérées comme des critères pronostiques importants [1]. Jusqu’à il y a quelques années, le traitement des mélanomes avancés et métastatiques était palliatif, avec une durée de survie moyenne de 6 à 12 mois. La norme thérapeutique était la chimiothérapie. La mise sur le marché d’options thérapeutiques très efficaces dans le domaine des inhibiteurs de points de contrôle et des inhibiteurs de kinases ciblés tels que les inhibiteurs de BRAF et de MEK a permis d’améliorer considérablement l’espérance de vie des patients atteints de mélanome complètement réséqué.
Les inhibiteurs de points de contrôle étaient les pionniers – qu’en est-il aujourd’hui ?
Depuis la mise sur le marché de l’ipilimumab en 2011, de nouveaux progrès ont été réalisés dans le domaine de l’immunothérapie des patients atteints de mélanome. En ce qui concerne le traitement adjuvant, cela est notamment documenté par l’étude KEYNOTE-054 [3], dans laquelle le nivolumab a montré un avantage significatif en termes de survie sans récidive par rapport à l’ipilimumab. Et dans l’étude Checkmate-238, le pembrolizumab s’est révélé supérieur au placebo en termes de survie sans récidive [4]. La réduction du risque était de 35% pour le nivolumab par rapport à l’ipilimumab et de 43% pour le pembrolizumab par rapport au placebo. L’étude randomisée menée avec nivolumab versus ipilimumab a également montré une amélioration significative de la survie sans métastases à distance (HR 0,73, IC 95% : 0,55-0,95]. En ce qui concerne le profil bénéfice/risque, le guide actuel de l’AWMF estime que, malgré le risque latent d’effets secondaires potentiellement graves, le bénéfice d’une réduction du risque plaide en faveur de l’utilisation de cette option thérapeutique. [5].
Les inhibiteurs de BRAF et de MEK élargissent la gamme des substances hautement efficaces
En ce qui concerne le traitement adjuvant avec des inhibiteurs de BRAF et de MEK- , la ligne directrice S3 actuelle mentionne entre autres une étude de phase III randomisée, contrôlée et en double aveugle sur le dabrafenib/trametinib. est appelé. Patients de stade IIIA (diamètre minimum dans le ganglion lymphatique affecté >1 mm) à IIIC avec un BRAFV600E ou de la mutation V600K ont reçu pendant 12 mois au total du dabrafenib 150 mg 2 fois par jour et du trametinib 2 mg 1 fois par jour, ou un traitement placebo comparable [6]. Après un suivi médian de 2,8 ans, la probabilité de survie sans récidive à 3 ans était de 58% pour le bras traité et de 39% pour le bras placebo (HR pour la récidive ou le décès 0,47 ; IC à 95% : 0,39-0,58 ; p<0,001). Selon l’évaluation de la ligne directrice S3 actuelle, l’utilisation de ces options thérapeutiques doit être encouragée malgré un taux d’interruption relativement élevé dû aux effets secondaires, compte tenu du bénéfice démontré : réduction du risque de 53% pour la survie sans récidive et de 43% pour le décès lié au mélanome.
Résultats intermédiaires d’un ensemble de données suprarégionales de la région DACH
Dans le cadre de la réunion annuelle de l’ADF de cette année, des données ont été présentées à partir d’une analyse intermédiaire d’une étude rétrospective dans laquelle des patients atteints de mélanome en Allemagne, en Autriche et en Suisse (DACH) ont reçu du pembrolizumab et du nivolumab (anti PD-1) ou du dabrafenib/trametinib (inhibition de BRAF/MEK) en tant que traitement adjuvant entre 1/2017 et 2/2020 [7]. En septembre 2020, les données de 524 patients sur un total de 1039 participants à l’étude ont été analysées. Les deux options de traitement adjuvant ont été comparées en termes de PFS à 12 mois et d’autres paramètres de résultats pertinents.
Les caractéristiques des patients des sous-populations traitées par inhibition de BRAF/MEK vs. traitement anti-PD1 étaient comparables en termes de variables démographiques et de caractéristiques tumorales. La majorité des patients ont reçu un traitement PD1 adjuvant (n=439 ; 83,8% ; Nivo=69,2% ; Pembro=30,8%). La période de suivi moyenne était de 13,1 mois. L’intervalle de temps entre la résection complète et le début du traitement adjuvant était de 2,5 mois (SD=1,55) pour l’inhibition BRAF/MEK et de 2,7 mois (SD=2,62) pour le traitement anti-PD1. La durée moyenne du traitement s’est étendue à 7,4 mois (SD=4,4) pour les deux régimes de traitement. Les analyses statistiques ont montré une SSP à 12 mois de 81,2% pour le sous-groupe anti-PD1 et de 90,4% pour les participants à l’étude traités par inhibition BRAF/MEK (OR 2,001 ; IC à 95% : 1,045-3,830 ; p=0,036). Aucune différence en termes de PFS n’a été observée entre les patients recevant le nivolumab et ceux recevant le pembrolizumab.
Dans le groupe traité par inhibition de BRAF/MEK comme dans le groupe traité par anti-PD1, les ulcères, l’épaisseur de la tumeur et l’atteinte métastatique plus importante des ganglions lymphatiques étaient des prédicteurs négatifs de la PFS. Les prédicteurs positifs d’une PFS plus favorable chez les patients sous traitement par inhibiteurs BRAF/MEK étaient un IMC plus élevé (25-30) et le sexe masculin. La PFS ne différait pas en fonction de la dissection complète du ganglion lymphatique vs. la biopsie du ganglion lymphatique sentinelle.

Le profil de sécurité de toutes les substances actives étudiées s’est révélé comparable à celui des études précédentes. Le taux d’effets indésirables liés au médicament (drAE, “drug associated adverse events”) et d’effets indésirables liés à l’immunité était similaire sous nivolumab par rapport au pembrolizumab (64,2-63,7% et 33,3-33,8% respectivement). Chez les patients traités par inhibition BRAF/MEK, la proportion de drAE était de 87% dans cette étude. Les auteurs ne donnent pas de détails sur la nature des effets secondaires. D’autres analyses sont prévues afin d’en savoir plus sur les caractéristiques des patients et des tumeurs qui sont en corrélation avec une réponse favorable à l’inhibition des anti-PD1 par rapport à l’inhibition des BRAF/MEK en tant que régime thérapeutique adjuvant.
Congrès : Groupe de travail sur la recherche dermatologique 2021
Littérature :
- Lamos C, Hunger RE : Inhibiteurs de points de contrôle – Indication et utilisation chez les patients atteints de mélanome [Checkpoint inhibitors-indications and application in melanoma patients]. Z Rheumatol 2020;79(8) : 818-825.
- Gershenwald JE, et al ; pour les membres du panel d’experts du Comité mixte américain sur le cancer du mélanome et la Plateforme internationale de découverte et de base de données sur le mélanome. Melanoma staging : Evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer J Clin 2017 ; 67(6) : 472-492.
- Weber J, et al : Adjuvant nivolumab versus ipilimumab dans le mélanome de stade III ou IV réséqué. N Engl J Med 2017 ; 377(19) : 1824-1835.
- Eggermont AMM, et al : Adjuvant pembrolizumab versus placebo dans le mélanome de stade III réséqué. N Engl J Med 2018 ; 378(19) : 1789-1801.
- AWMF : S3-Leitlinie zur Diagnostik, Therapie und Nachsorge des Melanoms Version 3.3 – Juillet 2020 Numéro de registre AWMF : 032/024OL
- Long GV, et al : Adjuvant dabrafenib plus trametinib dans le mélanome stade III BRAF-muté. N Engl J Med 2017 ; 377(19) : 1813-1823.
- Schumann K, et al. : P048 Adjuvant melanoma treatment : real-world data from the DACH region, 47th Annual Meeting of the Arbeitsgemeinschaft Dermatologische Forschung (ADF) Virtual, 04.03.-06.03.2021
- Schadendorf D, et al : Mélanome. Lancet 2018 ; 392 : 971-984.
- Arozarena I, Wellbrock C : Surmonter la résistance aux inhibiteurs de BRAF. Ann Transl Med 2017 ; 5 : 387
DERMATOLOGIE PRAXIS 2021 ; 31(4) : 44-45 (publié le 18.8.21 ; ahead of print)