Les procédures de résection dans le traitement du lymphœdème sont en cours de développement depuis le début du siècle dernier. Ils sont invasifs et présentent des complications. Avec le développement de la microchirurgie, les anastomoses lymphoveineuses jouent un rôle important dans l’amélioration de la qualité de vie des patients.
Les procédures de résection dans le traitement du lymphœdème sont des méthodes qui éliminent chirurgicalement un excès de tissu. Différentes procédures, parfois historiques, ont été décrites à partir de la fin du 19e siècle pour le traitement chirurgical du lymphœdème (tab. 1).
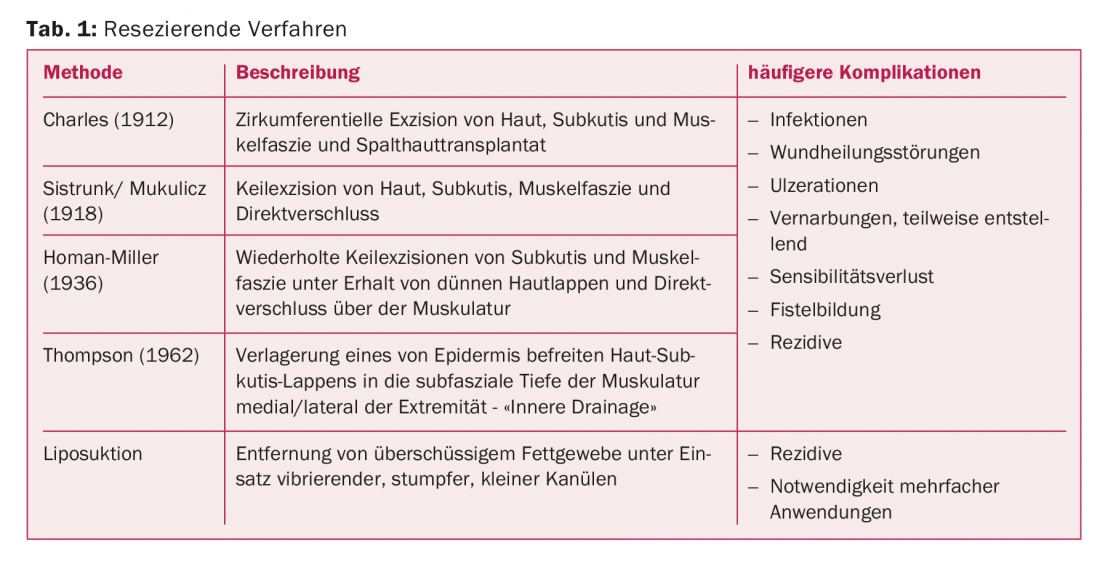
En 1912, la procédure Charles a été développée, dans laquelle la peau, l’hypoderme et le fascia musculaire sont excisés de manière circonférentielle et recouverts de peau fendue [1]. Selon Sistrunk, les excisions cœliques de la peau, de l’hypoderme et des fascias musculaires sont réalisées avec une fermeture directe, la procédure de Homan étant la première à épargner la peau et à la fermer sur le défaut tissulaire réséqué [2]. Cette procédure est répétée autant de fois que nécessaire jusqu’à ce que le périmètre souhaité soit atteint. L’idée de relier les voies lymphatiques superficielles et profondes a été établie pour la première fois en 1962, lorsque Thompson a réséqué du tissu sous-cutané et a déplacé un mince lambeau sous-cutané désépithélialisé dans la profondeur sous-fasciale des muscles. Il en résulte non seulement des cicatrices défigurantes, mais aussi souvent des fistules lymphatiques et des sinusoïdes pilonidales [3].
Les procédures de résection compliquent souvent le processus de guérison en raison des infections et de l’apparition de cicatrices instables. Ces méthodes doivent être recherchées en cas d’invalidité et d’échec thérapeutique au stade final du lymphœdème et peuvent augmenter l’efficacité des thérapies causales en réduisant ce que l’on appelle la “charge lymphatique”. Elles peuvent être combinées avec des méthodes de reconstruction. En cas d’œdème génital, ces procédures sont souvent envisagées plus tôt.
Liposuccion
La liposuccion est une procédure de résection spéciale qui peut conduire efficacement à une réduction du volume du lymphœdème des membres. La liposuccion est l’aspiration de l’excès de tissu adipeux à l’aide de canules vibrantes, émoussées et de petite taille. La transformation du lymphœdème en tissu adipeux (appelée transformation graisseuse) se produit très souvent à un stade ultérieur de la maladie. Le chirurgien suédois Hakan Brorson a été le pionnier de la liposuccion dans le lymphœdème des membres et a publié des résultats prometteurs ces dernières années. Dans une étude prospective portant sur 56 patients atteints de lymphœdème (29 primaires, 27 secondaires après un traitement anticancéreux), la circonférence du membre inférieur traité par liposuccion était toujours significativement alignée sur le côté sain après dix ans [4]. Les personnes concernées ont toutefois continué à porter des bas de compression en permanence. Dans une autre étude prospective portant sur 146 patientes atteintes d’un cancer du sein et ayant développé un lymphœdème du membre supérieur, l’excès de volume a été efficacement éliminé et le périmètre réduit du membre a pu être maintenu à long terme grâce au port systématique de bas de contention [5]. Une grande étude par sondage a révélé une grande satisfaction psychologique et physique chez les personnes traitées [6].
Le risque de lésion supplémentaire des vaisseaux lymphatiques par la liposuccion n’a pas encore été observé expérimentalement ou cliniquement. Les examens anatomiques après aspiration dans le sens de la longueur des membres n’ont pas permis de mettre en évidence de lésions des vaisseaux lymphatiques épifasciaux. En règle générale, on n’aspire pas plus de quatre litres de graisse par intervention, afin d’éviter les problèmes de circulation et les décalages électrolytiques. Plusieurs interventions peuvent être nécessaires.
Anastomoses lymphoveineuses (LVA)
Alors que l’intérêt pour le rôle du système lymphatique dans les processus physiologiques et pathologiques s’est accru au cours des dernières années, les connaissances sur le système lymphatique restent limitées par rapport aux connaissances sur le système cardiovasculaire. Les mécanismes pathologiques du lymphœdème font aujourd’hui l’objet de recherches croissantes et les possibilités de traitement chirurgical ne cessent de s’étendre. Pour rétablir le drainage lymphatique de manière physiologique, des anastomoses lymphoveineuses, qui permettent le drainage lymphatique de manière extra-anatomique, sont réalisées par super-microchirurgie. La supermicrochirurgie est une nouvelle technique et un développement de la microchirurgie qui permet de disséquer et de suturer entre eux de très petits vaisseaux d’un diamètre inférieur à 1 mm (0,3-0,8 mm). Des instruments chirurgicaux très fins sont spécialement fabriqués et des microscopes d’un grossissement jusqu’à 40 fois sont utilisés. Des sutures très fines sont utilisées, d’une épaisseur de 12-0 selon la classification USP (< 0,1 mm d’épaisseur de fil). La mise en place de ces anastomoses délicates se fait généralement sous anesthésie générale pour un meilleur confort du patient, mais elle est en principe également possible sous anesthésie locale.
Les vaisseaux lymphatiques eux-mêmes sont globalement difficiles à visualiser, car ils sont de petit calibre et transportent principalement du liquide lymphatique clair et presque exempt de cellules. La plupart des techniques de visualisation reposent sur la capacité naturelle des vaisseaux lymphatiques à absorber les traceurs injectés dans l’espace tissulaire. Le traceur est ensuite transporté et concentré dans le vaisseau lymphatique, ce qui permet différentes modalités d’imagerie.
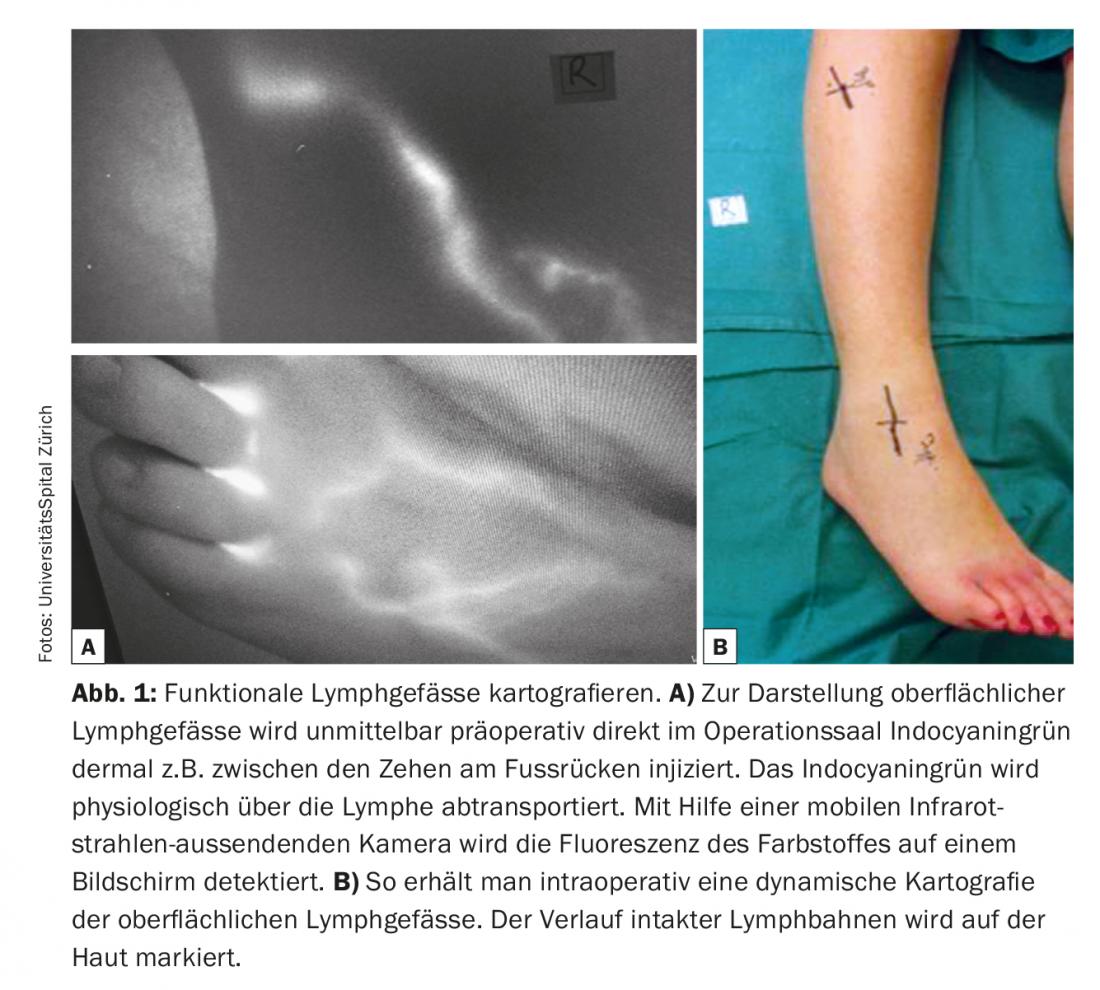
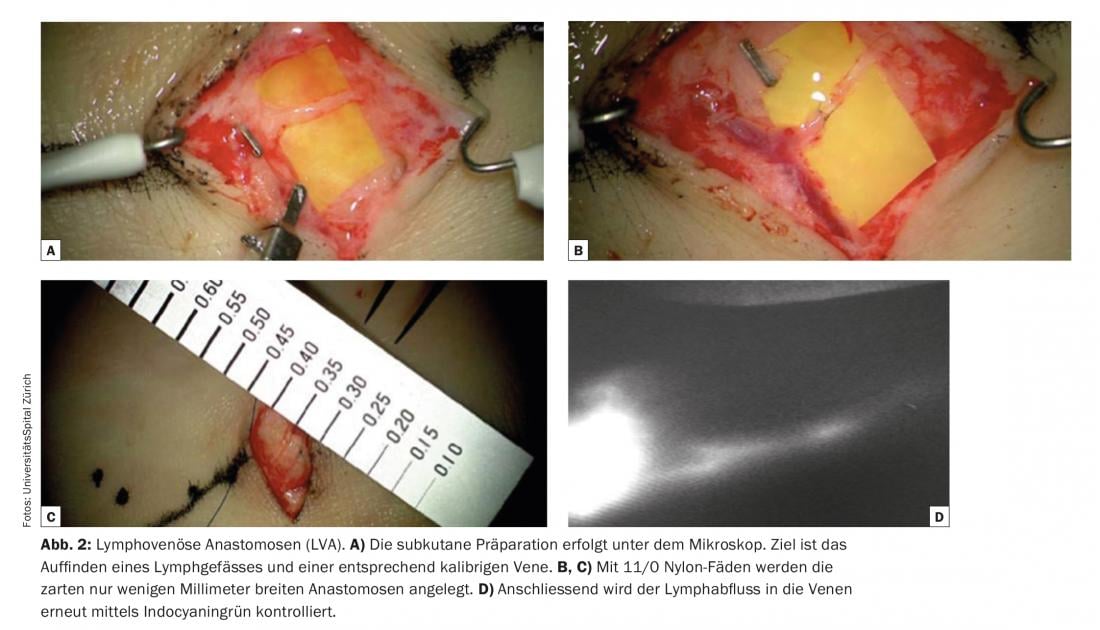
L’une des conditions élémentaires de réussite des anastomoses lymphoveineuses est l’identification de vaisseaux lymphatiques appropriés qui ne sont pas fibrotiques, mais qui ont une grande capacité de transport. La lymphangiographie au vert d’indocyanine (ICG) est actuellement utilisée comme une technique relativement simple et rapidement informative pour la visualisation des vaisseaux lymphatiques. Dans les vaisseaux lymphatiques fonctionnels – par exemple ceux des extrémités – le vert d’indocyanine est rapidement absorbé et rapidement transporté dans des canaux lymphatiques linéaires vers l’aine ou l’aisselle. Il est même souvent possible d’observer le péristaltisme. L’ICG est utilisée comme un moyen de navigation pré- et peropératoire pratique et économique. Le vert d’indocyanine est injecté en salle d’opération juste avant l’opération pour visualiser les vaisseaux lymphatiques superficiels, par exemple entre les orteils sur le dos du pied, et pour marquer le trajet des voies lymphatiques sur la peau. (Fig. 1). La préparation sous-cutanée est effectuée sous le microscope (Fig. 2). L’objectif est de localiser un vaisseau lymphatique et une veine calibrée correspondante. Des anastomoses sont réalisées avec des fils de nylon 11/0 ou 12/0. Ensuite, le drainage lymphatique dans la veine est à nouveau contrôlé par ICG. Il arrive souvent que des vaisseaux lymphatiques supplémentaires, qui n’ont pas été visualisés et enregistrés par l’ICG en préopératoire, ne soient détectés qu’en peropératoire dans une région chirurgicale donnée. Ces vaisseaux supplémentaires sont souvent plus grands et d’un diamètre presque approprié. Le drainage lymphatique est parfois visible à l’œil nu. Ces vaisseaux lymphatiques dits ICG-négatifs sont de plus en plus utilisés pour générer des anastomoses supplémentaires dans le site chirurgical et potentialiser la fonction de drainage.
Jusqu’à présent, ces observations cliniques n’ont pas été décrites dans la littérature. Dans l’ensemble, la recherche expérimentale dans ce domaine est très limitée. Les fonctions de transport différentiel entre deux vaisseaux de collecte ont été démontrées dans un modèle de rat [7]. On suppose qu’il existe des schémas de drainage lymphatique préférentiels, de sorte que pour un espace tissulaire donné, le drainage lymphatique est la responsabilité principale d’un seul vaisseau, tandis que tous les vaisseaux supplémentaires dans la zone ne servent qu’en cas de surcharge du système ou comme voie de transport de réserve pour les charges lymphatiques importantes [7]. Les différences de profondeur et de diamètre des vaisseaux peuvent favoriser l’écoulement de la lymphe via un vaisseau lymphatique donné [7]. Les effets du vert d’indocyanine sur la contractilité lymphatique normale et la fonction de drainage peuvent également entraîner un artefact significatif [8].
L’identification des petites veines est également problématique chez les patients atteints de lymphœdème, car la graisse sous-cutanée est souvent épaissie et le tissu fibrotique. Une veine appropriée doit être présente à proximité immédiate d’un vaisseau lymphatique fonctionnel détecté. Les systèmes de visualisation sans contact pour l’identification préopératoire des veinules sous-cutanées d’un diamètre d’environ 0,5-1,0 mm sont décrits dans la littérature comme prometteurs [9].
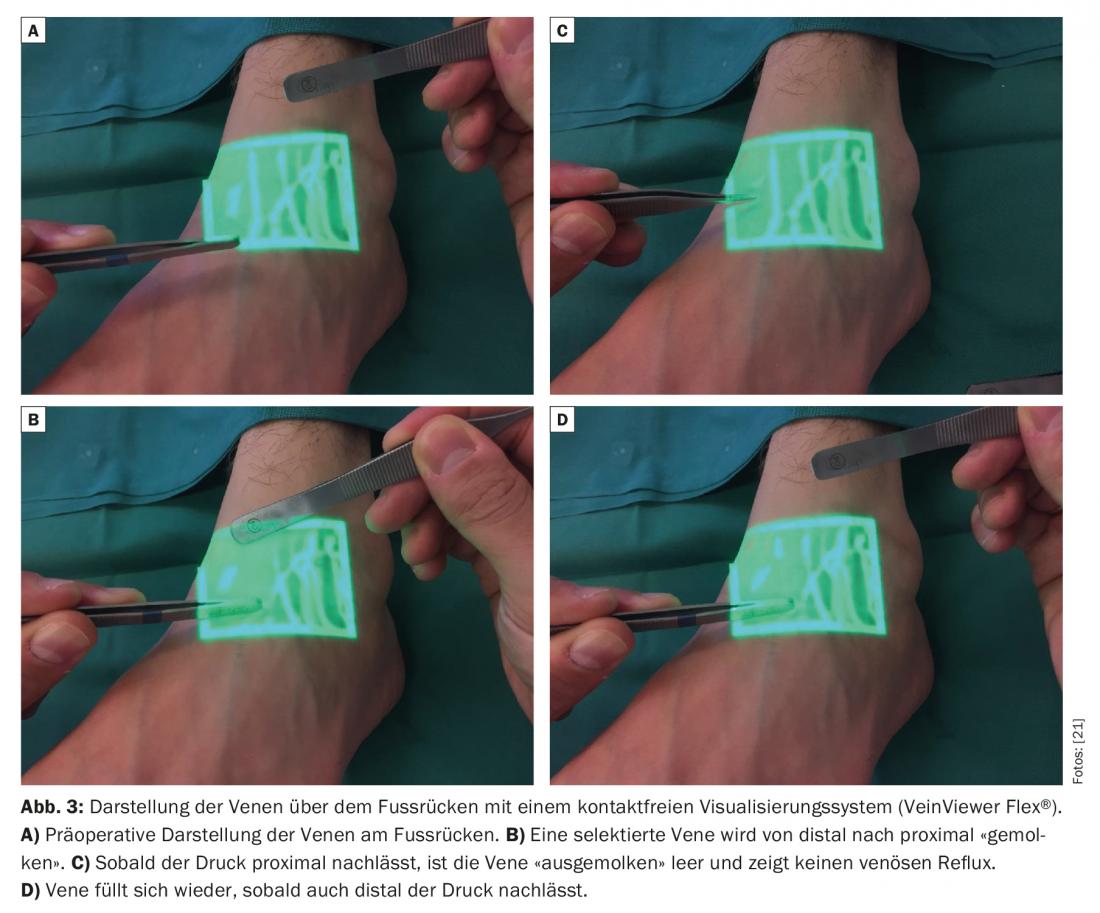
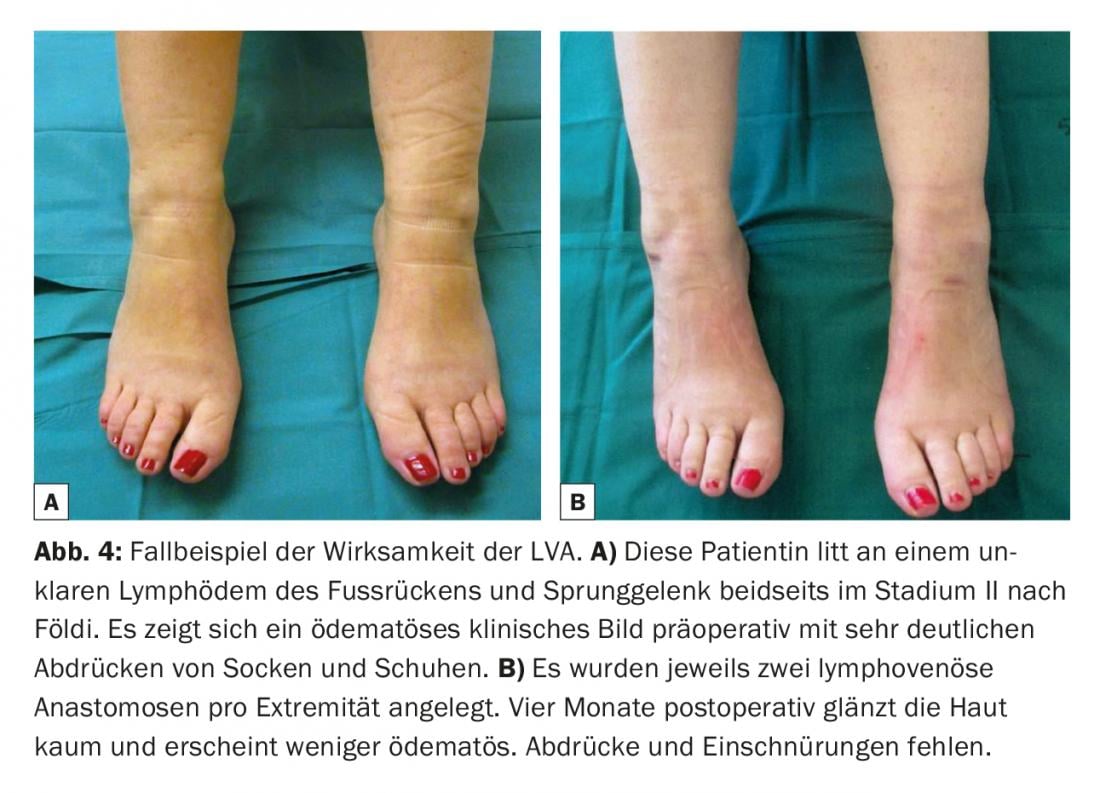
La pression veineuse est généralement plus élevée que dans le système lymphatique [10,11]. L’absence de reflux veineux est donc également d’une importance élémentaire. Si la veine présente un système valvulaire inadapté ou un trajet défavorable, il peut y avoir un retour veineux dans le vaisseau lymphatique. Ainsi, les thromboses et les fibroses des anastomoses peuvent limiter considérablement la longévité des anastomoses [12]. Les systèmes de visualisation sans contact standard sont donc de plus en plus utilisés pour obtenir une cartographie veineuse rapide et identifier les bifurcations cachées et les valvules mal situées dans les veines, qui pourraient avoir un impact négatif sur la qualité des anastomoses lymphoveineuses réalisées. (Fig.3). Un léger bandage de compression est porté en postopératoire afin de ne pas compromettre les anastomoses fragiles nouvellement créées. Les patients restent hospitalisés une nuit. Les modifications cutanées chez les survivantes du cancer du sein présentant un lymphœdème des membres supérieurs ont ainsi pu être réduites [13]. De nombreuses études cliniques décrivent une réduction de la circonférence de 35% à 50% un an après la pose de ces anastomoses chez des patientes atteintes d’un cancer du sein et présentant un lymphœdème du bras [14–16]. La divergence de ces résultats résulte le plus souvent des résultats rétrospectifs obtenus sur un petit nombre de cas. Dans une étude prospective plus large portant sur 100 cas, les scientifiques ont récemment constaté une réduction de la circonférence allant jusqu’à 38% après trois ans et ont montré qu’il y avait également un soulagement subjectif significatif des symptômes [17]. Les douleurs associées au lymphœdème ont été soulagées [18]. Dans une autre étude clinique portant sur 49 patientes souffrant d’un lymphœdème secondaire des membres inférieurs, il a été constaté que l’association d’anastomoses lymphoveineuses et d’une liposuccion permettait également de réduire significativement la texture de la peau ainsi que son volume [19]. Dans l’ensemble, il est postulé que l’efficacité de l’AVP est accrue pour les stades précoces (Fig. 4). Dans la littérature, il existe des descriptions de cas et des revues qui montrent que l’apparition d’un lymphœdème après lymphadénectomie peut être réduite de manière significative par la mise en place prophylactique d’anastomoses lymphoveineuses [20].
En résumé, les procédures de résection sont invasives, entraînent de nombreuses complications et ne peuvent être envisagées qu’au stade final de la maladie. La liposuccion constitue une procédure de résection particulière, car elle est moins invasive et donne d’excellents résultats dans de nombreuses études cliniques. Les procédures de résection peuvent dans certains cas être associées à la création d’anastomoses lymphoveineuses. La mise en place d’anastomoses lymphoveineuses est une procédure chirurgicale sûre à ce jour et montre, dans les études cliniques et expérimentales disponibles jusqu’à présent, des résultats améliorant la qualité de la peau et réduisant le volume, bien que des résultats à long terme soient encore attendus. Dans l’ensemble, des études expérimentales supplémentaires et des études cliniques prospectives à long terme portant sur un plus grand nombre de patients seront nécessaires à l’avenir pour mieux démontrer l’évidence de cette thérapie et pour optimiser continuellement la procédure sur le plan technique.
Les anastomoses lymphoveineuses sont reconnues internationalement comme faisant partie intégrante du traitement chirurgical du lymphœdème.
Messages Take-Home
- Les procédures de résection sont invasives et entraînent de nombreuses complications. Ils ne sont envisageables qu’au stade final de la maladie.
- La création d’anastomoses lymphoveineuses est une procédure chirurgicale sûre à ce jour et montre, dans les études cliniques et expérimentales disponibles, des résultats améliorant la qualité de la peau et réduisant le volume.
- Les anastomoses lymphoveineuses sont reconnues internationalement comme faisant partie intégrante du traitement chirurgical du lymphœdème.
Littérature :
- Charles H : Elephantiasis de la jambe. In : Latham A, English TC, editors. Un système de traitement. Vol. 3. Londres : Churchill 1912 : 516.
- Sistrunk WE : Contribution à la chirurgie plastique : élimination de cicatrices par étapes ; une opération ouverte pour une laceration étendue du sphincter anal ; l’opération de Kondoleon pour l’éléphantiasis. Ann surg 1927 ; 85 : 185-193.
- Thompson N : Buried dermal flap operation for chronic lymphedema of the extremitis. Plast Reconstr Surg 1970 ; 45 : 541-548.
- Brorson H : La liposuccion normalise l’hypertrophie des tissus adipeux induite par le lymphœdème dans l’éléphantiasis de la jambe. Plast Reconstr Surg 2015 ; 136 (4) : 133-134.
- Brorson H : Réduction complète de l’œdème lymphatique du bras après un cancer du sein – une étude prospective de vingt et un ans. Plast Reconstr Surg 2015 ; 136 (4) : 134-135.
- Hoffner M, et al : SF-36 Shows Increased Quality of Life Following Complete Reduction of Postmastectomy Lymphedema with Liposuction. Lymphat Res Biol 2017 ; 15 (1) : 87-98.
- Gashev AA et al. : Indocyanine Green and Lymphatic Imaging : Current Problems. Recherche et biologie lymphatique. 2010 ; 8 (2) : 127-130.
- Weiler M, Dixon JB : Fonction de transport différentielle des vaisseaux lymphatiques dans le modèle de queue de rat et les effets à long terme de l’indocyanine verte tels qu’ils sont évalués par imagerie proche de l’infrarouge. Frontiers in Physiology. 2013 ; 4 : 215.
- Makoto M, et al. : Lymphœdème du membre inférieur traité par anastomose veino-lymphatique sur la base de la lymphographie icg pré- et peropératoire et de la visualisation des veines sans contact : un rapport de cas. Microsurgery 2012 ; 32 : 227-230.
- Wardhan R, Shelley K : Forme d’onde de pression veineuse périphérique. Curr Opin Anaesthesiol 2009 ; 22 : 814-821
- Munn LL : Mécanobiologie des contractions lymphatiques. Semin Cell Dev Biol 2015 ; 38 : 67-74.
- Yamamoto T, Koshima I : Néo-valvuloplastie pour la supermicrosurgerie lymphatique. JPlast Reconstr Aesthet Surg 2014 ; 67 : 587-588.
- Jeremy ST, et al : Lymphaticovenous bypass decreases pathologic skin changes in upper extremity breast cancer rel. Lymphœdème. Lymphatic Res Biol. 2015 ; 13 : 46-53.
- Koshima I, et al. : Anastomose lymphatico-veineuse supermicroscopique pour le traitement du lymphœdème des membres supérieurs. J Reconstr Microsurg 2000 ; 16 : 437-442
- Furukawa H, et al. : Implantation veineuse lymphatique microscopique ciblant le flux de retour lymphatique dermique à l’aide de la lymphographie à fluorescence verte indocyanine dans le traitement du lymphœdème post-mastectomie. Plast Reconstr Surg 2011 ; 127 : 1804-1811.
- Chang DW : Lymphaticovenular bypass for lymphedema management in breast cancer patients : A prospective study. Plast Reconstr Surg 2010 ; 126 : 752-758.
- Chang DW, et al : A prospectove analysis of 100 consecutive lymphovenous bypass cases for treatment of extremity lymphedema. Plastic Reconst Surg 2013 ; 132 : 1305-1314.
- Mihara M, et al : L’anastomose veineuse lymphatique libère la douleur associée au lymphœdème de l’extrémité inférieure. Plast Reconst Surg Global Open. 2017 ; 5 (1) : e1205.
- Chang K1, et al : Liposuccion combinée à une anastomose lymphatico-veineuse pour le traitement du lymphœdème secondaire des membres inférieurs : un rapport de 49 cas. Zhonghua Wai Ke Za Zhi 2017 ; 55 (4) : 274-278.
- Jorgensen MG, et al : L’effet de l’anastomose lymphoveineuse prophylactique et des shunts pour prévenir le lymphœdème cancéreux : une revue systématique et une méta-analyse. Microsurg 2017 ; 00 : 1-10.
- Scaglioni M, et al. : Optimiser les résultats de la supermicrosurgery de l’anastomose veineuse lymphatique (LVA) par l’identification préopératoire de la veine sans reflux : choisir la veine avec soin. Manuscrit soumis à Microsurgery, 2017.
CARDIOVASC 2017 ; 16(5) : 11-15











