Pour certains types de tumeurs et pour les tumeurs malignes avec une carcinomatose péritonéale limitée, il est possible d’adopter une approche curative en combinant la chirurgie cytoréductrice et la chimiothérapie intrapéritonéale hyperthermique (CRS/HIPEC), même à ce stade de la maladie. L’indication doit toutefois être posée avec beaucoup de soin et de sélectivité. Pour l’évaluation définitive de la résécabilité des tumeurs malignes, une laparoscopie est généralement recommandée. Dans les tumeurs de l’appendice, le cancer du côlon et le mésothéliome péritonéal primaire, la survie à 5 ans peut être améliorée par la CRS/HIPEC.
La carcinomatose péritonéale est une manifestation tumorale avancée de nombreuses tumeurs gastro-intestinales, par exemple de l’appendice, du côlon, de l’estomac ou de l’ovaire, mais aussi de tumeurs du système hépatobiliaire et du pancréas. Les tumeurs péritonéales primaires, telles que les mésothéliomes péritonéaux primaires provenant du mésothélium du péritoine, sont extrêmement rares. Certains types de tumeurs, par exemple les tumeurs appendiculaires de faible malignité, évoluent certes de manière progressive, mais généralement lentement et de manière limitée à l’abdomen ; une carcinomatose dans le cas d’un cancer du pancréas ou de l’estomac évolue en revanche rapidement, inclut généralement le compartiment lymphatique et est souvent résistante au traitement. L’éventail des types de tumeurs primaires et des sous-types histologiques supplémentaires (par ex. différenciation intestinale ou à cellules en anneaux sigillaires) ne permet donc pas de généraliser les possibilités de traitement et les indications correspondantes.
Principe et indications de la chirurgie cytoréductrice
L’approche de la chirurgie cytoréductrice et de la chimiothérapie intrapéritonéale hyperthermique (CRS/HIPEC) est curative et non palliative. Il est donc impératif de poser une indication stricte et minutieuse. Dans le cas des tumeurs malignes, cette thérapie est adaptée aux carcinomes précoces ou limités et n’a que peu de sens en tant que dernière option. Une collaboration interdisciplinaire basée sur la confiance et des concepts élaborés en commun sont donc essentiels pour la planification du traitement. Il est également important de connaître la biologie de la tumeur. Par exemple, les carcinomes des tumeurs du foie, des voies biliaires ou du pancréas ne sont pas une indication pour une approche chirurgicale. La CRS/HIPEC est raisonnable pour le traitement des carcinomes péritonéaux limités dans les tumeurs de l’appendice, du côlon et du mésothéliome péritonéal primitif ; la CRS/HIPEC est également envisageable pour le cancer de l’ovaire et de manière hautement sélective pour le cancer de l’estomac.
La HIPEC permet de traiter les cellules tumorales libres ou microscopiques restant sur le péritoine après une chirurgie radicale, complétant ainsi le résultat de l’intervention chirurgicale. Le terme “chimiothérapie” n’est pas vraiment approprié, malgré les substances utilisées, car la HIPEC ne fait probablement que compléter au niveau microscopique le résultat macroscopique de la chirurgie.
Conformément à l’approche curative, l’évaluation définitive de la résécabilité nécessite généralement une laparoscopie, parfois une laparotomie exploratoire. L’étendue de la carcinomatose péritonéale est déterminée par la détermination du “Peritoneal Cancer Index” (PCI) [1]. L’abdomen est ainsi divisé en 13 quadrants, chacun se voyant attribuer une valeur comprise entre 0 et 3. Le PCI se situe donc entre 0 et 39. La décision de procéder à une résection n’est prise que si celle-ci peut être réalisée de manière radicale (complete cytoreduction [CC]-Score 0, pas de tumeur macroscopiquement visible). En ce qui concerne le pronostic à long terme, l’ICP ne devrait pas dépasser une valeur maximale pour certains types de tumeurs. La contreindication à la cytoréduction et donc à la HIPEC est souvent une atteinte tumorale importante de l’intestin grêle, ce qui peut rendre impossible une résection radicale. Dans de tels cas, l’intervention doit être interrompue, car il n’est pas justifié que, compte tenu du (mauvais) pronostic attendu, la qualité de vie soit amoindrie par la gêne postopératoire.
Aspects techniques
Si la décision est prise de procéder à une résection, le péritoine atteint par la tumeur est retiré (péritonectomie). Les résections d’organes sont pratiquées avec parcimonie et exclusivement en cas d’atteinte tumorale. L’exception est la résection oncologique si la tumeur primaire (par exemple au niveau du côlon ou de l’appendice) n’a pas été enlevée auparavant. Une résection est considérée comme complète lorsqu’il n’y a plus de tumeur visible (CC-score 0), et c’est seulement dans ce cas que la HIPEC est effectuée. L’administration directe des cytostatiques par voie intra-abdominale permet d’atteindre des concentrations élevées dans l’abdomen, tout en maintenant une faible exposition systémique. Le réchauffement simultané de la solution porteuse de chimiothérapie (liquide de dialyse) à 42°C améliore la pénétration et en partie l’effet cytotoxique des cytostatiques [2]. On utilise principalement des combinaisons de mitomycine C et de doxorubicine, de cisplatine, d’oxaliplatine et parfois de docétaxel. Les températures varient alors de 41° à 43°. L’application se fait pendant 30 à 90 minutes, en fonction des substances utilisées.
Effets secondaires
La morbidité de l’intervention dépend principalement de l’étendue de la cytoréduction. L’insuffisance rénale due à la HIPEC est extrêmement rare, surtout si la diurèse peropératoire est bien contrôlée. Le taux d’hémotoxicité lié aux cytostatiques est également faible. Une étude multicentrique française [3] et une recherche systématique dans la littérature actuelle [4] montrent un taux de complications postopératoires d’environ 30% et un taux de mortalité de 3-5% si l’expérience est suffisante. Les facteurs de risque significatifs dans l’analyse multivariée étaient, dans l’étude française, l’âge du patient, la PCI et l’étendue de la résection associée, ainsi que l’expérience du centre [3,5]. La HIPEC provoque une paralysie intestinale légèrement prolongée chez presque tous les patients, qui sont donc initialement nourris par voie parentérale.
Indications spécifiques et résultats par type de tumeur
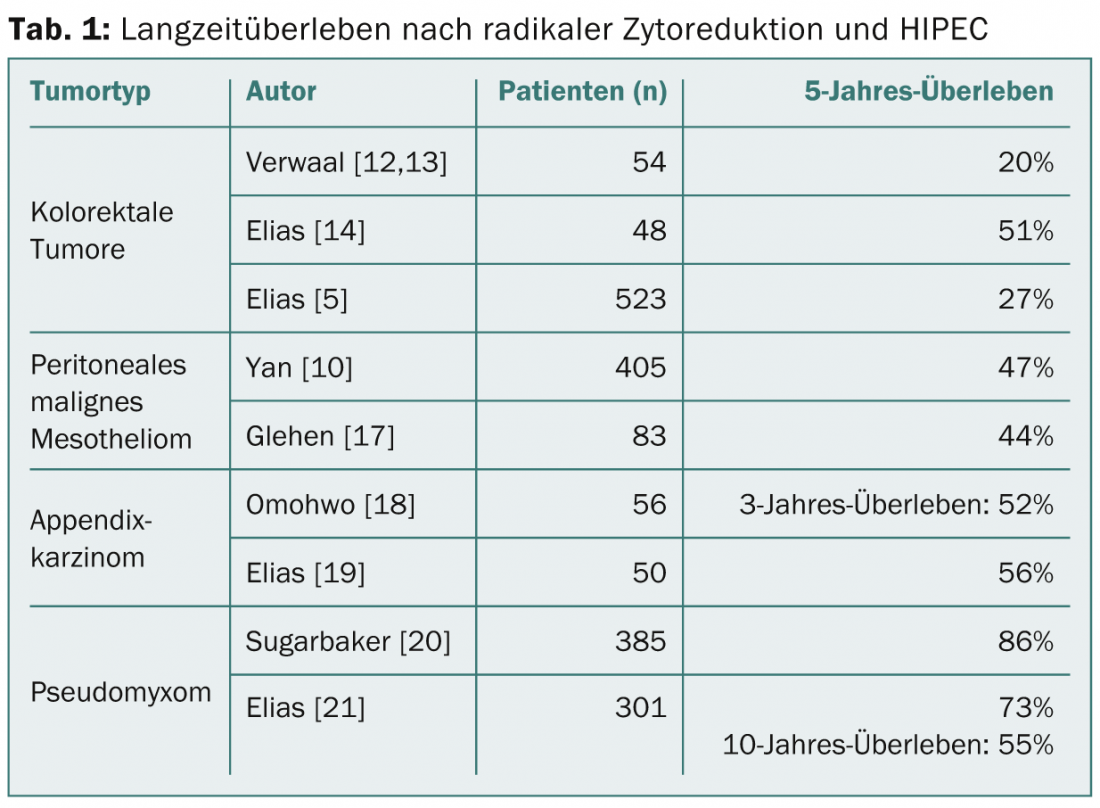
Pseudomyxome et tumeurs de l’appendice : Les tumeurs de l’appendice présentent une grande variation de types histologiques. La carcinomatose péritonéale peut être très pauvre en cellules et/ou riche en mucine, mais on trouve également des carcinomes à cellules en godet, des adénocarcinomes et des carcinomes à anneaux scellés, dont l’agressivité augmente dans cet ordre. La manifestation sous forme de masses muqueuses peu malignes et pauvres en cellules (disseminated peritoneal adenomucinosis, DPAM) correspond au pseudomyxome classique. Dans cette maladie, la CRS/HIPEC permet d’obtenir une survie à 5 ans de 85% (tableau 1) [6]. Ces excellents résultats continuent de se manifester sur une période de 10 à 20 ans [7]. Pour les tumeurs riches en cellules (carcinomatose mucineuse péritonéale, PMCA), la survie à 5 ans est plus faible (47%), mais elle reste supérieure à celle des tumeurs colorectales [8]. Le pronostic est moins bon pour les tumeurs de l’appendice avec différenciation des cellules de l’anneau sigillaire.
Il convient de noter que c’est l’histologie de la carcinomatose péritonéale qui est pertinente pour le pronostic, plutôt que l’histologie de la tumeur primaire. Sur la base des données actuelles, toutes les tumeurs de l’appendice avec une atteinte exclusivement péritonéale peuvent être évaluées pour une CRS/HIPEC. En l’absence de réponse ou en cas d’atteinte étendue de l’intestin grêle, la CRS/HIPEC n’est pas indiquée. Cela ne s’applique pas au pseudomyxome classique, pour lequel une CRS/HIPEC doit être réalisée même en cas de PCI élevé.
Mésothéliome péritonéal malin : il n’existe actuellement aucun traitement systémique efficace du mésothéliome péritonéal primaire, et la survie est limitée [9]. Une étude multicentrique portant sur 401 patients avec un PCI moyen de 20 a révélé une survie médiane de 53 mois après CRS/HIPEC et une survie à 5 ans de 47% [10]. Les facteurs prédictifs négatifs sont le PCI, l’atteinte ganglionnaire et les métastases à distance [11]. En raison de ces données de survie prometteuses , la CRS/HIPEC est une option thérapeutique raisonnable pour cette maladie rare, malgré l’absence d’études randomisées.
Cancer colorectal : il n’existe à ce jour qu’une seule étude prospective randomisée comparant la chirurgie cytoréductrice et la HIPEC à la chimiothérapie systémique. Verwaal et al. ont montré une survie prolongée à long terme chez les patients atteints de tumeurs colorectales en 2003 et 2008 [12,13]. Cette étude fait aujourd’hui l’objet de controverses, d’une part en raison d’une résection insuffisamment radicale, d’autre part en ce qui concerne la chimiothérapie à base de 5FU uniquement, désormais obsolète. Dans le cadre d’une étude non randomisée, la CRS/HIPEC avec oxaliplatine a été comparée à des patients sous chimiothérapie systémique moderne : chez les patients après CRS/HIPEC, la survie médiane s’est améliorée de 24 à 63 mois, et la survie à 5 ans a en outre augmenté de 13 à 51% [14]. Une analyse plus poussée de l’expérience multi-institutionnelle sur plusieurs années a montré une survie globale à 5 ans de 27%, qui était encore plus élevée en cas d’ICP faible [5]. Les métastases hépatiques isolées ne constituent pas une contre-indication absolue ; elles peuvent être réséquées en même temps avec de bons résultats, mais uniquement en cas d’atteinte péritonéale limitée [15,16].
Plusieurs études sont actuellement en cours pour clarifier le rôle de la CRS/HIPEC dans le cancer colorectal par rapport au traitement systémique moderne. Actuellement, une CRS/HIPEC est raisonnable chez les patients dont l’atteinte péritonéale est limitée (PCI <20), tandis que l’intervention doit être interrompue au profit d’un traitement palliatif dans les stades plus avancés ou lorsqu’elle ne peut pas être radicale (atteinte de l’intestin grêle). Il reste à discuter du rôle du traitement néoadjuvant/préopératoire, qui conduit à une sélection plus poussée des patients. Il est important de noter qu’en raison de la résolution insuffisante des techniques d’imagerie, l’atteinte péritonéale – et donc la résécabilité – ne peut souvent être évaluée que dans le cadre d’une laparoscopie ou d’une laparotomie exploratoire.
Conclusion et recommandation pour la pratique
Le traitement de la carcinomatose péritonéale par CRS/HIPEC est une option thérapeutique efficace pour les patients bien sélectionnés et en bon état général, qui ont généralement peu de chances de survivre à long terme sans traitement agressif. La condition préalable à la CRS/HIPEC est une résection radicale (CCR-0), idéalement précoce. La multimodalité du traitement nécessite impérativement une indication et une collaboration interdisciplinaires minutieuses.
Dr. med. Kuno Lehmann
Littérature :
- Jacquet P, Sugarbaker PH : Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis : Kluwer Academic Publishers, Boston (MA) ; 1996.
- Ceelen WP, Flessner MF : Nat Rev Clin Oncol 2010 ; 7 : 108-115.
- Glehen O, Elias D, Gilly F : Présentation du rapport de l’AFC. In : Carcinoses péritonéales d’origine digestive et primitives 2008.
- Chua TC, et al : Ann Surg 2009 ; 249 : 900-907.
- Elias D, et al : J Clin Oncol 2010 ; 28 : 63-68.
- Glehen O, et al : Cancer 2010 ; 116(24) : 5608-5618.
- Sugarbaker PH : Lancet Oncol 2006 ; 7 : 69-76.
- Elias D, et al : Eur J Surg Oncol 2010 ; 36 : 456-462.
- Fizazi K, et al : J Clin Oncol 2003 ; 21 : 349-354.
- Yan TD, et al : J Clin Oncol 2009 ; 27 : 6237-6242.
- Yan TD, et al : Cancer 2011 ; 117 : 1855-1863.
- Verwaal VJ, et al : Ann Surg Oncol 2008 ; 15 : 2426-2432.
- Verwaal VJ, et al : J Clin Oncol 2003 ; 21 : 3737-3743.
- Elias D, et al : J of Clin Oncology 2009 ; 27 : 681-685.
- Chua TC, et : Eur J Surg Oncol 2009 ; 35 : 1299-1305.
- Elias D, et al : Similitudes et différences pronostiques dans les métastases hépatiques et péritonéales de cancers colorectaux réséquées de manière optimale. Ann Surg 2014 Feb. [Epub ahead of print].
- Tong L, et al : Ophthalmology 2009 ; 116 : 572-579.
- Omohwo C, et al : J Am Coll Surg 2009 ; 209 : 308-312.
- Fan KH, et al : Chang Gung Med J 2009 ; 32 : 526-534.
- Sugarbaker PH, Chang D : Ann Surg Oncol 1999 ; 6 : 727-731.
- Chuanyu S, et al : Urologie 2009 ; 74 : 1036-1040.
InFo ONKOLOGIE & HÄMATOLOGIE 2014 ; 2(8) : 20-22