Le diagnostic, le traitement et le suivi du cancer du testicule sont clairement définis par les recommandations du consensus international. Les chances de guérison du cancer du testicule sont élevées si le traitement est adéquat. Les patients atteints de cancer du testicule doivent être présentés à un centre d’oncologie spécialisé.
Bien que rare, avec une incidence d’environ 10/100 000 habitants, le cancer du testicule est le cancer le plus fréquent chez les hommes âgés de 15 à 40 ans. Dans environ 3% des cas, le testicule controlatéral non porteur de la tumeur présente également un stade précancéreux (CIS ou TIN ou IGCNU), et dans environ 5% des cas, le cancer du testicule est primairement extragonadique (tumeurs germinales extragonadiques). Par conséquent, le diagnostic différentiel d’une tumeur testiculaire ou d’une tumeur germinale doit être inclus chez tous les hommes dont la tumeur primaire n’est pas claire [1]. En raison d’une réponse thérapeutique exceptionnellement bonne et grâce à des études menées de manière cohérente, le cancer du testicule est devenu assez tôt une sorte de “maladie modèle” pour décrire une action oncologique réussie.
Diagnostic, stadification et stratification des risques
Le diagnostic primaire du cancer du testicule comprend tout d’abord les étapes présentées dans le tableau 1. Un scanner ou une IRM de la tête n’est nécessaire qu’en cas de détection de métastases pulmonaires ou de symptômes cliniques. Le PET-CT n’a aucun rôle à jouer dans le cadre du diagnostic primaire du cancer du testicule [1].

En ce qui concerne l’histologie, il est important de distinguer les séminomes, les non-séminomes et les tératomes matures. Toutes les tumeurs mixtes et toutes les tumeurs de patients présentant une élévation de l’AFP sont considérées comme des non-séminomes, quelle que soit l’histologie. En ce qui concerne la classification des stades, on distingue en routine clinique un stade I, avec une maladie limitée au testicule, et les stades métastatiques de la tumeur. Chez les patients présentant une augmentation claire des marqueurs tumoraux AFP et HCG, une confirmation histologique n’est pas nécessaire, même pour les tumeurs germinales extragonadiques.
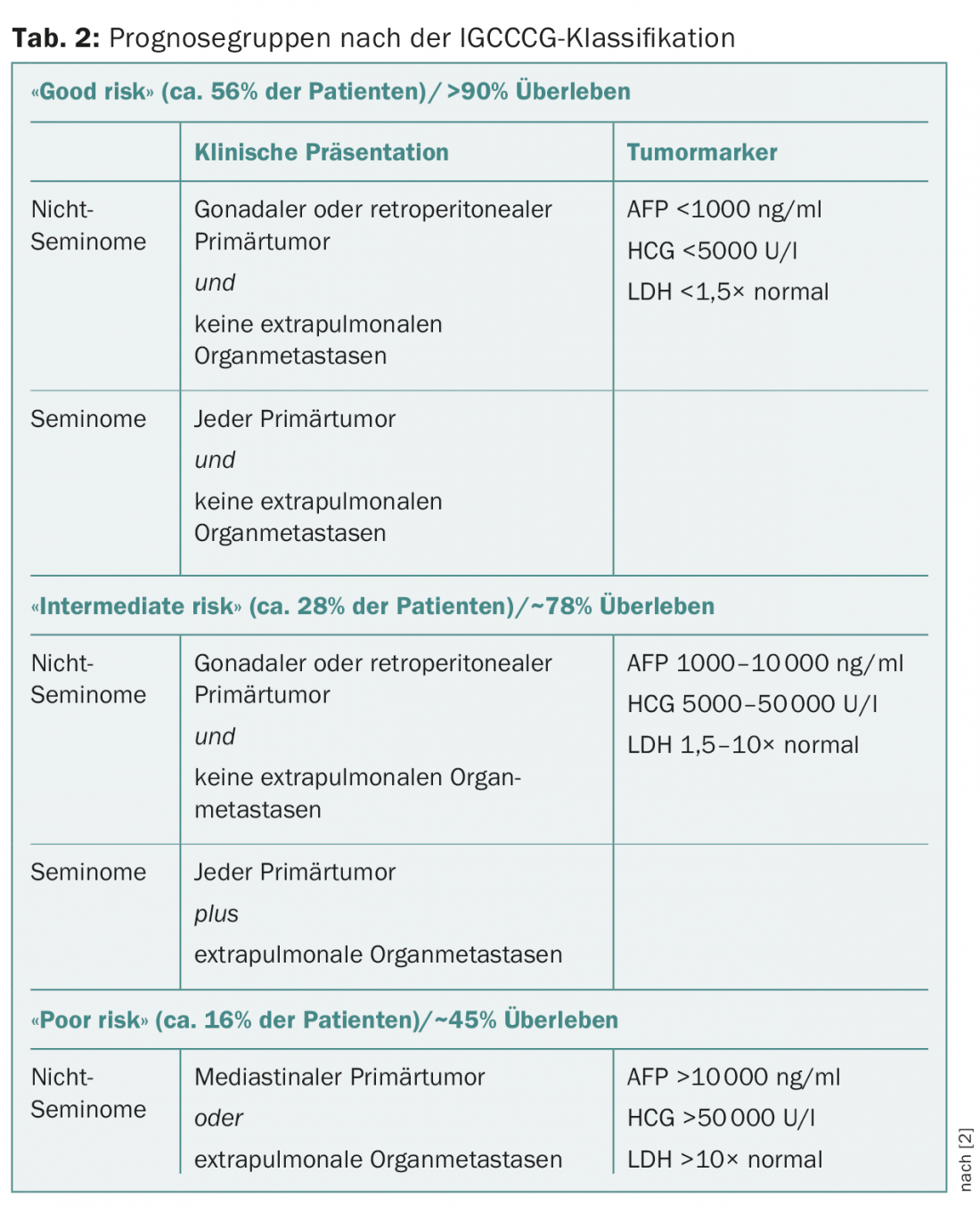
Au stade clinique I, avec une maladie limitée au testicule, la taille de la tumeur, l’infiltration du rete testis et, plus récemment, l’invasion vasculaire lymphovasculaire dans la tumeur primaire sont des facteurs de risque de métastases occultes discutés dans le cas des séminomes, mais ils sont controversés. Pour les non-séminomes de stade I, l’invasion vasculaire lymphatique dans la tumeur primaire est un facteur de risque certain de métastases occultes, mais l’importance de l’infiltration du rete testis ou du pourcentage de carcinome embryonnaire est controversée. Les stades tumoraux métastatiques sont divisés en trois groupes pronostiques selon la classification IGCCCG (International Germ Cell Cancer Collaborative Group) (tab. 2) [2].
Traitement primaire
Les patients atteints de maladie gonadique subissent en premier lieu une orchidectomie. Une biopsie du testicule controlatéral non affecté est utile pour identifier les patients atteints de CIS ou de TIN ou d’IGCNU, mais reste facultative. En revanche, les patients atteints d’une maladie largement métastasée et d’une tumeur gonadique primaire reçoivent en premier lieu une chimiothérapie et ne subissent une orchidectomie qu’une fois la chimiothérapie terminée.
Traitement du stade I
Les patients atteints de séminome de stade I bénéficient d’une surveillance active par défaut, avec un risque de récidive compris entre 10 et 25%. Un traitement adjuvant avec un cycle de carboplatine à une dose AUC 7 peut réduire le risque de récidive à 5%, mais constitue un traitement excessif pour la majorité des patients. Une radiothérapie para-aortique adjuvante de 20 Gy est réservée à des cas particuliers.
Les patients atteints de non-séminomes de stade I sans invasion lymphovasculaire dans la tumeur primaire bénéficient d’une surveillance active par défaut, avec un risque de récidive d’environ 15%. Un cycle de chimiothérapie adjuvante à base de cisplatine, d’étoposide et de bléomycine (PEB) peut réduire le risque de récidive à moins de 3%, mais constitue un traitement excessif pour la majorité des patients.
Les patients atteints de non séminomes de stade I et présentant une invasion lymphovasculaire dans la tumeur primaire bénéficient également soit d’une surveillance active, avec un risque de récidive d’environ 50%, soit d’un cycle de chimiothérapie adjuvante avec PEB, qui réduit le risque de récidive à moins de 3%. La lymphadénectomie rétropéritonéale comme traitement de première intention des non-séminomes de stade I est réservée à des cas isolés.
Avant tout traitement adjuvant des séminomes et des non-séminomes de stade I, il est nécessaire de déterminer les marqueurs tumoraux AFP, HCG et LDH. Chez les patients dont les marqueurs tumoraux restent élevés, voire augmentent, après une orchidectomie, même en l’absence de preuve radiologique de métastases, il ne s’agit pas d’un stade I, mais d’un stade tumoral métastasé.
Traitement des stades métastatiques
Les patients atteints de séminomes métastatiques reçoivent trois cycles (“good risk”), rarement quatre cycles (“intermediate risk”) de PEB, selon la catégorie IGCCCG. Les patients présentant des métastases ganglionnaires abdominales très limitées, jusqu’à environ 2 cm, peuvent alternativement être irradiés ou, en cas de métastases jusqu’à 5 cm maximum, être inclus dans l’étude SAKK 01/10 en cours pour ce stade [3].
Les patients atteints de non-séminomes métastatiques reçoivent trois (“good risk”) ou quatre (“intermediate” et “poor risk”) cycles de PEB, selon la catégorie IGCCCG. Une baisse inadéquate des marqueurs après le premier cycle de traitement est un facteur pronostique négatif supplémentaire chez les patients “à risque faible”. Ces patients peuvent bénéficier d’un traitement combiné complexe et “dose-dense” proposé par le groupe de travail français GETUG [4].
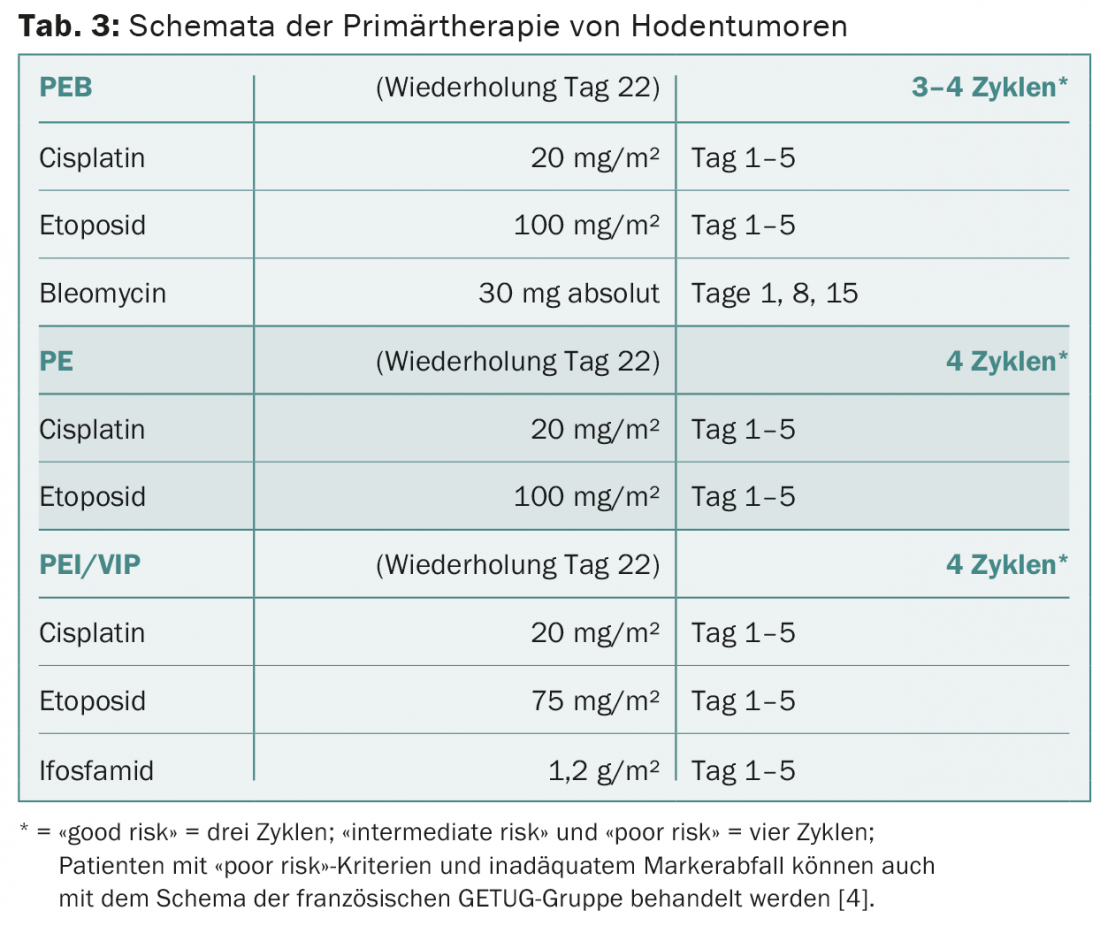
L’administration de PEB dans les séminomes et les non-séminomes se fait exclusivement selon le schéma standard (tab. 3). Les intervalles de traitement de trois semaines doivent être respectés. La bléomycine doit être supprimée chez les patients âgés et chez ceux qui ont une mauvaise fonction pulmonaire ou rénale. Chez les patients dont le pronostic est favorable, le traitement peut être tout aussi efficace avec quatre cycles de cisplatine et d’étoposide sans bléomycine au lieu de trois cycles de PEB. Chez les patients dont le pronostic est intermédiaire ou défavorable, la bléomycine doit être remplacée par l’ifosfamide. La décision de recourir à une chimiothérapie primaire à haute dose est prise individuellement chez les patients à haut risque présentant des non séminomes médiastinaux primaires et chez les patients présentant des métastases hépatiques, osseuses ou du SNC.
Évaluation du traitement et résection des tumeurs résiduelles
Pour tous les patients atteints de séminomes et de non-séminomes, les examens de diagnostic primaire sont répétés environ trois semaines après le début du dernier cycle de traitement. Un staging intermédiaire n’est généralement pas nécessaire, le PET-CT n’a pas de place dans l’évaluation du traitement, sauf chez les patients atteints de séminomes purs et de tumeur résiduelle après chimiothérapie primaire.
Les patients atteints de séminomes purs sans rémission complète après chimiothérapie ne subissent pas de résection tumorale résiduelle, mais un PET-CT au plus tôt douze semaines après le début de la dernière chimiothérapie. La décision thérapeutique ultérieure est prise individuellement en fonction des résultats du PET.
Les patients atteints de non-séminomes sans rémission complète subissent une résection de tous les résidus radiologiquement détectables au plus tard dans les quatre à huit semaines suivant le début du dernier cycle de chimiothérapie. La décision thérapeutique ultérieure est prise individuellement en fonction des résultats histologiques.
Traitement des récidives
Le traitement des patients atteints de séminomes et de non-séminomes et ayant récidivé après le traitement d’un stade I se fait de la même manière que les algorithmes de traitement des patients atteints d’une maladie métastatique primaire, indépendamment du choix de la prise en charge primaire. En règle générale, trois à quatre cycles de PEB sont utilisés chez ces patients, en fonction du stade de la tumeur. La majorité de ces patients sont ainsi définitivement libérés de la maladie.
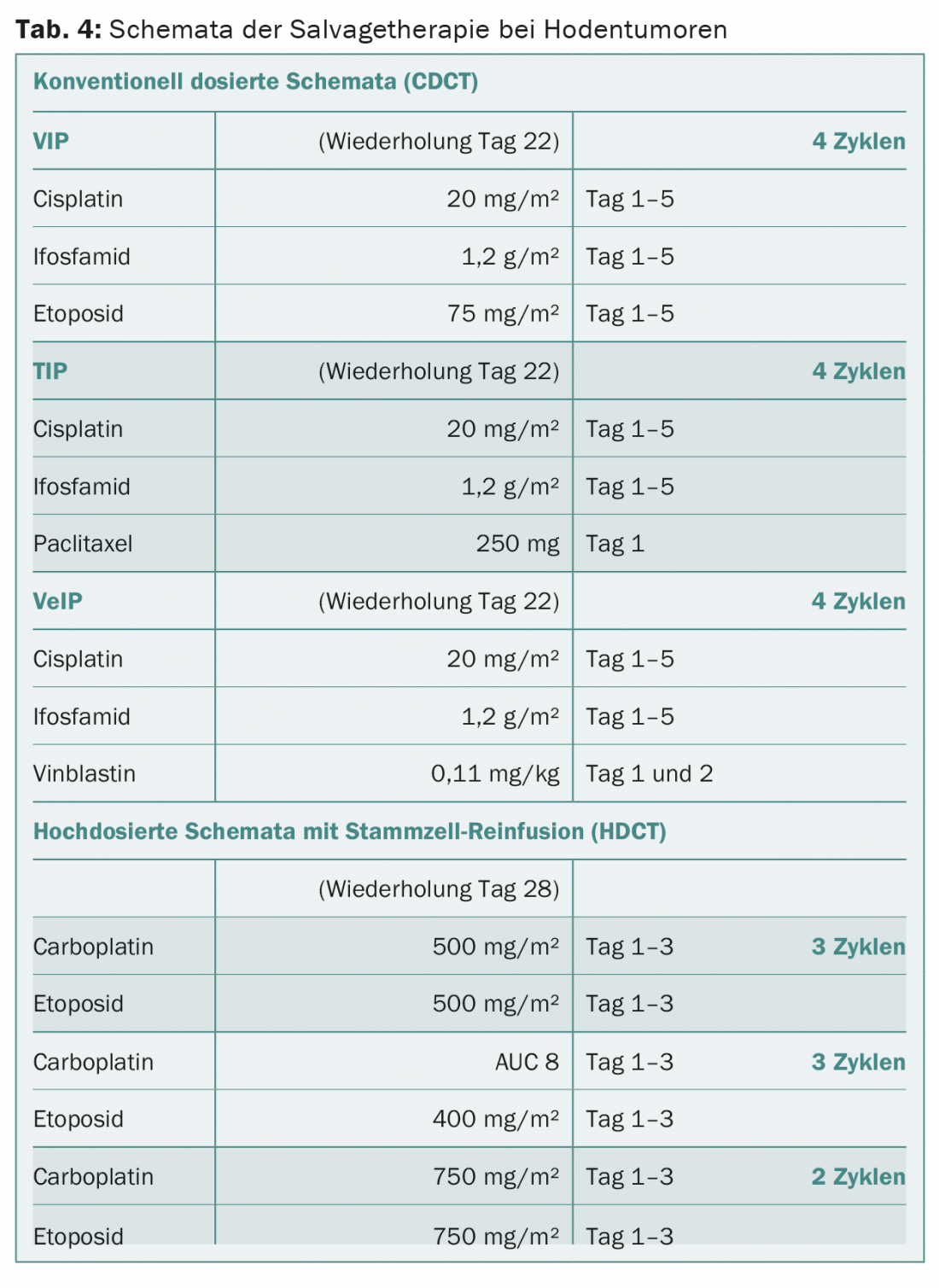
La chimiothérapie de la récidive (synonyme de “chimiothérapie de sauvetage”), nettement plus intensive, reste limitée aux patients métastatiques qui répondent mal à une chimiothérapie primaire et n’obtiennent pas de rémission complète de leur maladie ou qui récidivent après une chimiothérapie primaire à partir d’une rémission complète. Deux stratégies thérapeutiques principales peuvent être envisagées : une chimiothérapie à dose conventionnelle ou une chimiothérapie à haute dose (tableau 4). La détermination de la meilleure stratégie de salving est individuelle.
Récidives tardives
Les récidives tardives, plus de deux ans après la chimiothérapie primaire, sont rares. Dans la mesure du possible, la résection complète de la récidive tardive doit être effectuée en premier lieu. La suite de la procédure dépend du résultat de l’opération et des résultats histologiques.
Thérapie palliative
Un traitement palliatif n’est nécessaire que pour un petit nombre de patients. Les cytostatiques efficaces et bien documentés en situation palliative sont la gemcitabine, l’oxaliplatine et le paclitaxel, qu’ils soient utilisés seuls ou dans le cadre de thérapies combinées. Une radiothérapie palliative ou une “chirurgie de desperation” peuvent être indiquées chez certains patients.
Plan de soins des survivants
Les patients en rémission complète bénéficient d’une consultation finale à la fin du traitement, au cours de laquelle un plan de soins de survie est établi, qui comprend les points énumérés dans le tableau 5.

Le suivi est assuré conformément aux recommandations de Cathomas et al. publiés [5]. Si les personnes concernées donnent leur consentement, les résultats des examens sont inclus dans le registre de suivi. Cela signifie que dans le cadre du suivi de routine des patients, aucun diagnostic par scanner ne sera effectué deux ans après la fin du traitement.
Pour plus d’informations : www.hodenkrebs.de
Littérature :
- Beyer J, et al : Maintenir le succès, réduire la charge du traitement, se concentrer sur la survie : les faits saillants de la troisième conférence de consensus européenne sur le diagnostic et le traitement du cancer à cellules germées. Annals of Oncology 2013 ; 24 : 878-888.
- Classification internationale consensuelle des cellules germinales : un système de stagnation basé sur des facteurs pronostiques pour les cancers métastatiques des cellules germinales. Groupe international de collaboration sur le cancer des cellules germinales. J Clin Oncol 1997 ; 15 : 594-603.
- www.sakk.ch
- Fizazi K, et al : Chimiothérapie personnalisée basée sur le déclin des marqueurs tumoraux dans les tumeurs à cellules germinales à faible pronostic (GETUG 13) : une phase 3, multicentre, essai randomisé. Lancet Oncol 2014 ; 15 : 1442-1450.
- Cathomas R, et al : Interdisciplinary evidence-based recommendations for the follow-up of testicular cancer patients : un effort commun. Swiss Medical Weekly 2010 ; 140 : 356-369.
InFo ONKOLOGIE & HÄMATOLOGIE 2016 ; 4(1) : 34-37











