La réalisation d’une cytométrie de flux à partir d’échantillons de LCR de haute qualité a permis d’identifier des signatures de cellules immunitaires spécifiques dans différentes maladies neurologiques. Cela a permis d’améliorer la différenciation de différentes maladies neurologiques, telles que les neuropathies immunitaires et les maladies auto-immunes du système nerveux central, et d’acquérir des connaissances sur les populations cellulaires potentiellement impliquées dans les différentes maladies.
La clinique de neurologie et l’institut de neurologie translationnelle de l’hôpital universitaire de Münster ont réalisé une cytométrie en flux à partir d’échantillons de LCR de haute qualité à une échelle inégalée et ont établi une base de données unique et complète qui a permis d’identifier des signatures de cellules immunitaires spécifiques dans différentes maladies neurologiques. Cela a permis d’améliorer la différenciation de différentes maladies neurologiques, telles que les neuropathies immunitaires et les maladies auto-immunes du système nerveux central, et d’acquérir des connaissances sur les populations cellulaires potentiellement impliquées dans les différentes maladies. L’article suivant permet d’avoir un aperçu des travaux scientifiques basés sur la cytométrie de flux à partir du liquide céphalorachidien et donne un bref aperçu de certaines compositions de cellules immunitaires dans les principales maladies neurologiques.
Le liquide céphalo-rachidien, une fenêtre diagnostique sur le système nerveux central
Le liquide céphalorachidien (en abrégé LCR) est un liquide clair qui circule autour du système nerveux central (SNC) et entoure le cerveau et la moelle épinière. Le liquide céphalo-rachidien n’offre pas seulement une protection mécanique, il est également susceptible de fournir des nutriments aux cellules du système nerveux central [1], de servir de milieu de transport pour les cellules immunitaires [2] et de servir d’intermédiaire pour le transport des antigènes entre le SNC et les compartiments périphériques, tels que le sang [3]. La fraction non cellulaire du LCR est produite sous forme d’ultrafiltrat à partir du sérum dans le plexus choroïde dans les ventricules cérébraux, les substances dissoutes passant du sérum dans le LCR en fonction de leur taille. Le drainage du liquide céphalo-rachidien (réintégration dans la circulation) se fait par le système veineux et lymphatique [3,4]. Les cellules du LCR sont des leucocytes, appelés leucocytes du LCR ou cellules du LCR. La concentration de cellules dans le LCR est environ mille fois plus faible que dans le sang périphérique. Dans des conditions physiologiques, le LCR contient ≤4 leucocytes du LCR/µl (ou <5/leucocytes du LCR/µl). Le profil cellulaire du LCR est lymphocytaire et monocytaire et se caractérise par une prédominance de lymphocytes T CD4+. Par rapport au sang périphérique, les cellules mémoires et les lymphocytes T régulateurs et les cellules tueuses naturelles (NK) sont augmentés dans le LCR, alors que les lymphocytes B sont réduits et que les plasmocytes ne sont pas présents dans les conditions physiologiques [5,6]. Cela suggère que la composition cellulaire du LCR forme un compartiment distinct, soumis à une régulation et à un contrôle stricts, et qui doit être régulé indépendamment du sang périphérique. Comme le liquide céphalo-rachidien entoure le système nerveux central, il constitue le compartiment le plus proche du SNC, accessible en pratique clinique par ponction lombaire à des fins d’analyse diagnostique. Il est bien connu que le liquide céphalo-rachidien peut fournir des informations sur les mécanismes cellulaires des maladies du SNC. L’immunophénotypage des cellules du LCR – tel que nous le présentons dans cet article – peut aider à obtenir de nouveaux aperçus de la physiopathologie, à affiner les analyses diagnostiques et à mieux évaluer les pronostics individuels. Dans le futur, cela pourrait aider à développer de nouvelles approches thérapeutiques pour différentes maladies du système nerveux [7,8].
Cytométrie en flux des cellules du LCR à une échelle sans précédent
La cytométrie en flux est une méthode de détection quantitative et de caractérisation moléculaire des cellules. Cette méthode permet de classer les cellules en différentes catégories (par ex. lymphocytes, monocytes) en fonction de leurs propriétés. La cytométrie de flux consiste à enregistrer les cellules d’une suspension dans un appareil appelé cytomètre de flux. Chaque cellule individuelle passe à travers un faisceau laser dont le “profil de réponse” permet de détecter la taille des cellules, la granularité des cellules et l’expression des marqueurs cellulaires de chaque cellule individuelle. Des combinaisons de marqueurs spécifiques déterminent de quelle population cellulaire il s’agit (tableau 1) [5,14].
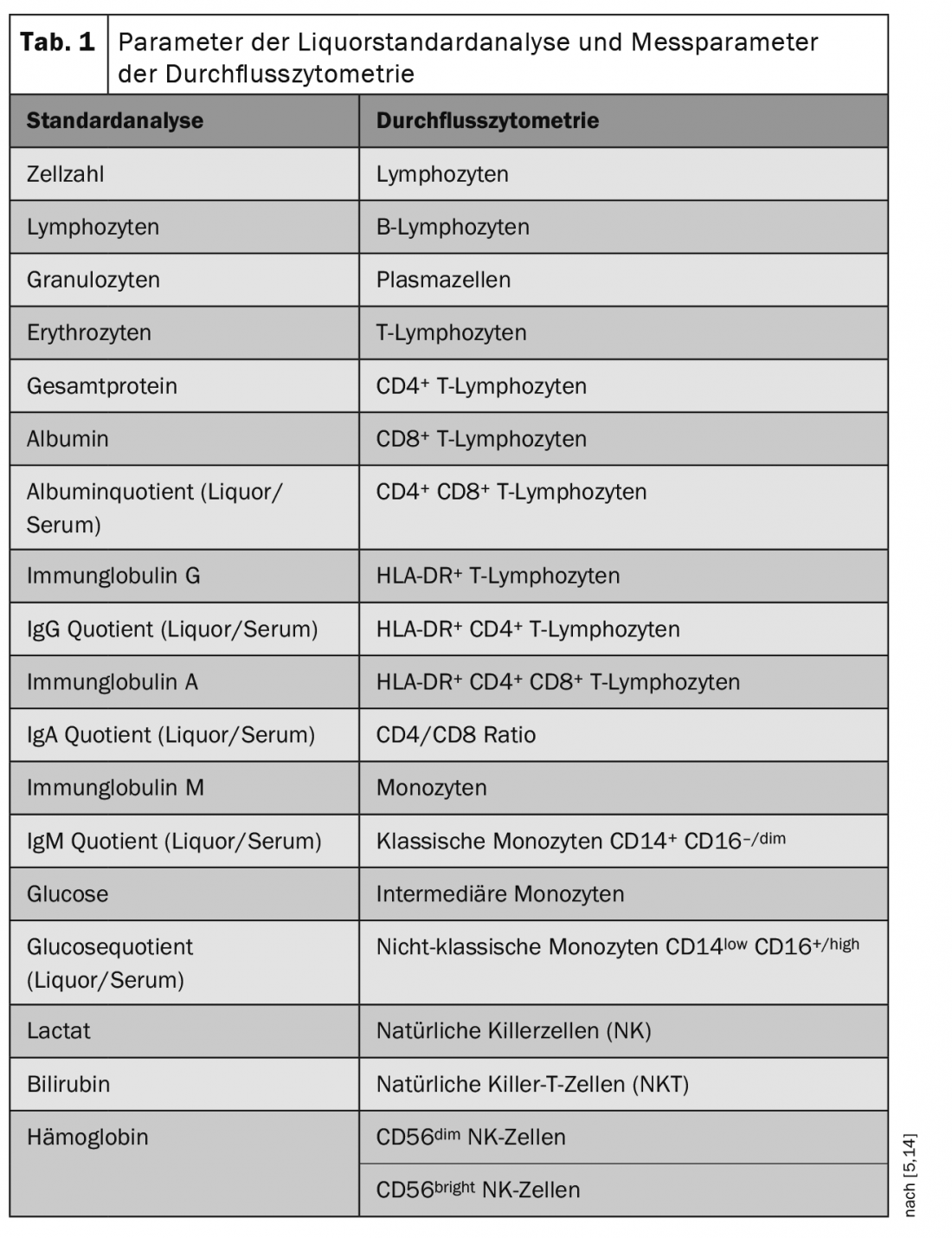
Le laboratoire de LCR de la clinique de neurologie et de l’institut de neurologie translationnelle de l’hôpital universitaire de Münster a réalisé ces dernières années des analyses cytométriques de flux très complètes à partir de sang et, en particulier, d’échantillons de LCR de grande qualité provenant de patients atteints de diverses maladies neurologiques. Chaque année, environ mille échantillons de LCR ont été analysés par cytométrie de flux standardisée et les ensembles de données ont été collectés dans une biobanque. Ces données ont ainsi atteint une ampleur inégalée et sont à la disposition de nombreux réseaux de recherche au niveau national et international.
Dans les premiers travaux scientifiques qui en ont résulté, des cellules immunitaires ont été comparées dans le LCR et le sang de patients atteints de maladies auto-immunes du système nerveux central et périphérique [5,9]. L’analyse cytométrique de flux a également été utilisée chez des patients atteints de maladies neuro-dégénératives telles que la démence d’Alzheimer et la démence fronto-temporale [7,10]. En coopération avec la clinique de psychiatrie de l’hôpital universitaire de Münster, les leucocytes des échantillons de sang et de liquide céphalorachidien de patients souffrant de troubles psychotiques primaires ont été analysés et comparés aux profils immunologiques des maladies neurologiques.
La base de données de la clinique de neurologie et de l’institut de neurologie translationnelle de l’hôpital universitaire de Münster continuera à s’enrichir de nouveaux jeux de données et à servir de source d’informations pour des analyses plus approfondies et des diagnostics différentiels spécifiques de différentes maladies.
Neuropathies
Les neuropathies – c’est-à-dire les maladies du système nerveux périphérique – sont très fréquentes et peuvent affecter les fibres nerveuses motrices, sensitives et autonomes. Cliniquement, les neuropathies sont différenciées en fonction de leur schéma de distribution, de leur évolution clinique et de leur genèse. En fonction de la localisation des nerfs touchés, on distingue notamment les mononeuropathies et les polyneuropathies (PNP). Il existe un large éventail de causes possibles de neuropathies, y compris les maladies métaboliques, toxiques, héréditaires, infectieuses, auto-immunes, vasculaires, paraprotéinémiques et malignes. La cause la plus fréquente de polyneuropathie dans le monde occidental est le diabète sucré, suivi par l’origine éthyliques. Jusqu’à 10% des neuropathies sont causées par des processus auto-immuns et sont donc également appelées neuropathies immunitaires [11].
Le diagnostic repose principalement sur l’anamnèse et l’examen physique et neurologique. Une attention particulière est accordée aux infections antérieures, telles que les gastro-entérites et les infections des voies respiratoires supérieures, aux maladies antérieures et aux symptômes d’autres systèmes d’organes, tels que les symptômes autonomes. Sur le plan de la chimie de laboratoire, on procède d’abord à un diagnostic standard. Le diagnostic avancé de certains anticorps anti-gangliosides (GM1, GM2, GQ1b, etc.) peut aider à poser le diagnostic de neuropathies immunitaires à médiation auto-immune en cas de suspicion clinique. Les paramètres inflammatoires, l’immunoélectrophorèse, les anticorps rhumatoïdes (ANA, AN-CA) ou les anticorps antineuronaux (anti-Hu, anti-CV2/CRMP5, anti-amphiphysine, anti-Ma2) peuvent être révélateurs d’une maladie systémique ou maligne à l’origine des polyneuropathies inflammatoires. Pour exclure les infections virales ou bactériennes, une anamnèse complète et un diagnostic sérologique d’agents viraux (EBV, CMV, HSV, VZV, FSME, HBV, VIH, polio) ou bactériens (Borrelia, Treponema pallidum) peuvent être complétés. Les mesures électrophysiologiques peuvent détecter plus précisément les schémas de distribution et de lésion et permettent de les classer en différents sous-types. L’électromyographie permet d’identifier d’autres schémas de lésions myogènes, comme la dénervation, les atrophies musculaires et l’activité spontanée. Les techniques d’imagerie telles que l’échographie et l’imagerie par résonance magnétique peuvent visualiser les schémas lésionnels et aider au diagnostic d’exclusion d’autres causes de neuropathies, par exemple les tumeurs neuronales comme les schwannomes.
Neuropathies immunitaires
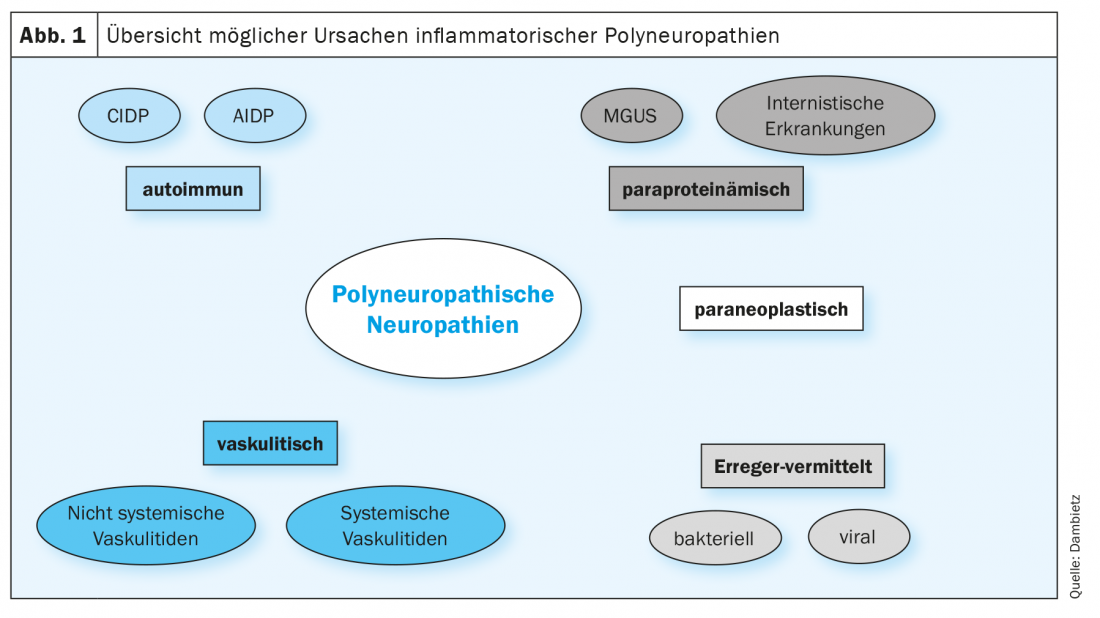
Les neuropathies immunitaires sont particulièrement pertinentes, car elles peuvent être traitées si elles sont diagnostiquées tôt et si un traitement approprié est mis en place. En premier lieu, les neuropathies immunitaires sont divisées en un type d’évolution aiguë (≤quatre semaines), subaiguë (quatre à huit) ou chronique (≥huit semaines). La polyradiculoneuropathie inflammatoire démyélinisante aiguë (PIDA), appelée syndrome de Guillain-Barré (SGB), est la forme la plus courante des neuropathies immunitaires aiguës, tandis que la polyradiculoneuropathie inflammatoire démyélinisante chronique (PIDC) est le prototype des neuropathies immunitaires chroniques. Le diagnostic différentiel des polyneuropathies inflammatoires reste à ce jour un défi majeur. Le diagnostic différentiel avec les neuropathies à médiation auto-immune doit prendre en compte diverses autres causes (figure 1).
Différenciation des neuropathies immunitaires à l’aide de profils de cellules immunitaires
La classification en neuropathies immunitaires aiguës et chroniques est en partie artificielle et il existe de nombreux chevauchements et des transitions fluides entre les deux formes. Ainsi, un CIDP présente un début aigu de type SGB dans jusqu’à 10% des cas. Inversement, une évolution subaiguë de plus de quatre semaines a été décrite dans des cas initialement classés comme SGB [12]. Jusqu’à présent, il n’existe pas de paramètres pronostiques permettant de prédire une évolution aiguë ou chronique au moment de la première manifestation clinique. Étant donné que les options thérapeutiques et la réponse aux différents traitements immunomodulateurs diffèrent entre le SGB et le PIDC, une différenciation précoce des entités est importante et pourrait avoir un impact positif sur l’évolution et le pronostic des maladies.
Les mesures standard du LCR dans les neuropathies inflammatoires permettent de mettre en évidence ce que l’on appelle une “dissémination cytalbumine”, avec une augmentation des protéines totales dans le LCR, alors que le nombre de cellules est normal et qu’il existe souvent un trouble de la barrière hémato-encéphalique.
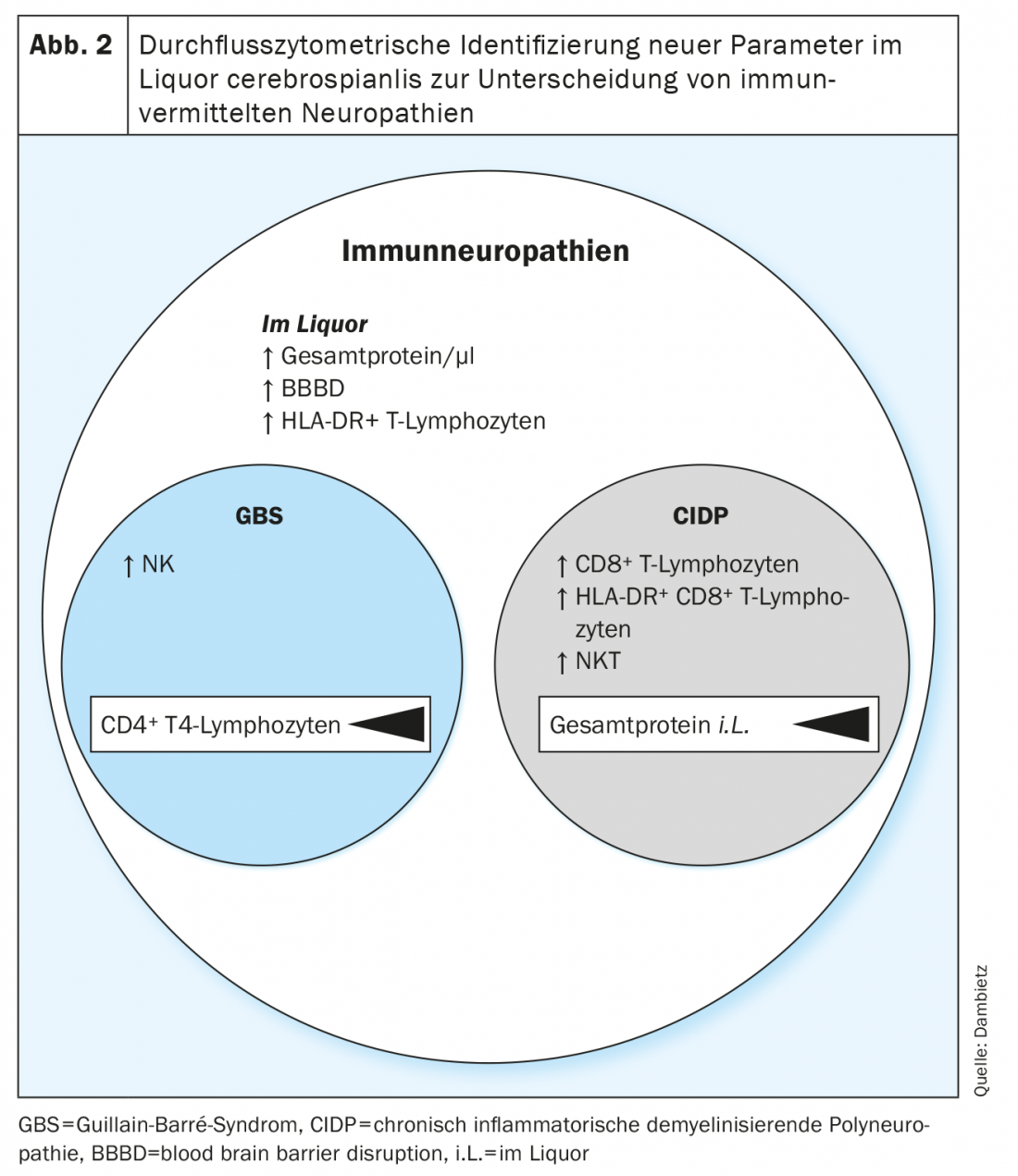
Pour la première fois, les compositions des cellules immunitaires dans le LCR de patients atteints de SGB et de CIDP ont été analysées rétrospectivement et comparées grâce à l’utilisation de la cytométrie en flux [13]. Les profils hétérogènes ont donné des indications sur l’implication de différentes populations de cellules dans la physiopathologie des neuropathies immunitaires aiguës vs chroniques.
En cytométrie de flux, un nombre accru de lymphocytes T activés et non activés (HLA-DR+ vs. HLA-DR-) a été enregistré dans le LCR des patients atteints de neuropathies inflammatoires. L’activation des lymphocytes T, l’augmentation des protéines du LCR et la perturbation de la barrière hémato-encéphalique sont des paramètres non spécifiques des neuropathies et ne sont pas adaptés pour distinguer un SGB d’un CIDP, car l’activation des lymphocytes T est souvent présente dans les formes aiguës et chroniques des neuropathies et peut également être détectée dans d’autres maladies neurologiques. [14,15].
De manière plus spécifique, un taux élevé de cellules tueuses naturelles (NK) a été détecté dans le LCR du syndrome de Guillain-Barré, tandis que dans la polyneuropathie inflammatoire démyélinisante chronique, c’est surtout le nombre de cellules tueuses naturelles T (NKT) et de CD8+ les lymphocytes T étaient élevés (Fig. 2). Dans la comparaison directe du syndrome de Guillain-Barré et de la polyneuropathie démyélinisante inflammatoire chronique, la détection des cellules T Natural Killer, suivie des monocytes classiques et intermédiaires, a été définie comme le paramètre présentant le plus haut niveau de confiance pour différencier les deux entités neuropathiques. L’immuno-profilage avec les différents pourcentages de cellules T NK, NKT et CD8+ permet d’identifier des modèles de cellules immunitaires spécifiques à la maladie et au sous-type dans le LCR et donne une indication de l’implication des types de cellules cytotoxiques distincts dans la physiopathologie des neuropathies immunitaires aiguës vs chroniques. En outre, les profils cellulaires individuels pourraient permettre une évaluation prospective de l’évolution aiguë et chronique au moment de la première manifestation clinique et faciliter ainsi le choix d’un traitement.
Le traitement de choix du syndrome de Guillain-Barré est la plasmaphérèse. Les immunoglobulines intraveineuses sont également disponibles en tant qu’option thérapeutique équivalente. De nos jours, en raison d’une carence omniprésente en immunoglobulines, celles-ci ne sont généralement utilisées que secondairement dans la pratique clinique quotidienne et sont appliquées en particulier pour l’escalade thérapeutique après plasmaphérèse avec une amélioration insuffisante de la symptomatologie clinique. Alors que les corticostéroïdes n’ont pas montré d’effet dans le SGB [16], une bonne efficacité a été démontrée dans la polyneuropathie démyélinisante inflammatoire chronique, raison pour laquelle ils sont utilisés de manière standard dans le traitement du PIDC [17–19].
Les patients SGB et PIDC naïfs de traitement n’ont pas montré de différence significative dans leurs profils de cellules immunitaires liquides par rapport aux patients déjà traités. En fin de compte, cela signifie que la différenciation des neuropathies inflammatoires par cytométrie de flux peut également être effectuée sous traitement et que les profils de cellules immunitaires spécifiques aux sous-types dans le LCR ne sont pas faussés par l’utilisation d’immunoglobulines ou de corticostéroïdes, par exemple.
Afin de mettre en évidence la pertinence clinique des compositions de cellules immunitaires spécifiques aux sous-types, des paramètres reflétant les manifestations cliniques des néruopathies ont été détectés. La sévérité des maladies a été déterminée par le score d’invalidité de Hughes et l’échelle de Rankin modifiée (mRS). Dans le cas du syndrome de Guillain-Barré, une corrélation a été établie entre le nombre de lymphocytes T CD4+ et de monocytes non classiques et la sévérité clinique de la maladie. Dans le cas de la PIDC, le taux de protéines totales dans le LCR était en corrélation avec la gravité de la maladie. La cytométrie en flux du LCR a permis d’établir une nouvelle approche diagnostique pour identifier les changements spécifiques à la maladie et au sous-type dans les neuropathies inflammatoires à médiation auto-immune, ce qui facilite la différenciation de la PIDC du SGB. A l’avenir, cela pourrait servir de base à l’évaluation du pronostic et au développement de nouveaux agents thérapeutiques, et l’analyse immunocellulaire pourrait être étendue à d’autres variantes neuropathiques.
Les immunophénotypes dans le spectre des maladies neurologiques
Sur la base de l’augmentation des informations obtenues par l’utilisation de la cytométrie en flux dans différents compartiments (sang et LCR), la collecte de données a été étendue à un plus large éventail de maladies neurologiques. Une étude transversale rétrospective a examiné la composition des cellules immunitaires chez des patients atteints de maladies à médiation auto-immune, neurodégénératives et vasculaires. Tout comme les neuropathies immunitaires, les maladies auto-immunes du système nerveux central constituent un groupe hétérogène de pathologies neuroinflammatoires qui nécessitent encore aujourd’hui une classification plus spécifique et un diagnostic différentiel plus précis, et dont les mécanismes pathologiques sous-jacents ne sont pas encore totalement décryptés.
Des paramètres individuels ont été détectés par cytométrie de flux et des analyses multidimensionnelles ont permis d’extraire les caractéristiques qui différencient le mieux les maladies neuroinflammatoires des pathologies neurodégénératives et vasculaires [5].
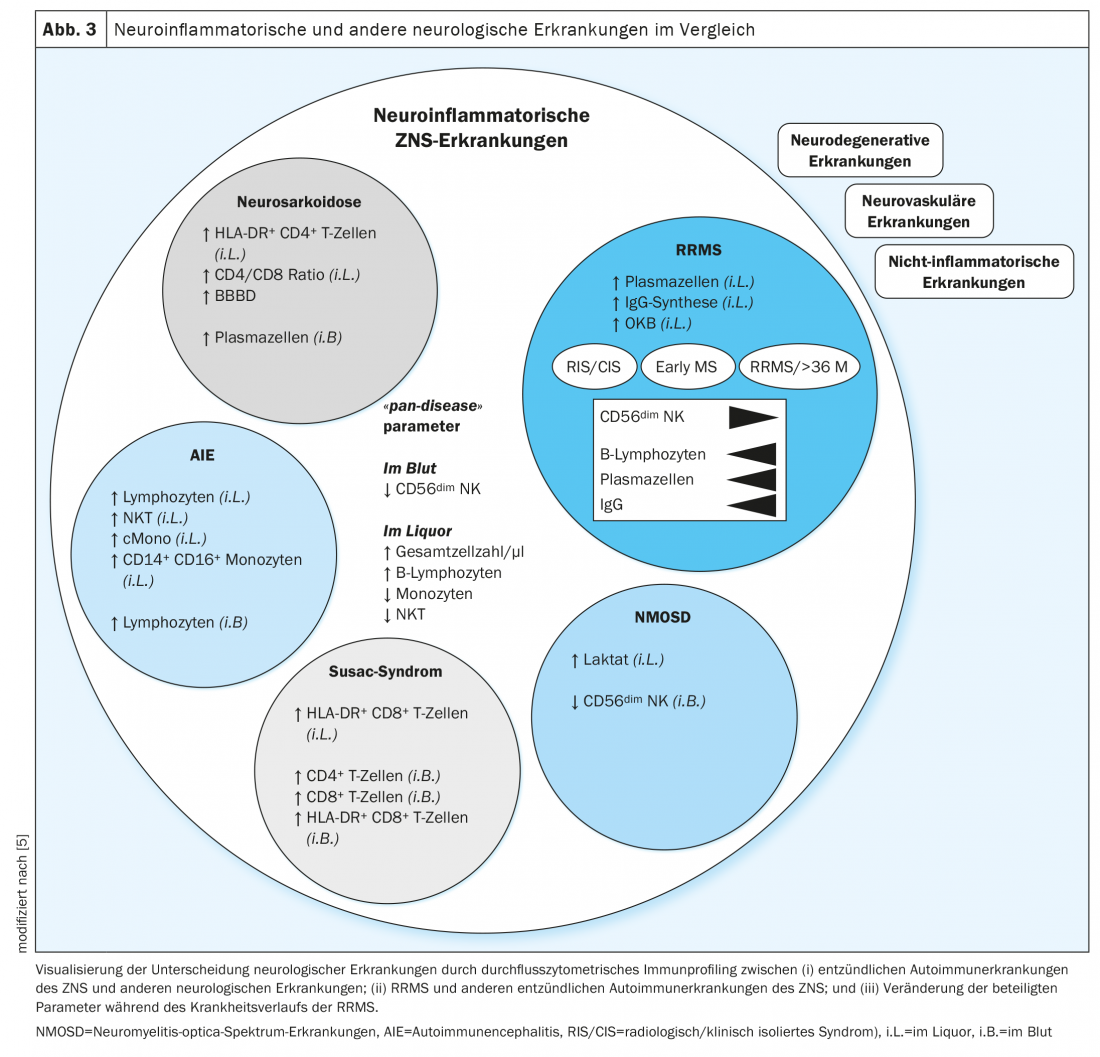
Les profils de cellules immunitaires des maladies neuroinflammatoires auto-immunes ont montré des similitudes entre elles et des différences par rapport aux maladies neurodégénératives, vasculaires et non-inflammatoires (figure 3). Dans les profils de cellules immunitaires de toutes les maladies neuroinflammatoires, le nombre de cellules et la proportion de lymphocytes B dans le LCR étaient élevés, tandis que les monocytes, les cellules tueuses naturelles et les cellules T tueuses naturelles étaient abaissés. En outre, une diminution du nombre de cellules NK CD56dim dans le sang a été identifiée comme un indice de la présence d’une maladie inflammatoire du SNC. Ces caractéristiques ont été définies comme des paramètres “pan-disease” pour les pathologies auto-immunes du système nerveux central et indiquaient donc des modifications communes à toutes les maladies (figure 3). Dans la sclérose en plaques, une augmentation du nombre de cellules dans le LCR et une expansion significative des cellules de la lignée B sont connues depuis de nombreuses années [20,21]. Il est intéressant de noter que ces paramètres étaient influençables par les immunothérapies et pourraient être utilisés à l’avenir comme biomarqueurs de la réponse aux thérapies immunomodulatrices et améliorer l’évaluation du pronostic ainsi que le contrôle du traitement.
Compositions de cellules immunitaires dans les maladies neuroinflammatoires auto-immunes
Des signatures de cellules immunitaires spécifiques de la maladie dans le LCR ont également été étudiées dans diverses autres maladies neurologiques.
Une étude rétrospective a comparé la composition des cellules immunitaires dans la sclérose en plaques de type récurrent-rémittent (RRMS) et la neurosarcoïdose. La sarcoïdose est une maladie auto-immune multisystémique qui se manifeste par des granulomes épithélioïdes dans divers organes où elle provoque des réactions inflammatoires locales par infiltration de macrophages [22]. Le système nerveux central est également touché chez environ 25% des patients [23]. Cela se traduit souvent par des symptômes neurologiques qui peuvent être similaires à ceux d’une poussée de SEP. Le diagnostic de la sarcoïdose comprend un bilan sanguin avec dosage des paramètres inflammatoires, de l’immunoglobuline G, de l’ECA, du récepteur soluble de l’IL-2 (sIL-2R) et de la néoptérine, ainsi qu’une exploration fonctionnelle respiratoire, une bronchoscopie avec lavage broncho-alvéolaire et biopsie transbronchique, une radiographie du thorax et, selon les manifestations cliniques, d’autres examens d’imagerie et des examens interdisciplinaires [24,25]. En ce qui concerne la différenciation avec d’autres maladies inflammatoires, les paramètres chimiques de laboratoire (ECA, sIL-2R) se sont révélés non spécifiques et insuffisamment sensibles [26,27]. La distinction entre la neurosarcoïdose et la sclérose en plaques n’est pas toujours évidente, même en imagerie, car les lésions de SEP (white matter lesions) et les modifications granulomateuses de la neurosarcoïdose se ressemblent souvent en imagerie par résonance magnétique [28]. L’analyse standard “simple” du LCR révèle également des anomalies similaires, comme une pléiocytose légère [29]. Le diagnostic définitif de la neurosarcoïdose ne peut alors parfois être établi que par biopsie de lésions couvertes de granulomes dans le système nerveux central [30]. Toutefois, une telle biopsie constitue une procédure invasive et risquée et ne devrait être effectuée qu’après une évaluation précise des bénéfices et des risques. Pour éviter une telle mesure invasive, il est essentiel de mettre en place de nouveaux outils de diagnostic. Dans cette optique, la cytométrie en flux du LCR et du sang de patients atteints de neurosarcoïdose et de sclérose en plaques a été évaluée de manière rétrospective.
En cytométrie de flux, la neurosarcoïdose a été étonnamment bien différenciée de la sclérose en plaques par un taux élevé de plasmocytes, de monocytes intermédiaires et non classiques dans le sang, tandis que le nombre de lymphocytes T dans le sang était réduit dans la neurosarcoïdose. Le LCR a révélé des paramètres se chevauchant partiellement dans les deux maladies, avec une augmentation spécifique du pourcentage de lymphocytes T CD4-positifs dans la neurosarcoïdose. L’intégration multidimensionnelle des compositions cellulaires immunologiques du LCR et du sang a permis d’optimiser la différenciation des deux maladies (figure 3). La prédominance de lymphocytes T CD4 positifs activés et un ratio CD4/CD8 élevé dans le LCR ainsi qu’une proportion accrue de plasmocytes dans le sang ont été définis comme caractéristiques de la neurosarcoïdose [14]. La détection de plasmocytes dans le liquide céphalorachidien ainsi que la synthèse intrathécale d’IgG et de bandes oligoclonales ont ouvert la voie à la sclérose en plaques.
Les compositions immunocellulaires individuelles dans le LCR permettent donc de mieux distinguer ces deux maladies inflammatoires du système nerveux central et peuvent permettre, dans la pratique clinique quotidienne, de renoncer à des confirmations de diagnostic par biopsie et de simplifier le choix du traitement (immunosuppresseurs classiques vs traitements modulateurs de la SEP).
En outre, l’accent a été mis sur la distinction des maladies auto-immunes distinctes du système nerveux central et sur la comparaison des profils de cellules immunitaires dans la sclérose en plaques, les maladies du spectre de la neuromyélite optique (NMOSD), l’encéphalite auto-immune (AIE) et le syndrome de Susac. La NMOSD se caractérise par des névrites optiques et des myélites récurrentes avec des lésions inflammatoires de longue durée [31]. Les encéphalites auto-immunes peuvent se manifester cliniquement par des céphalées, de la fièvre, une baisse de la vigilance, des crises d’épilepsie mais aussi des déficits cognitifs. L’encéphalite à récepteurs NMDA (NMDARE) se caractérise souvent par des déficits cognitifs, des troubles mnésiques et des symptômes psychotiques [32, 33]. Le syndrome de Susac est une endothéliopathie des petits vaisseaux sanguins du SNC médiée par les cellules T CD8+ et se caractérise cliniquement par une triade d’encéphalopathie, de perte auditive et de baisse de l’acuité visuelle [34,35].
Alors que ces maladies présentent des changements similaires entre elles dans les analyses standard du LCR [36], la cytométrie de flux a révélé des changements spécifiques aux sous-types dans la composition des cellules immunitaires.
En plus de la synthèse intrathécale d’IgG connue jusqu’à présent, la synthèse intrathécale d’IgA et d’IgM a également été identifiée comme caractéristique de la RRMS. Dans les maladies du spectre de la neuromyélite optique, on a notamment observé une diminution du nombre de cellules NK CD56bright dans le sang et une augmentation de la concentration de lactate dans le LCR. Le syndrome de Susac se caractérisait par la présence de lymphocytes T CD4+ et CD8+ dans le sang, ainsi que par un taux élevé de lymphocytes T CD8+ activés (HLA-DR+) dans le LCR et le sang. La caractéristique de l’encéphalite auto-immune était la détection d’un nombre élevé de lymphocytes dans le LCR et dans le sang, ainsi qu’un nombre élevé de cellules T tueuses naturelles, de monocytes classiques et de monocytes CD14+ CD16+ dans le LCR.
L’analyse des cellules immunitaires par cytométrie de flux dans le LCR permet donc de différencier la SEPR des autres entités avec un degré de confiance élevé. Dans une analyse multidimensionnelle, les plasmocytes dans le LCR et la synthèse intrathécale d’IgG ont été définis comme les meilleurs paramètres pour différencier le SMRR des autres maladies auto-immunes du SNC.
Les profils des cellules immunitaires de patients atteints de sclérose en plaques récurrente-rémittente à différents stades de la maladie ont été étudiés de manière approfondie. Quel que soit le stade de la maladie, les paramètres ‘pan-disease’ étaient modifiés dans la même mesure. En revanche, la progression de la maladie s’est accompagnée d’une nouvelle diminution de CD56dim cellules NK dans le sang et une augmentation des lymphocytes B intrathécaux, des plasmocytes et de la synthèse intrathécale d’IgG (Fig. 3). A l’aide de paramètres spécifiques aux cellules immunitaires, corrélés à la gravité et à la progression de la maladie, une surveillance continue permettrait de définir de nouveaux marqueurs facilitant l’évaluation de l’activité de la maladie et permettant une modulation précoce du traitement afin d’influencer positivement l’évolution de la maladie. Des données supplémentaires provenant d’études longitudinales sur plusieurs décennies pourraient permettre d’identifier des paramètres facilitant la détection de la transition d’une SEP rémittente à une SEP secondairement progressive. Des études prospectives de confirmation sont donc encore nécessaires.
L’analyse précise des profils variables des cellules immunitaires dans différentes entités pathologiques devrait permettre à l’avenir d’acquérir de nouvelles connaissances sur les mécanismes pathologiques communs et distincts dans certaines maladies, mais l’identification d’autres paramètres discriminants nécessitera des cohortes plus importantes, notamment de patients atteints de maladies rares telles que la NMOSD ou le syndrome de Susac. À l’avenir, la cytométrie en flux ne devrait pas se limiter au domaine de la neurologie, mais s’étendre à d’autres disciplines médicales.
Analyse des cellules immunitaires dans un champ interdisciplinaire
De nombreuses maladies neuroinflammatoires peuvent également se manifester par des symptômes psychiatriques, comme les encéphalites auto-immunes telles que l’encéphalite à récepteurs NMDA (NMDARE). Les erreurs de diagnostic qui classent l’AIE comme une maladie primaire parmi les maladies psychiatriques sont fréquentes. Les conséquences qui en découlent peuvent être graves. Actuellement, le diagnostic différentiel entre les maladies psychiatriques et les maladies auto-immunes neuroinflammatoires reste un défi dans la pratique clinique quotidienne de la neurologie et de la psychiatrie. En outre, le spectre des maladies psychiatriques comprend de nombreuses entités dont la pathogenèse n’est pas encore totalement comprise [37]. Ces dernières années, des mécanismes immunologiques et auto-immuns ont également été discutés et pourraient contribuer à l’apparition de maladies psychiatriques [38–41]. C’est pourquoi nous avons analysé les données de cytométrie de flux dans le cadre de maladies psychiatriques. Dans le diagnostic des maladies psychiatriques, l’analyse du LCR était jusqu’à présent surtout utilisée pour exclure les maladies organiques.
Une étude rétrospective a permis de recueillir des données sur la composition des cellules immunitaires dans les maladies psychotiques primaires (dont la schizophrénie, les troubles délirants, les troubles psychotiques aigus et transitoires et les troubles schizo-affectifs) et de les comparer aux signatures des cellules immunitaires des maladies neuroinflammatoires, en particulier la NMDARE, une sous-forme courante de l’AIE.
La cytométrie de flux a permis de détecter des paramètres et de créer des scores multidimensionnels qui servent non seulement au diagnostic d’exclusion, mais aussi à soutenir et à faciliter le diagnostic des troubles psychotiques primaires. En outre, la composition de cellules immunitaires spécifiques donne des indications sur l’implication de certaines sous-populations dans la genèse et les mécanismes pathologiques des maladies psychiatriques. Des recherches antérieures ont mis en évidence une augmentation du nombre de leucocytes dans le sang des patients atteints de troubles psychotiques [42]. Les analyses standard du liquide céphalorachidien ont montré une augmentation des protéines du liquide céphalorachidien dans les psychoses primaires et souvent la présence d’un trouble de la barrière hémato-encéphalique. Cependant, il n’existe pas de paramètres spécifiques de laboratoire et de chimie du liquide céphalorachidien, et il n’a pas été possible jusqu’à présent de les différencier avec certitude des maladies neurologiques par des analyses standard du sang et du liquide céphalorachidien.
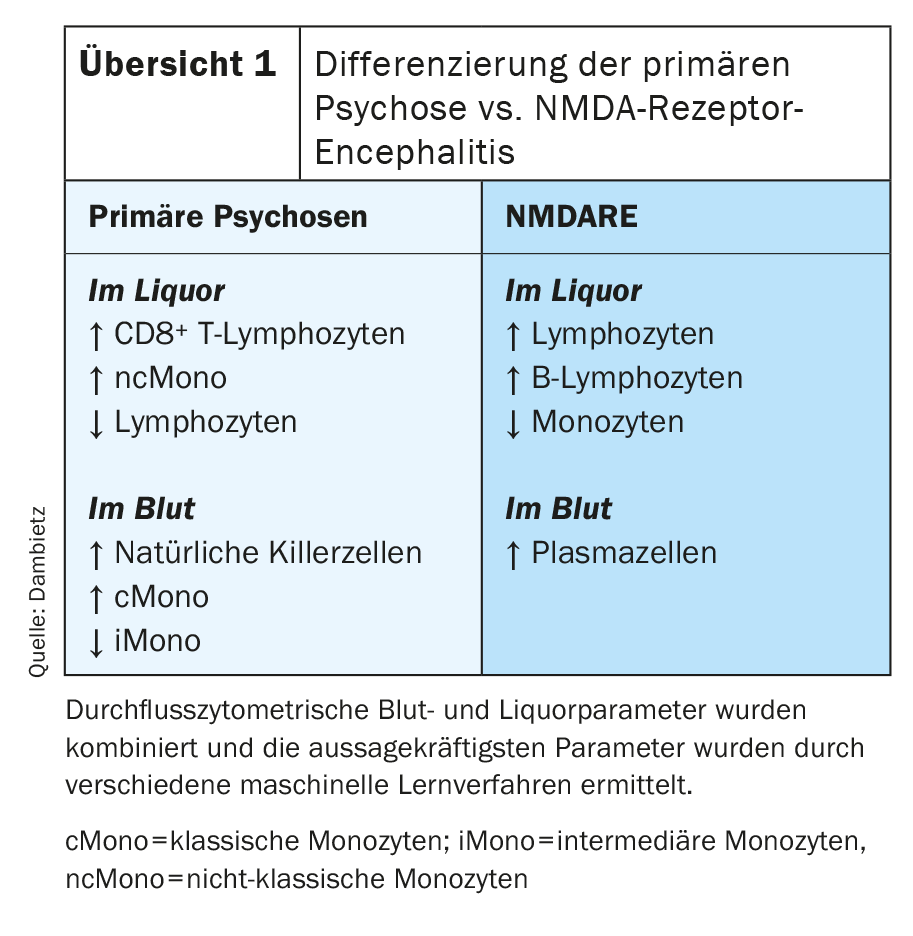
La cytomérèse en flux a révélé des changements spécifiques au compartiment dans le LCR et le sang chez les patients atteints de psychose primaire [43]. La composition spécifique des cellules immunitaires dans le LCR dans les troubles psychotiques primaires était caractérisée par une augmentation des lymphocytes T CD8 positifs et des monocytes, en particulier des monocytes non classiques. En revanche, le nombre de lymphocytes dans le liquide céphalorachidien a été réduit (tableau 1). Dans le sang, on a observé une augmentation du nombre de cellules tueuses naturelles et de monocytes. En particulier, le nombre de monocytes classiques était augmenté, tandis que la proportion de monocytes intermédiaires dans le sang était réduite. L’encéphalite à récepteurs NMDA (NMDARE) est souvent associée à des symptômes psychotiques et peut être difficile à distinguer cliniquement des psychoses primaires. Malgré la possibilité de déterminer les anticorps spécifiques des récepteurs anti-NMDA, des erreurs de diagnostic sont possibles car il existe également des variantes d’encéphalites auto-immunes avec anticorps négatifs [44]. C’est pourquoi les deux maladies ont été comparées en particulier. Le profilage des cellules immunitaires par cytométrie de flux a montré que la NMADRE peut être facilement distinguée des maladies psychotiques primaires par un taux élevé de lymphocytes, de cellules B et de monocytes dans le LCR et par la détection de plasmocytes dans le sang. (Aperçu 1). En outre, la cytométrie de flux a détecté une augmentation du taux de cellules tueuses naturelles dans le sang chez les patients présentant des symptômes psychotiques positifs.
Les troubles psychotiques primaires constituent un groupe hétérogène dont la physiopathologie complexe est encore incomprise sous de nombreux aspects et n’a pas été étudiée en détail. Des recherches antérieures indiquent une dérégulation du système immunitaire et des composants inflammatoires dans le système nerveux central chez les patients souffrant de troubles psychotiques primaires. Les résultats de la cytométrie de flux montrent des changements dans la composition des cellules immunitaires dans le LCR et suggèrent que les mécanismes immunologiques, en particulier l’immunité innée, contribuent, avec une fonction de barrière hémato-encéphalique perturbée, au développement des maladies psychotiques primaires. La cytométrie de flux a identifié des changements typiques de la maladie dans la composition des cellules immunitaires dans le LCR et le sang, ce qui renforce le diagnostic de psychose primaire et soutient l’hypothèse immunitaire de la psychose primaire.
Résumé
La cytométrie de flux dans le liquide céphalo-rachidien a permis d’établir la possibilité de nouvelles analyses de cellules immunitaires spécifiques à la maladie et au sous-type. Les analyses cytométriques en flux du LCR ont permis de classer spécifiquement les maladies neuroinflammatoires du système nerveux central et périphérique. Les compositions des cellules immunitaires dans le LCR des patients atteints de SGB vs CIDP permettent de distinguer les deux entités avec un niveau de confiance plus élevé. De plus, une évaluation précoce de l’évolution de la maladie (aiguë monophasique vs chronique récurrente) peut être effectuée au moment du diagnostic initial de neuropathie inflammatoire.
En outre, les maladies inflammatoires auto-immunes du système nerveux central présentent des modifications individuelles des sous-populations cellulaires dans le sang ainsi que dans le LCR. Ces variations spécifiques à la maladie devraient à l’avenir améliorer la classification dans les différentes entités et faciliter ainsi le diagnostic différentiel. L’analyse cytométrique de flux du liquide céphalorachidien peut s’avérer particulièrement utile en cas de résultats incertains d’autres examens, par exemple en imagerie ou en cas de modifications non spécifiques de la chimie de laboratoire. Par exemple, lorsque des lésions non spécifiques sont détectées par IRM, par exemple dans le cas de lésions ischémiques vs. “white matter lesions” (dans la SEP, la NMOSD ou le syndrome de Susac), ou dans le cas de granulomes dans le système nerveux central vs. des lésions de SEP, le diagnostic peut être complété par l’analyse des cellules immunitaires.
De plus, un diagnostic précoce peut orienter les décisions thérapeutiques, comme par exemple l’utilisation de médicaments immunomodulateurs, et optimiser l’impact sur l’évolution de la maladie grâce à un choix thérapeutique déterminé. L’objectif des futures analyses du LCR par cytométrie de flux pourrait être la détection de variables immunocellulaires reflétant les effets thérapeutiques et permettant de mieux évaluer l’évolution de la maladie.
En outre, l’identification de signatures de cellules immunitaires spécifiques à une maladie ouvre la voie à l’implication de certaines populations de cellules dans le développement de maladies neurologiques et de mécanismes auto-immuns dans le système nerveux central et périphérique. Elle constitue donc la base d’analyses plus approfondies des processus physiopathologiques.
En résumé, la cytométrie de flux à partir du LCR constitue une nouvelle option diagnostique pour l’analyse de profils spécifiques de cellules immunitaires. La cytométrie de flux de patients atteints de neuropathies immunitaires, de maladies neuroinflammatoires auto-immunes du SNC ou de troubles psychotiques a révélé des modifications immunocellulaires spécifiques à la maladie dans les compartiments périphériques et intrathécaux, indiquant l’implication du système immunitaire inné et des mécanismes immunologiques dans l’étiologie de ces maladies. En particulier, il a été démontré que non seulement les composants cellulaires dans le sang, mais aussi les cellules immunitaires spécifiques dans le LCR jouent un rôle crucial dans la physiopathologie des maladies neurologiques.
L’établissement d’une base de données unique de cytométrie de flux à partir d’échantillons de LCR de haute qualité à la Clinique de neurologie de l’Hôpital universitaire de Münster a permis de jeter les bases de futurs projets de recherche plus approfondis.
Grâce à l’identification de paramètres singuliers et à l’établissement de scores multifactoriels, il sera possible à l’avenir de générer des profils de cellules immunitaires spécifiques à une maladie ou à une sous-classe, qui seront utilisés comme de nouveaux outils de diagnostic dans la pratique clinique quotidienne et qui révolutionneront le diagnostic ainsi que le traitement des neuropathies immunitaires et d’autres maladies.
Messages Take-Home
- La cytométrie de flux des cellules du liquide céphalorachidien permet d’identifier des profils de cellules immunitaires spécifiques à la maladie.
- Certaines populations de leucocytes ont été identifiées comme marqueurs de maladies individuelles et pourraient être impliquées dans les mécanismes pathologiques individuels, par exemple les cellules T tueuses naturelles pour différencier les neuropathies immunitaires aiguës vs chroniques. Les monocytes présents dans le LCR pourraient distinguer les psychoses primaires de l’encéphalite à récepteurs NDMA.
- L’analyse prospective des cellules du LCR pourrait améliorer le choix et le suivi des thérapies dans la pratique clinique quotidienne.
- La cytométrie en flux des cellules du LCR peut améliorer le diagnostic des maladies avec des manifestations cliniques non spécifiques et des symptômes qui se chevauchent, facilitant ainsi les décisions thérapeutiques.
Littérature :
- Iliff JJ, et al : Une voie paravasculaire facilite le flux de LCR à travers le parenchyme cérébral et l’élimination des solutés interstitiels, y compris l’amyloïde bêta. Sci Transl Med 2012 ; 4(147) : 147ra111.
- Schlager C, et al : Effector T-cell trafficking between the leptomeninges and the cerebrospinal fluid. Nature 2016 ; 530(7590) : 349-353.
- Engelhardt B, Vajkoczy P, Weller RO : The movers and shapers in immune privilege of the CNS. Nat Immunol 2017 ; 18(2) : 123-131.
- Louveau A, et al : Caractéristiques structurelles et fonctionnelles des vaisseaux lymphatiques du système nerveux central. Nature 2015 ; 523(7560) : 337-341.
- Gross CC, et al : Classification des maladies neurologiques à l’aide de l’analyse multidimensionnelle du LCR. Brain, 2021. 144(9) : 2625-2634.
- Han S, et al : Immunophénotypage complet des cellules du liquide céphalo-rachidien chez les patients atteints de maladies neuro-immunologiques. J Immunol 2014 ; 192(6) : 2551-2563.
- Pawlowski M, et al : Relevance of raised cerebrospinal fluid monocyte levels in patients with frontotemporal dementia. Neurobiol Aging 2018 ; 62 : 45-52.
- Alvermann S, et al : Immunophénotypage des cellules du liquide céphalorachidien dans la sclérose en plaques : à la recherche de biomarqueurs. JAMA Neurol 2014 ; 71(7) : 905-912.
- Gross CC, et al : Impaired NK-mediated regulation of T-cell activity in multiple sclerosis is reconstituted by IL-2 receptor modulation. Proc Natl Acad Sci USA 2016 ; 113(21) : E2973-2982.
- Lueg G, et al : Pertinence clinique de l’activation spécifique des cellules T dans le sang et le liquide céphalo-rachidien des patients atteints de la maladie d’Alzheimer légère. Neurobiol Aging 2015 ; 36(1) : 81-89.
- Wiendl HK, Kieseier B, Meuth S : Questions et réponses sur la neuroimmunologie 2015 : 191-215.
- van Doorn PA : Diagnostic, traitement et pronostic du syndrome de Guillain-Barre (GBS). Presse Med 2013 ; 42(6 Pt 2) : e193-201.
- Heming M, et al : Le profilage des cellules immunitaires du fluide cérébrospinal fournit des informations pathogéniques sur les neuropathies inflammatoires. Front Immunol 2019 ; 10 : 515.
- Heming M, et al : Les profils leucocytaires dans le sang et le LCR distinguent la neurosarcoïdose de la sclérose en plaques. J Neuroimmunol 2020 ; 341 : 577171.
- Li S, et al : IL-17 et IL-22 dans le fluide cérébrospinal et le plasma sont élevés dans le syndrome de Guillain-Barre. Mediators Inflamm 2012 ; 2012 : 260473.
- Essai en double aveugle de méthylprednisolone intraveineuse dans le syndrome de Guillain-Barre. Syndrome de Guillain-Barre Essai sur les stéroïdes GrouLancet, 1993. 341(8845) : 586-590.
- Kieseier BC, et al : Neuropathies à médiation immunitaire. Nat Rev Dis Primers 2018 ; 4(1) : 31.
- Nobile-Orazio E, Gallia F : Mise à jour sur le traitement de la polyradiculoneuropathie inflammatoire démyélinisante chronique. Curr Opin Neurol 2015 ; 28(5) : 480-485.
- Nobile-Orazio E, et al : Immunoglobuline intraveineuse versus méthylprednisolone intraveineuse pour la polyradiculoneuropathie inflammatoire démyélinisante chronique : un essai contrôlé randomisé. Lancet Neurol 2012 ; 11(6) : 493-502.
- Kraus J, et al : CD45RA+ ICAM-3+ lymphocytes dans le liquide céphalo-rachidien et le sang comme marqueurs de l’activité de la maladie chez les patients atteints de sclérose en plaques. Acta Neurol Scand 2000 ; 102(5) : 326-332.
- Cepok S, et al : Patterns of cerebrospinal fluid pathology correlate with disease progression in multiple sclerosis. Brain 2001 ; 124(Pt 11) : 2169-2176.
- Chen ES, Moller DR : Sarcoidosis – scientific progress and clinical challenges. Nat Rev Rheumatol 2011 ; 7(8) : 457-467.
- Iannuzzi MC, Rybicki BA, Teirstein AS : Sarcoïdose. N Engl J Med 2007 ; 357(21) : 2153-2165.
- Bradshaw MJ, et al : Neurosarcoidosis : Pathophysiology, Diagnosis, and Treatment. Neurol Neuroimmunol Neuroinflamm, 2021. 8(6).
- Seve P, et al : Sarcoidosis : A Clinical Overview from Symptoms to Diagnosis, Cells 2021 ; 10(4).
- Bharwani KD, et al : Elevated Plasma Levels of sIL-2R in Complex Regional Pain Syndrome : A Pathogenic Role for T-Lymphocytes ? Mediators Inflamm 2017 : 2764261.
- Cai B, et al : Micro-inflammation caractérisée par une distorsion de la balance Treg/Teff avec augmentation du sIL-2R chez les patients atteints de diabète de type 2. Exp Clin Endocrinol Diabetes 2013 ; 121(4) : 214-219.
- Spencer TS, et al : Manifestations cliniques et d’imagerie par résonance magnétique de la neurosarcoidosis. Semin Arthritis Rheum 2005 ; 34(4) : 649-661.
- Pawate S, Moses H, Sriram S : Présentations et résultats de la neurosarcoïdose : une étude de 54 cas. QJM 2009 ; 102(7) : 449-460.
- Wegener S, et al : Clinically isolated neurosarcoidosis : a recommended diagnostic path. Eur Neurol 2015 ; 73(1-2) : 71-77.
- Jarius S, Wildemann B, Paul F : Neuromyelitis optica : caractéristiques cliniques, immunopathogénèse et traitement. Clin Exp Immunol 2014 ; 176(2) : 149-164.
- Dalmau J, Graus F : Encéphalite à médiation d’anticorps. N Engl J Med 2018 ; 378(9) : 840-851.
- Dalmau J, et al : An update on anti-NMDA receptor encephalitis for neurologists and psychiatrists : mechanisms and models. Lancet Neurol 2019 ; 18(11) : 1045-1057.
- Vishnevskia-Dai V, et al : Susac syndrome : clinical characteristics, clinical classification, and long-term prognosis. Medicine (Baltimore), 2016 ; 95(43) : e5223.
- Gross CC, et al : CD8(+) T cell-mediated endotheliopathy is a targetable mechanism of neuro-inflammation in Susac syndrome. Nat Commun 2019 ; 10(1) : 5779.
- Toledano M, Weinshenker BG, Solomon AJ : A Clinical Approach to the Differential Diagnosis of Multiple Sclerosis. Curr Neurol Neurosci Rep 2015 ; 15(8) : 57.
- Fritz B : Sur le diagnostic sérologique de la schizophrénie à partir du LCR selon la méthode de Lehmann-Facius. 1939/12. 165 : 462-467.
- van Kesteren CF, et al : Implication immunitaire dans la pathogenèse de la schizophrénie : une méta-analyse sur des études cérébrales post-mortem. Transl Psychiatry 2017 ; 7(3) : e1075.
- Mazza MG, et al : Neutrophil-lymphocyte ratio, monocyte-lymphocyte ratio and platelet-lymphocyte ratio in non-affective psychosis : A meta-analysis and systematic review. World J Biol Psychiatry 2020 ; 21(5) : 326-338.
- Fernandez-Egea E, et al : Populations de cellules immunitaires périphériques associées aux déficits cognitifs et aux symptômes négatifs de la schizophrénie résistante au traitement. PLoS One 2016 ; 11(5) : e0155631.
- Doorduin J, et al : Neuroinflammation in schizophrenia-related psychosis : a PET study. J Nucl Med 2009 ; 50(11) : 1801-1807.
- Steiner J, et al : Cellules immunitaires internes et protéine C-réactive dans la psychose aiguë du premier épisode et la schizophrénie : relation avec la psychopathologie et le traitement. Schizophr Bull 2020 ; 46(2) : 363-373.
- Rauber S, et al : Cerebrospinal fluid flow cytometry distinguishes psychosis spectrum disorders from differential diagnoses. Mol Psychiatry 2021 ; 26(12) : 7661-7670.
- Dalmau J, et al. : Encéphalite à récepteurs anti-NMDA : série de cas et analyse des effets des anticorps. Lancet Neurol 2008 ; 7(12) : 1091-1098.
InFo NEUROLOGIE & PSYCHIATRIE 2022 ; 20(3) : 6-14