La carence en fer est la maladie carentielle la plus répandue dans le monde. En Europe, sa prévalence est de 5 à 10 %, ce qui en fait l’une des causes les plus fréquentes d’anémie (environ 50 %). Un déséquilibre entre les besoins et l’absorption entraîne tout d’abord une carence en fer de réserve, si l’approvisionnement des précurseurs érythropoïétiques est insuffisant, cela conduit à une érythropoïèse déficitaire en fer, alors que l’hémoglobine est encore normale. Ce n’est que lorsque les valeurs de l’hémoglobine sont inférieures à la norme que l’on parle d’anémie ferriprive.
La carence en fer est la maladie carentielle la plus répandue dans le monde. En Europe, la prévalence est de 5 à 10% et constitue l’une des causes les plus fréquentes d’anémie, avec environ 50%. La carence en fer est divisée en trois stades. Un déséquilibre entre les besoins et l’absorption entraîne d’abord une carence en fer de réserve (stade I), si l’approvisionnement des précurseurs érythropoïétiques est insuffisant, cela conduit à une érythropoïèse déficitaire en fer (stade II), avec une hémoglobine encore normale. Ce n’est que lorsque les valeurs d’hémoglobine sont inférieures à la norme (hommes adultes : 13 g/dl, femmes : 12 g/dl) que l’on parle d’anémie ferriprive (stade III). Cette classification des stades est principalement axée sur l’érythropoïèse, mais chacune de nos cellules a besoin de fer. L’érythropoïèse est alimentée en priorité en cas de carence en fer, mais cela signifie également que le fer est déjà absent d’autres systèmes avant que l’anémie ne se manifeste. Des troubles liés à une carence en fer peuvent apparaître dès les stades I et II.
Physiologie et physiopathologie du métabolisme du fer
L’organisme d’un adulte en bonne santé contient 3-5 g de fer, dont la plus grande partie est sous forme de fer hémoglobine, une autre partie sous forme de fer de réserve (hommes adultes 500-1000 mg, femmes préménopausées 200-400 mg) et seulement une très petite partie sous forme de fer plasmatique. Notre corps obtient la majeure partie de ses besoins quotidiens en fer par recyclage à partir de ses réserves internes de fer, mais il dépend de l’absorption entérale pour éviter un bilan négatif. Dans le cadre d’une alimentation normale et équilibrée, l’absorption moyenne de 1-2 mg/jour (environ 5-10% du fer contenu dans l’alimentation dans le cadre d’une alimentation mixte normale) compense la perte physiologique. Chez les femmes en période de menstruation, la balance du fer devient souvent négative avec une perte quotidienne de fer pouvant atteindre 3 mg. Pour maintenir l’homéostasie du fer, un apport quotidien de 8 mg (hommes) et de 18 mg (femmes en âge de procréer) est nécessaire en raison de l’absorption seulement partielle du fer [1]. La plus grande partie du fer alimentaire est éliminée dans les selles.
Notre alimentation contient du fer sous différentes formes. Alors que le fer de la viande est en grande partie constitué de fer héminique divalent, celui des légumes et des céréales se trouve sous forme trivalente. L’absorption se fait principalement dans le duodénum. Le fer héminique provenant de la viande est absorbé par un récepteur (Heme carrier protein 1) situé à la surface des entérocytes. Au niveau intracellulaire, une hémoxygénase sépare le fer et le lie à la ferrine mobile. De là, elle peut être utilisée pour des processus cellulaires ou libérée dans le sang via la ferroportine 1 au niveau de la membrane basale des entérocytes. L’absorption du fer héminique est moins sujette aux interférences et plus efficace que l’absorption du fer provenant des légumes et des produits céréaliers. Le fer trivalent doit d’abord être converti en fer divalent par le DCYTB (cytochrome duodénal B). L’absorption dans les entérocytes se fait via le DMT-1 (divalent metal transporter 1), un transporteur de fer spécifique dépendant du pH. Ce processus peut être entravé par de nombreuses substances (notamment les antiacides, le calcium, les oxalates, les phosphates). Depuis les entérocytes, le fer bivalent passe également dans la circulation sanguine via la ferroportine 1-. Avant libéré dans le sang portal, le fer divalent est oxydé en fer trivalent par l’héphaestine ou la coéruloplasmine et lié à l’apotransferrine produite dans le foie (apotransferrine+2Fe3+ -> transferrine). Dans des conditions normales, 16 à 45% des molécules de transferrine dans le plasma sont saturées en fer. L’absorption dans les cellules cibles se fait par l’intermédiaire de récepteurs de transferrine (TfR), dont le nombre à la surface des cellules est régulé par les besoins en fer de chaque cellule.
Le stockage du fer est principalement assuré par la ferritine, qui est présente dans toutes les cellules et tous les liquides du corps. Il constitue une réserve très rapidement disponible et sa concentration sérique est bien corrélée au stock de fer disponible chez les personnes en bonne santé. La régulation de l’absorption du fer provenant de l’alimentation est assurée par une hormone peptidique produite dans le foie, l’hepcidine. Elle entraîne une régulation négative de la DMT-1 et une dégradation de la ferroportine 1. L’augmentation de l’hepcidine entraîne une diminution de l’absorption des aliments ainsi qu’une diminution de la libération des entérocytes dans le sang portal.
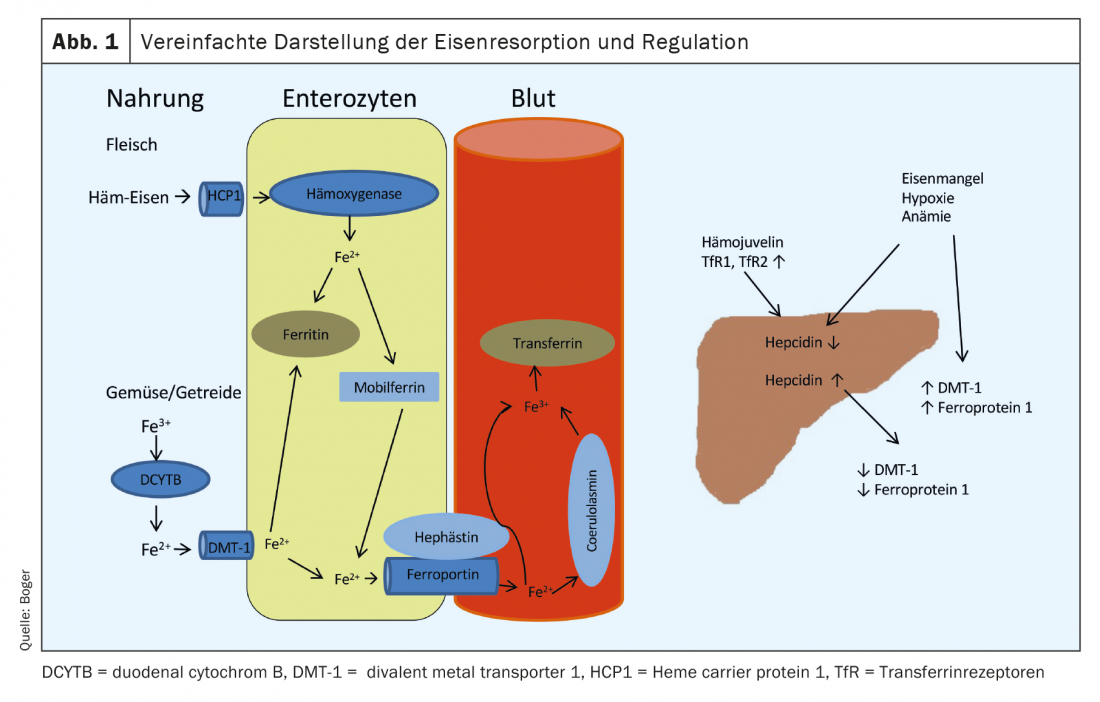
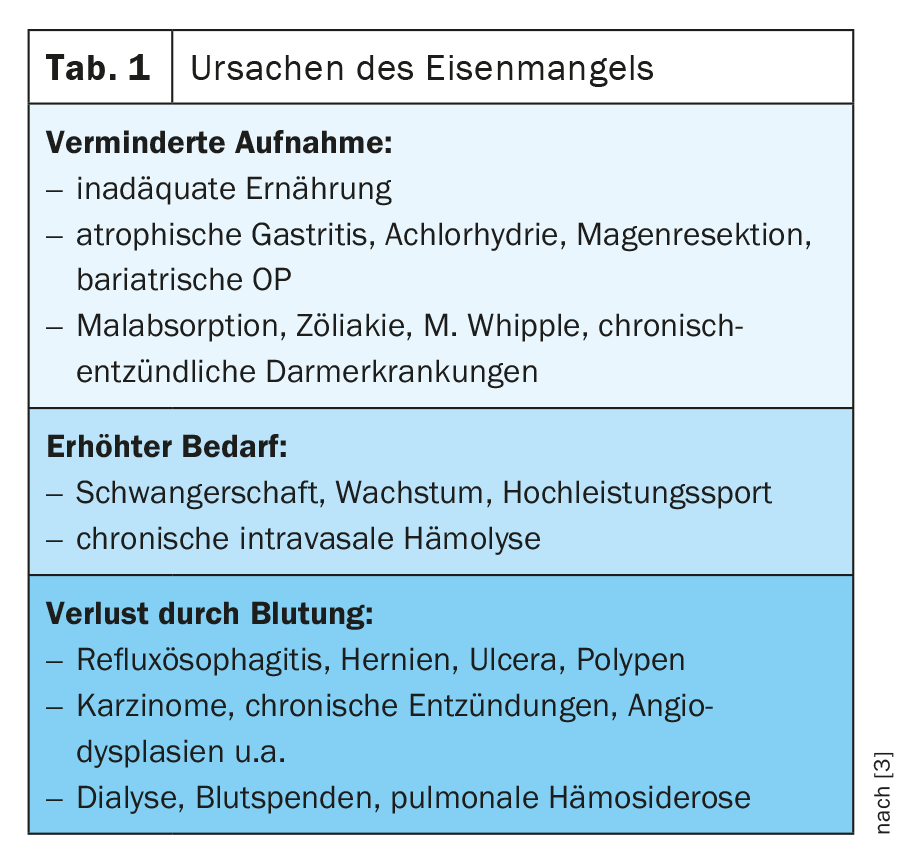
En présence d’une anémie, d’une carence en fer ou d’une hypoxie, la production d’hepcidine dans le foie est réduite et l’expression de DMT-1, DCYTB, de l’héphaestine, de la ferroportine 1 et de HCP1 dans les entérocytes est augmentée [1] (Fig. 1). Pour un aperçu des causes de la carence en fer,voir Tableau 1.
Carence fonctionnelle en fer
Le terme de carence en fer fonctionnelle s’est imposé ces dernières années pour désigner le trouble intrinsèque de l’utilisation du fer. Le terme a d’abord été développé pour désigner l’anémie rénale. Aujourd’hui, il englobe également l’anémie liée à des maladies chroniques (tumeurs, infections, maladies auto-immunes). La libération de cytokines inflammatoires (par ex. interleukine-1α, interleukine-1β, interleukine-6, tumor necrosis factor-α) induit l’hépcidine, ce qui entraîne une diminution de l’absorption et une perturbation de la transmission interne à la transferrine, la protéine de transport, et explique ainsi la diminution de lasaturation de la transferrine (TSAT) en tant que résultat de laboratoire indicatif.
Diagnostic de la carence en fer
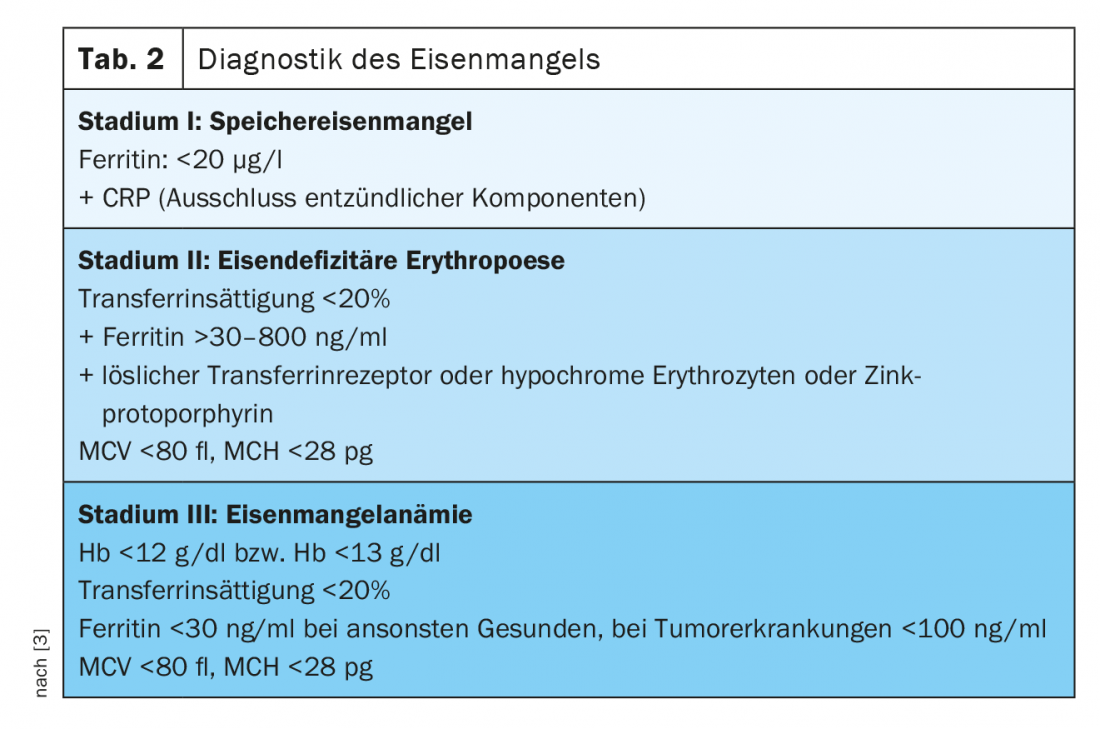
Stade I (carence en fer de réserve)
La ferritine dans le sérum est en corrélation avec l’état des réserves de fer chez les personnes en bonne santé et peut diagnostiquer une carence en fer dès le stade I. La ferritineest un indicateur de l’état des réserves de fer. Alors que l’on parle de carence en fer chez les personnes en bonne santé à partir de valeurs inférieures à 20 µg/l, nous savons que les patients atteints de néoplasie solide et présentant une carence en fer avérée peuvent présenter des valeurs de ferritine de 100 à 800 µg/l, voire supérieures à 800 µg/l chez un quart des patients [2].
Même si la coloration bleu berlinois du Bien que le frottis de moelle osseuse permette une excellente évaluation de la teneur en fer sur la base de la proportion de sidéroblastes (érythroblastes avec détection de granules de fer intracellulaires), ce diagnostic invasif n’est pas la méthode de choix pour une simple carence en fer. Toutefois, si une ponction est effectuée pour une autre raison, en particulier chez les patients oncologiques, cette coloration peut être réalisée en plus si la cause de l’anémie n’est pas claire.
Stade II (érythropoïèse déficiente en fer)
Le site La saturation de la transferrine (TSAT), qui mesure le fer fonctionnel disponible, est soumise à des variations circadiennes et peut être réduite en cas de processus inflammatoires, malgré des taux de ferritine normaux. Elle est le paramètre d’une carence fonctionnelle en fer (TSAT [%]=fer sérique [µg/dl]/transferrine sérique [mg/dl]×70,9). Dans les conditions physiologiques, jusqu’à 45% des molécules de transferrine sont chargées de fer. Si le pourcentage est inférieur à 20%, on peut supposer qu’il y a une carence en fer.
La concentration de récepteurs solubles de la transferrine (sTfR) dans le sérum dépend de l’activité de l’érythropoïèse et du statut du fer. S’il s’agit d’une carence pure en fer de réserve, elle se situe dans la norme. En cas d’érythropoïèse déficitaire en fer, les taux sériques augmentent. Ils servent donc très bien de paramètres pour différencier une érythropoïèse déficiente en fer et une carence fonctionnelle en fer. Les valeurs du récepteur de la transferrine soluble et de la ferritine sérique permettent de calculer l’indice TfR-F, ce qui permet d’obtenir une meilleure sensibilité et spécificité quant à l’érythropoïèse déficitaire en fer. D’autres paramètres permettant de diagnostiquer l’érythropoïèse déficiente en fer sont le taux de réticulocytes hypochromes (HYPO). Lorsque l’apport en fer est suffisant ou au stade I de la carence en fer, le pourcentage d’érythrocytes hypochromes est inférieur à 2,5%. S’il est supérieur à 10%, cela prouve que l’érythropoïèse est déficitaire en fer. De même, la détermination du Teneur en hémoglobine des réticulocytes (CHr) est un paramètre très précoce d’une érythropoïèse déficitaire en fer.
Un paramètre jusqu’à présent peu répandu dans la pratique quotidienne est le la protoporphyrine de zinc (ZPP). Si le fer n’est pas disponible lors de la synthèse de l’hème, le zinc est métabolisé à la place, ce qui donne lieu à des ZPP-globine. ZPP apparaît à partir du stade II de la carence en fer. Une mesure par hématofluorométrie, très peu coûteuse et utilisable comme diagnostic au point d’intervention, permet de diagnostiquer et de quantifier l’érythropoïèse déficiente en fer, bien que les différentes méthodes de mesure et le manque de standardisation rendent difficile une mise en œuvre à grande échelle [3]. De même, la mesure de Hepcidin permet de distinguer une carence absolue en fer d’une carence fonctionnelle en fer dans le cadre de maladies chroniques. En l’absence de standardisation, ce paramètre n’est pas non plus utilisé dans la pratique clinique quotidienne.
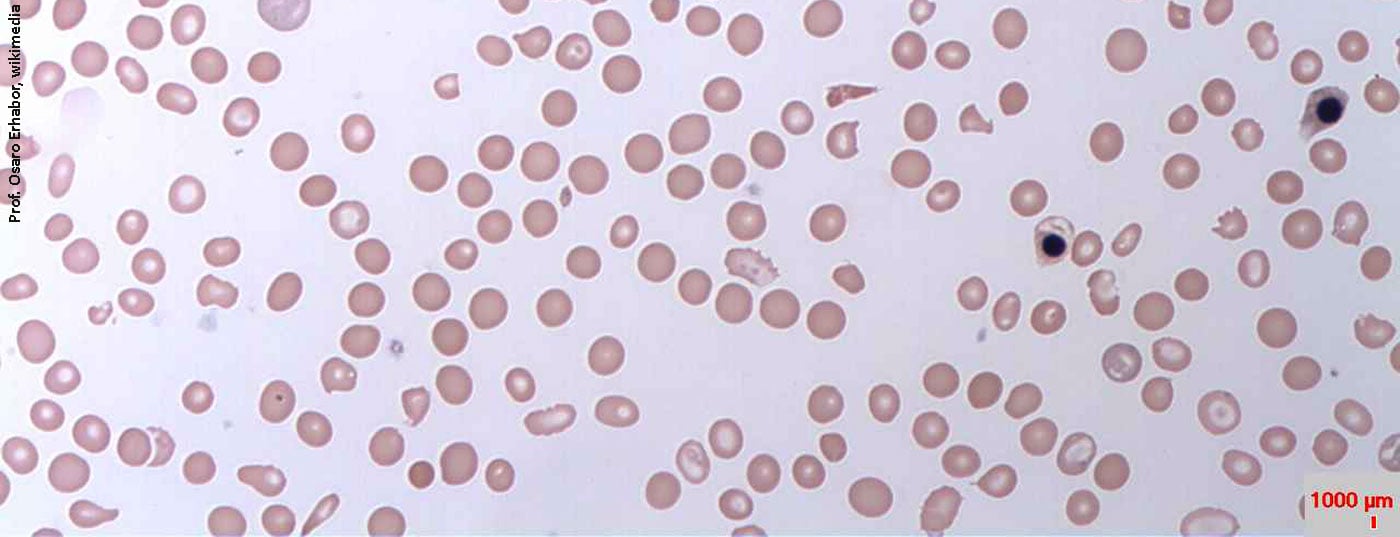
Dans le site Stade III , avec une concentration d’Hb de <12 g/dl pour les femmes et <13 g/dl pour les hommes, l’anémie devient manifeste avec des érythrocytes hypochromes (MCH <28 pg) et microcytaires (MCV <80 fl). Il n’est pas rare d’observer une thrombocytose réactionnelle, qui est l’expression de la réactivité croisée de la thrombopoïèse face à un taux élevé d’érythropoïétine (pour un aperçu du diagnostic de la carence en fer, voir Tableau 2).
Les aspects spécifiques du patient oncologique
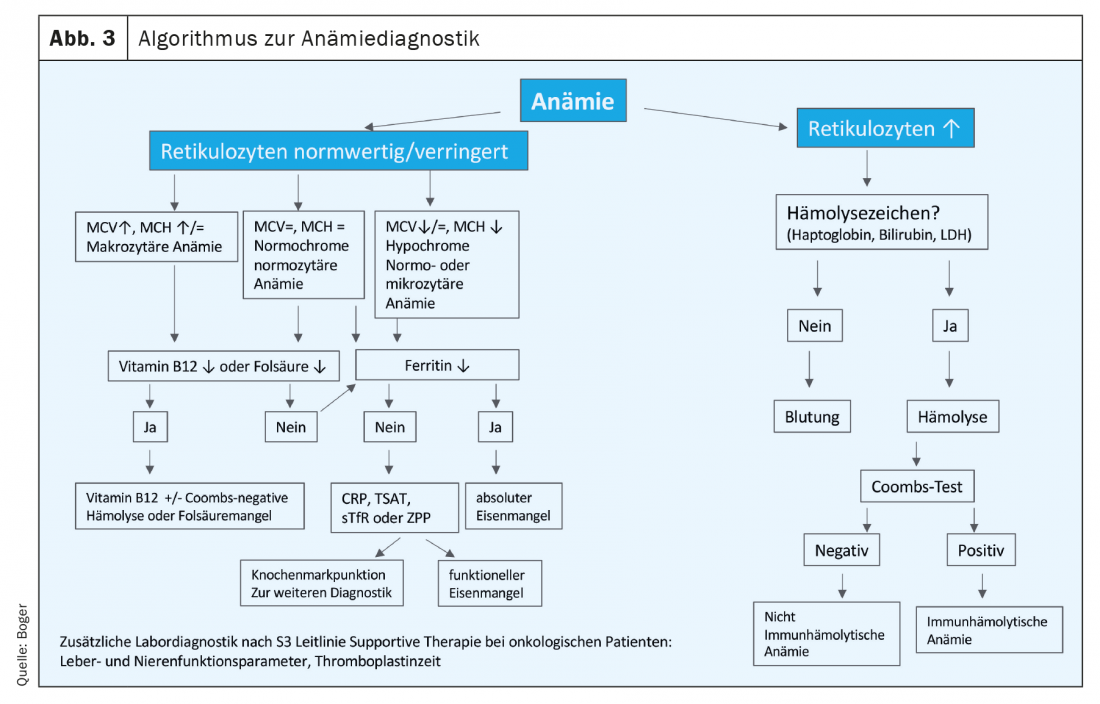
Les patients oncologiques présentent souvent une carence en fer absolue et fonctionnelle due à l’inflammation, à une nutrition perturbée et à la perte de sang ou à la réduction de la durée de survie des érythrocytes, à laquelle se superpose une carence en fer fonctionnelle. (Fig. 2).La ligne directrice allemande S3 SupportivTherapie bei Krebspatienten recommande un diagnostic approprié dès le premier diagnostic. D’autres causes d’anémie non spécifiques aux tumeurs doivent également être examinées [4]. Un algorithme de diagnostic de l’anémie est disponible dans Figure 3 compilé.
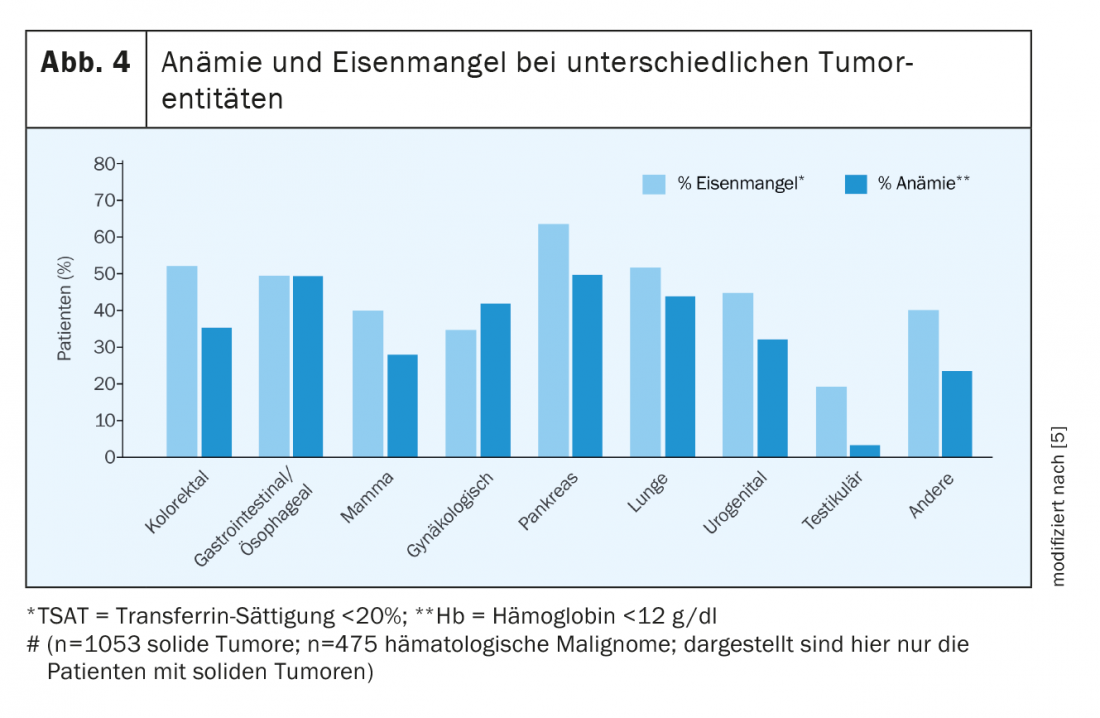
Dès le diagnostic, la moitié des patients atteints de tumeur présentent à la fois une anémie et une carence en fer. Sous traitement, les chiffres augmentent considérablement. Toutes les tumeurs ne provoquent pas une anémie ou une carence en fer dans les mêmes proportions. Dans Figure 4 donne un aperçu de la prévalence de différents types de tumeurs [5,6].
Les hémorragies chroniques sont particulièrement fréquentes dans les tumeurs gastro-intestinales ou gynécologiques. La perte de sang stimule l’érythropoïèse hyperrégénérative par le biais de l’induction réactive de l’érythropoïétine, ce qui entraîne un besoin accru de fer. Si l’inflammation chronique s’accompagne d’une carence fonctionnelle en fer et que l’érythropoïèse est inhibée par un traitement médicamenteux contre les tumeurs ou par une radiothérapie, l’érythropoïétine est souvent élevée en cas de fonction rénale normale, mais son augmentation ne suffit pas à compenser l’anémie multicausale.
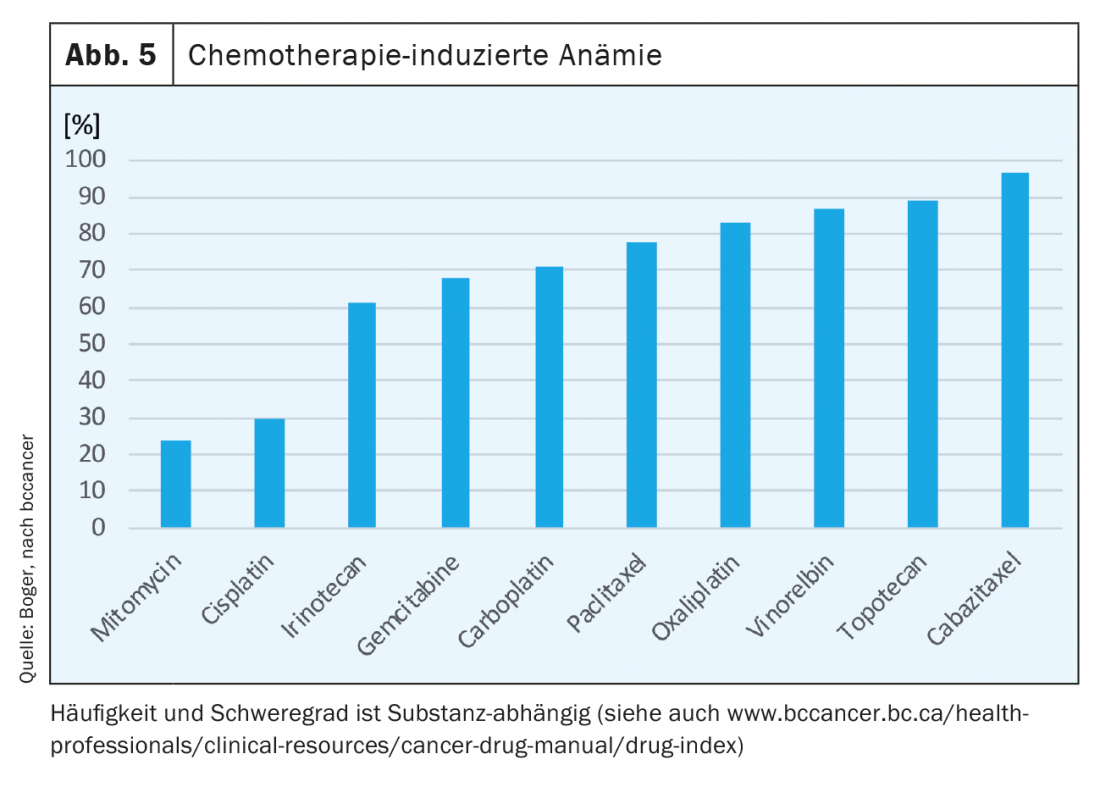
Jusqu’à 75% des patients oncologiques présentent une anémie au cours de leur traitement. En cas de radiothérapie seule, selon l’entité tumorale, jusqu’à 50% des patients. Les agents chimiothérapeutiques suppriment l’érythropoïèse et, selon la substance, provoquent une anémie. (Fig. 5). Sous les thérapies combinées, nous constatons un effet additif et une augmentation de l’anémie est également souvent observée avec le nombre de cycles [7].
Traitement de la carence en fer et de l’anémie ferriprive chez les patients atteints de tumeurs
Substitution du fer
Une carence absolue en fer constitue une indication claire de substitution. Pour calculer les besoins en fer, le calcul de Ganzoni s’est imposé :
|
Déficit total en fer (mg) = [Soll-Hb – Patienten Hb (g/dl)] × poids corporel (kg) × 2,4 + fer de réserve* (mg) * |
Substitution orale
Pour la substitution orale, il existe des préparations contenant du fer divalent et du fer trivalent. Les doses vont jusqu’à 200 mg par jour. Même s’il est très bien toléré, l’organisme peut être au max. en résorber 10%. Les patients oncologiques ont souvent des besoins très élevés et généralement une carence fonctionnelle en fer, c’est pourquoi lasubstitution orale provoquedes effets secondaires inutiles (tolérance gastro-intestinale) encas de perturbation de l’absorption, sans pour autant reconstituer efficacement les réserves de fer. Avant de décider d’un traitement de substitution orale, il faut donc connaître le statut inflammatoire et les éventuelles contre-indications à la substitution orale (résection gastrique, troubles de la malabsorption, constipation chronique, etc. Il est important d’évaluer l’adhésion au traitement, la constipation, etc.
Les substances couramment utilisées dans la supplémentation orale sont le fumarate ferreux, le gluconate ferreux et le sulfate ferreux. Des substances alternatives présentant un meilleur potentiel d’absorption et un profil de tolérance plus favorable (mais un profil de coût moins favorable) sont apparues récemment sur le marché : les complexes de fer(III)-maltol-polysaccharide et les formulations liposomales de fer(III) [8].
Une augmentation de l’hémoglobine de ≥1 g/dl devrait être observée dès 14 jours après le début de la substitution. Si ce n’est pas le cas, il convient de passer à une préparation intraveineuse [9]. Une fois les taux d’hémoglobine normalisés, la substitution orale doit être poursuivie pendant au moins trois mois afin de reconstituer les réserves de fer.
Substitution intraveineuse
La substitution intraveineuse doit être privilégiée chez les patients atteints de tumeurs présentant un trouble avéré de l’utilisation du fer et une érythropoïèse déficiente en fer ou une anémie ferriprive. L’utilisation préférentielle de formulations intraveineuses pour une supplémentation efficace s’impose, en particulier en cas de traitement simultané par des substances stimulant l’érythropoïèse [3].
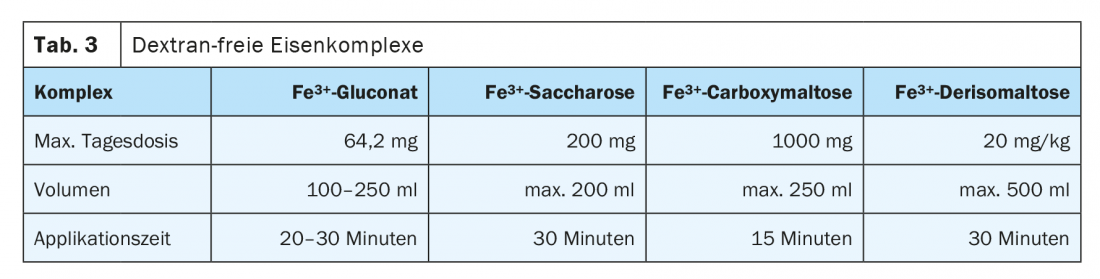
Il existe un risque de réaction anaphylactique avec toutes les préparations parentérales à base de fer en raison des partenaires de liaison du Fe, mais ce risque est très faible avec les substances modernes. L’Agence européenne des médicaments (EMA) a déjà conclu en 2013, dans le cadre d’une procédure d’évaluation des risques, que les bénéfices l’emportaient sur les risques éventuels. Le risque est plus élevé avec les préparations contenant du dextran, il est donc préférable d’utiliser des préparations sans dextran. Le gluconate ferrique, l’hydroxyde ferrique-saccharose et le carboxymaltose ferrique présentent un profil d’effets secondaires nettement plus favorable. Il s’agit de nanoparticules dissoutes de manière colloïdale. Ceux-ci sont absorbés et dégradés par le système réticulo-endothélial dans le foie et la rate. Le fer libéré est stocké ou distribué dans l’organisme par la transferrine. L’administration intraveineuse doit se faire de préférence en perfusion courte. Une application trop rapide peut dépasser la capacité de liaison de la transferrine et déclencher une symptomatologie de flush. Le volume d’application, la quantité de fer liée au complexe par perfusion et le dosage unique vs. multiple diffèrent nettement et déterminent la fréquence du traitement et les intervalles de contrôle. Dans Tableau 3 sont répertoriées plusieurs préparations sans dextran pouvant être administrées par voie intraveineuse.
Transfusion de concentrés érythrocytaires
L’indication de la transfusion est posée en fonction de l’état clinique, des facteurs de risque du patient, de la sévérité des symptômes d’anémie, du taux d’Hb (ou hématocrite), de l’acuité de la perte de sang et des possibilités de compensation [4]. Chez les patients présentant une perte de sang aiguë, une tumeur solide ou une hémoblastose, l’indication de la transfusion doit être examinée à partir d’un taux d’hémoglobine ≤8 g/dl. Les patients souffrant d’anémie chronique ont parfois des taux d’Hb compris entre 6 et 8 g/dl sans aucun symptôme et ne présentent donc aucune indication de transfusion obligatoire. Chez les patients présentant des pathologies cardiaques ou pulmonaires concomitantes, le taux d’hémoglobine doit être stabilisé à 10 g/dl.
Thérapie avec des agents stimulant l’érythropoïèse
Dans le cas de l’anémie induite par la chimiothérapie, Erythropoese-stimuling Agencies (ESA) sont autorisés pour les anémies symptomatiques avec un taux d’Hb -≤10 g/dl [4]. L’association de l’ASE et de la substitution intraveineuse de fer sous chimiothérapie peut réduire de manière significative le nombre de transfusions sanguines [10]. La supplémentation en fer doit précéder le traitement par ASE. Cependant, les risques liés au profil de risque thrombophile et les bénéfices individuels d’un traitement par ASE pour le patient doivent être soigneusement évalués [11].
D’autres approches thérapeutiques de la carence fonctionnelle en fer des patients atteints de tumeurs, telles que la thérapie androgénique ou l’utilisation de l’hepcidine et des antagonistes de la protéine morphogénétique de l’os (BMP), font actuellement l’objet de recherches cliniques [12].
Résumé
La carence en fer et l’anémie sont difficiles à considérer séparément chez les patients oncologiques. L’anémie et la carence en fer ont généralement plusieurs causes. Il faut donc toujours exclure ou traiter d’autres causes non spécifiques à la tumeur. La plupart des patients oncologiques sont vulnérables à la malnutrition et il convient de procéder rapidement à une évaluation qualifiée du statut nutritionnel et à des conseils réguliers en matière de nutrition pendant le traitement oncologique. Cependant, chez la plupart des patients, une carence en fer se produit malgré un apport oral optimisé. En cas de carence en fer due à des hémorragies chroniques et à une inflammation chronique, les besoins accrus de l’organisme ne peuvent et ne doivent pas être couverts par une substitution orale.
La chimiothérapie supprime l’érythropoïèse et la sécrétion endogène d’érythropoïétine ne répond pas aux besoins de stimulation, avec bilan érythropoïétique négatif permanent. La thérapie transfusionnelle ne doit être utilisée qu’en cas de nécessité de correction immédiate de l’anémie (hémorragie, risque cardio-circulatoire) en raison de ses effets toxiques et de son potentiel pronostique négatif. La supplémentation en fer par voie intraveineuse est le traitement préféré pour éviter ou corriger l’anémie.
Messages Take-Home
- En cas de diagnostic initial d’une maladie maligne, il convient de procéder à une analyse du substrat de l’érythropoïèse et à un diagnostic de l’anémie.
- L’Hb, le statut du fer (TSAT, ferritine sérique) et la CRP doivent être déterminés au début et avant chaque cycle de chimiothérapie.
- La carence fonctionnelle en fer chez les patients cancéreux se caractérise par une utilisation perturbée des réserves de fer intrinseques.
- Le fer oral ne doit être envisagé que chez les patients présentant une carence absolue en fer (ferritine <30 ng/ml) et un état non inflammatoire (CRP <5 mg/l).
- La supplémentation en fer par voie intraveineuse est le traitement à privilégier chez les patients oncologiques.
Littérature :
- Finberg KE : Régulation de l’homéostasie systémique du fer. Current opinion in hematology 2013 ; 20(3) : 208-214.
- Ludwig HE, et al : Métabolisme du fer et supplémentation en fer chez les patients cancéreux. Wien Klin Wochenschr 2015 ; 127(23-24) : 907-919.
- Hastka J, et al : Carence en fer et anémie ferriprive. Onkopedia Leilinien 2020 ; www.onkopedia.com/de/onkopedia/guidelines/eisenmangel-und-eisenmangelanaemie/@@guideline/html/index.html, consulté le 29.06.2020.
- Jordan K, et al. : Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF) : Supportive Therapie bei onkologischen PatientenInnen – Langversion 1.3.2020 ; www.leitlinienprogrammonkologie.de/leitlinien/supportive-therapie, consulté le 29.06.2020.
- Ludwig H, et al : Prévalence de la carence en fer à travers différentes tumeurs et son association avec un mauvais état de performance, l’état de la maladie et l’anémie. Annals of oncology : official journal of the European Society for Medical Oncology/ESMO 2013 ; 24(7) : 1886-1892.
- Ludwig H, et al : The European Cancer Anaemia Survey (ECAS) : a large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. Eur J Cancer 2004 ; 40(15) : 2293-2306.
- Xu H, et al. : Incidence de l’anémie chez les patients diagnostiqués avec des tumeurs solides recevant une chimiothérapie, 2010-2013. Clin Epidemiol 2016 ; 8 : 61-71.
- Farrag K, et al. : Nouvelles options pour la substitution orale du fer. Thérapie médicamenteuse 2019 ; 37(4) : 105-112.
- Okam MM, et al : Iron Supplementation, Response in Iron-Deficiency Anemia : Analysis of Five Trials. The American journal of medicine 2017 ; 130(8) : 991 e991-991 e998.
- Bastit L, et al : Randomized, multicenter, controlled trial comparing the efficacy and safety of darbepoetin alpha administered every 3 weeks with or without intravenous iron in patients with chemotherapy-induced anemia. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2008 ; 26(10) : 1611-1618.
- Aapro M, et al : Management of anaemia and iron deficiency in patients with cancer : ESMO Clinical Practice Guidelines. Annals of oncology : official journal of the European Society for Medical Oncology/ESMO 2018 ; 29(Suppl 4) : iv96-iv110.
- Gilreath JA, Rodgers GM : Comment je traite l’anémie cancéreuse. Blood 2020 ; doi : 10.1182/blood.2019004017.
InFo ONKOLOGIE & HÉMATOLOGIE 2020 ; 8(6) : 10-15