Pendant longtemps, le traitement du lupus a été marqué par l’immobilisme. Cependant, après 20 années de frustration, les choses commencent enfin à bouger dans le développement de nouvelles options thérapeutiques. Des études ont montré des résultats prometteurs pour trois molécules spécifiquement destinées au traitement de la néphrite lupique. L’ancien principe d’induction et de conservation a définitivement fait son temps.
Comme pour toutes les maladies génétiques, il existe des formes monogéniques de lupus érythémateux disséminé (LED). Mais pour chaque patient présentant une mutation aussi grave, il y en a 1000 autres qui présentent des variantes mineures. Chez eux, par exemple, ce n’est pas toute la protéine qui manque, mais seulement un seul domaine, ce qui fait que l’évolution de la maladie est beaucoup moins grave. Dans le lupus, les patients présentent souvent des variantes génétiques non pas dans un seul gène, mais dans plusieurs, et c’est alors la somme des petits détails qui définit en fin de compte cette maladie.
Cette constellation varie d’un patient à l’autre. En ce qui concerne la néphrite lupique (LN), les variants génétiques affectent également le rein, ce qui peut entraîner par exemple une faiblesse de la membrane basale (les patients deviennent rapidement hématuriques), une faiblesse endothéliale (entraînant des complications vasculaires) ou une faiblesse podocytaire (protéinurie, syndrome néphrotique). Onset, classe et pronostic du LN sont génétiquement déterminés. Un diagnostic génétique est particulièrement intéressant en cas d’antécédents familiaux, de LED dans l’enfance et de cas atypiques/syndromiques.
L’idée largement répandue selon laquelle le lupus est une maladie qui se manifeste par poussées peut être rejetée, du moins pour la néphrite lupique, a expliqué le professeur Hans-Joachim Anders, du Centre de néphrologie de l’Université de Munich [1] : “Il n’y a pas de poussée de LN, il n’y a jamais que des personnes qui ne suivent pas ou pas suffisamment leur traitement. Ou lorsque le médecin et le patient ont décidé de réduire les doses – et la maladie reprend alors à un moment donné parce que le traitement n’a pas suffi. Mais c’est une maladie chronique qui persiste”. Il faut donc trouver la dose de médicaments qui est suffisante et s’y tenir.
Pas de LN sans CKD
Une protéinurie est toujours le signe d’une maladie rénale, a rappelé le néphrologue. “Si vous avez une protéine positive dans la bandelette, cela signifie presque toujours qu’il y a une lésion des podocytes”. Les podocytes sont les cellules de la barrière de filtration dans les glomérules, ils sont particulièrement sensibles et lorsqu’ils sont endommagés (immunologiquement, toxiquement ou génétiquement), la protéinurie se produit. C’est pourquoi la détection d’une protéinurie dans la bandelette urinaire est toujours le signe d’une maladie rénale. “Inutile d’envoyer le patient chez l’urologue, il n’y a pas de maladie en urologie qui puisse expliquer une protéinurie”. Le néphrologue est plutôt le bon interlocuteur dans un tel cas. En revanche, l’hématurie peut parfois survenir en cas de maladie urologique, mais elle se produit bien sûr aussi en cas de maladie rénale. En particulier, la combinaison de l’hématurie et de la protéinurie ne peut en fait s’expliquer que par une maladie rénale. “On appelle généralement cela un syndrome néphritique, et c’est particulièrement fréquent dans le lupus”.
Une hématurie permet toutefois de conclure qu’une membrane basale a dû être rompue, car sinon les érythrocytes ne passeraient pas. En ce sens, le sang dans l’urine est toujours le signe d’une membrane basale endommagée et, s’il est associé à une protéinurie, il provient probablement des glomérules, ce qui rend probable un contexte immunologique dans le lupus. Les lignes directrices indiquent que les patients présentant une protéinurie supérieure à 500 milligrammes par jour doivent subir une biopsie rénale. La biopsie est ensuite évaluée sur la base d’un score qui date maintenant de près de 20 ans, ce que le professeur Anders a critiqué. Des initiatives de mise à jour existent, mais rien de concret n’est encore disponible.

Important : tout patient souffrant de néphrite lupique est, par définition, atteint de maladie rénale chronique (MRC). “Dans ce cas, le néphrologue devrait être impliqué à un moment ou à un autre, et pas seulement au moment de la dialyse”. Une LN est toujours présente depuis plus de trois mois, ce qui en fait une maladie chronique. Il existe 5 stades différents : si la fonction rénale est encore correcte, la LN peut tout à fait être au stade 1, mais il s’agit néanmoins dans tous les cas d’une maladie rénale chronique. La maladie rénale signifie également que les néphrons sont perdus plus rapidement que par le processus de vieillissement normal. La durée de vie des reins s’en trouve raccourcie. “Et comme tous mes patients veulent vivre au moins 90 ans, ça commence à faire juste derrière”, a averti l’expert. Il a également rappelé que les taux à 10 ou 15 ans peuvent sembler intéressants pour le médecin, mais qu’ils ne sont pas intéressants pour les femmes de 25 ans, qui ne veulent pas être dialysées même à 40 ans. Il faut donc se battre pour les néphrons des patients, et ce bien avant que la créatinine n’augmente. Lorsque cela se produit, la moitié des néphrons est déjà perdue.
Maintenir la cortisone à feu doux
Le professeur Anders a rejeté le terme de “néphrite lupique réfractaire” dans le domaine des contes de fées. Il est vrai qu’il y a déjà des patients qui ont un lupus difficile à contrôler sur le plan immunologique. Il a toutefois recommandé d’utiliser dans ces cas le traitement standard (stéroïdes pulsés plus traitement IS de première ligne), auquel la plupart des patients répondent. Les lignes directrices indiquent qu’il faut d’abord utiliser le cyclophosphamide ou le MMF pour la LN, puis changer si cela ne fonctionne pas, mais “cela n’a aucun sens”. L’expert a comparé cela à l’administration d’un antibiotique en cas d’infection, qui n’est pas remplacé par un autre antibiotique en cas de non-réponse. Ici comme ailleurs, il faudrait plutôt envisager un re-diagnostic, voire un frottis. “Donc si le patient ne répond pas au traitement de première ligne, en parler à un centre ou faire une biopsie, un diagnostic génétique, un profil immunitaire”. Et surtout, vérifier la non-adhésion, maintenant que le MMF est de plus en plus utilisé par voie orale.
Comment augmenter l’adhérence – en général, le médecin doit beaucoup parler avec le patient (au moins 1 consultation d’une heure) : La pathogenèse (contagion, hérédité), la prise de la pilule, les vaccins, les facteurs de risque cardiovasculaire, la réduction de l’anxiété et l’évitement des “tours de passe-passe” tels que les guérisseurs ou l’utilisation de pierres chaudes doivent être abordés et expliqués en détail. L’adhésion peut en outre être assurée par la responsabilité personnelle et l’autoprotection : une protection solaire (au moins de force 50) dès le mois d’avril en fait sans aucun doute partie. L’hydroxychloroquine peut être utilisée chez tous les patients, mais pas la cortisone orale >5 mg (le cas échéant, le belimumab). La soi-disant “poussée” – qui, comme expliqué précédemment, n’existe pas – n’est plus traitée par 20 mg de cortisone par voie orale, comme cela se faisait auparavant. Au lieu de cela, il n’y a aujourd’hui que 3 fois 250 mg de méthylprednisolone en pulsothérapie sur une période de 3 jours. Ensuite, on continue avec la dose d’entretien normale, sinon l’exposition à la cortisone est beaucoup trop élevée. Il ne faut cependant pas arrêter les derniers mg de cortisone, a conseillé le spécialiste. “Sinon, un tiers des patients feront de nouvelles rechutes”. Le lupus est une maladie permanente, il faut donc appliquer un traitement permanent. 2-4 mg de cortisone à long terme ne font pas une grande différence.
L’hydroxychloroquine doit être réduite de 50% en cas de détérioration de la fonction rénale, mais heureusement seulement lorsque le DFGe est de 20 ml/min (les lignes directrices recommandent 30 ml/min).
Crème solaire pour se protéger
La thérapie ne peut rien changer au problème de base, à savoir le patrimoine génétique. Seule la prévention de la mort cellulaire est possible. Cela signifie en premier lieu : mettre de la crème solaire. En effet, les coups de soleil entraînent régulièrement la libération d’énormes quantités de matière nucléaire, ce qui peut effectivement déclencher une poussée. Une protection solaire soigneuse est donc recommandée à tous les patients atteints de lupus.
Le rituximab ne s’est pas vraiment imposé comme une option d’immunosuppression. Des études montrent que les patients gravement malades semblent en bénéficier, mais par rapport à tous les groupes de patients, la valeur p n’est pas assez bonne, c’est pourquoi toutes les études sont négatives à ce jour. En revanche, l’obinutuzumab (OBI), qui élimine toutes les cellules B en quelques jours, est un dépléteur de cellules B nettement plus puissant que le rituximab, d’où son efficacité accrue. L’obinutuzumab est autorisé dans la sclérose en plaques et l’étude de phase 2 NOBILITY a désormais démontré son efficacité dans la LN. L’étude a montré un effet de 22% sur l’ensemble des patients présentant une LN confirmée par biopsie, ce qui correspond à un doublement du nombre de patients ayant obtenu une réponse complète. Off label, l’obinutuzumab peut déjà être utilisé.
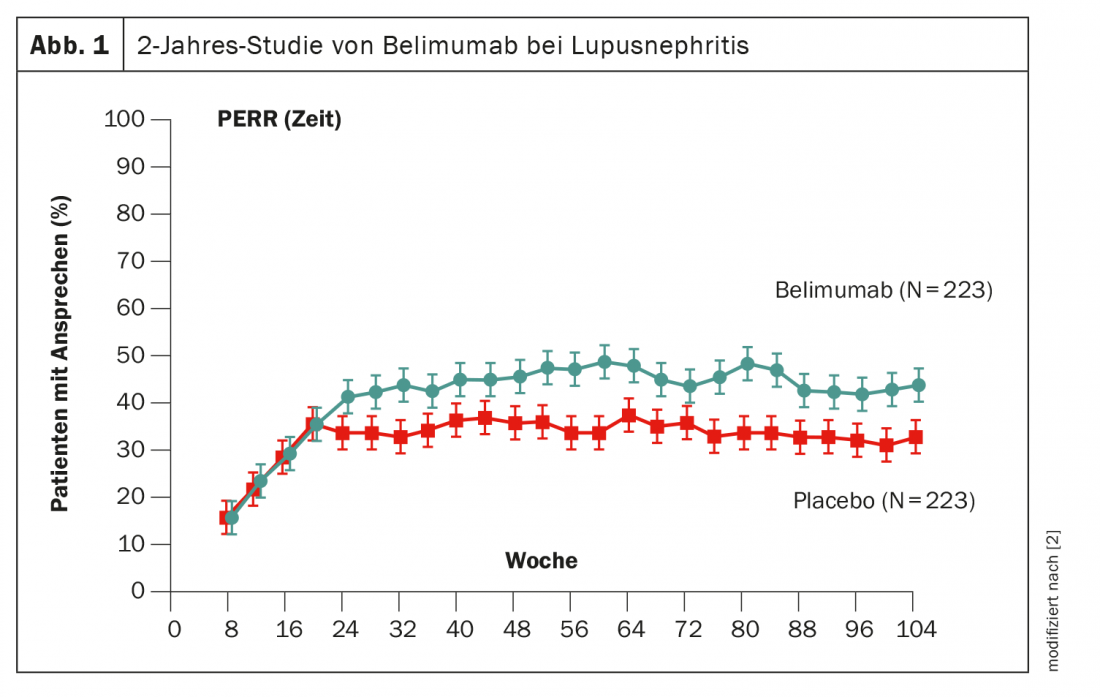
Une autre façon de manipuler les cellules B est le belimumab, qui a déjà fait ses preuves sur le terrain. Dans l’étude de phase 3 BLISS, les patients ont reçu du belimumab dès le début et pendant 2 ans [2]. Après environ 6 mois, un avantage statistiquement significatif par rapport au placebo a été observé, bien que l’intensité de l’effet (11%) ait été inférieure à celle de l’obinutuzumab (Fig. 1). La substance active est déjà autorisée en Suisse.
Le tacrolimus fait partie des immunosuppresseurs qui agissent principalement sur la prolifération des lymphocytes T. Le tacrolimus est un médicament qui agit sur les lymphocytes T. Il est également utilisé pour traiter les infections à VIH. Cette substance a déjà fait l’objet de discussions ces dernières années, car elle est utilisée en Asie en combinaison avec le MMF. Toutefois, aucune donnée n’est encore disponible pour les Européens. L’étude de phase 3 AURORA a démontré l’efficacité de la voclosporine, qui est un inhibiteur de la calcineurine comme le tacrolimus. La taille de l’effet après 52 semaines était de 18%, l’effet concernait essentiellement la protéinurie. Là encore, le nombre de cas ayant obtenu une réponse complète a presque doublé.
Le point commun de toutes ces nouvelles options thérapeutiques est qu’elles ne visent plus l’induction et le maintien, mais suggèrent d’emblée une thérapie combinée à long terme. “Le lupus est ainsi reconnu comme une maladie auto-immune chronique, qui nécessite également un traitement chronique”, a déclaré le professeur Anders. “On donne une forte dose de cortisone au début et on continue ensuite avec un traitement continu. Cela semble bien mieux fonctionner que les anciennes idées d’induction et de maintien”.
En ce qui concerne le monitoring, beaucoup dépend de la protinurie : si elle descend en dessous de 0,8 en l’espace d’un an, cela a une valeur prédictive très élevée pour le résultat à long terme, ces patients ont donc un bon pronostic à long terme. Ceux qui n’y parviennent pas peuvent avoir besoin d’un nouveau protocole ou d’une nouvelle biopsie après 12 mois. Le conseil du professeur Anders à ses collègues : “Chez nous, nous expliquons à tous les patients, dès la première biopsie, qu’il y en aura une deuxième dans un an, afin de voir si le traitement a été efficace”.
Résumé
- Le lupus est une maladie polygénique qui entraîne une perte de tolérance au matériel nucléaire.
- Le pronostic est individuel.
- Second tour de diagnostic si pas de RC
- Thérapeutique CYC/MMF et AZA/MMF, nouvelles options thérapeutiques à venir/déjà disponibles (obinutuzumab, belimumab, voclosporine).
- Pour le suivi, néphrologie basée sur la SCr/protéinurie, si le patient ne répond pas, biopsie de contrôle. En cas de non-réponse, envisager également de contacter un centre de lupus.
– FomF Rhumatisme Néphro Refresher (en ligne)
Sources :
- Conférence “Antisynthetase Syndromes” dans le cadre du FomF Rheuma Nephro Refreshers (en ligne), 30.10.2020.
- Furie R, et al : Two-Year, Randomized, Controlled Trial of Belimumab in Lupus Nephritis. N Engl J Med 2020 ; 383 : 1117-1128 ; doi : 10.1056/NEJMoa2001180.
InFo DOULEUR & GERIATRIE 2020 ; 2(2) : 28-30 (publié le 7.12.20, ahead of print)