Un pour cent des femmes sont touchées par une insuffisance ovarienne prémature. La cause exacte est souvent inconnue.
Le terme d’insuffisance ovarienne prématurée (IOP) désigne la perte prématurée de la fonction ovarienne avant l’âge de 40 ans avec l’apparition combinée consécutive d’un hypogonadisme hypergonadotrope et d’une aménorrhée primaire/secondaire.
On estime que la prévalence de l’IOP est de 1% de la population féminine avant l’âge de 40 ans et de 0,1% avant l’âge de 30 ans. La ménopause entre 40 et 44 ans est appelée “ménopause précoce” et a une prévalence de 5%. Une ménopause à partir de 45 ans est considérée comme régulière [1].
Diagnostic
Une IOP existe lorsque les critères de diagnostic suivants sont remplis :
- Aménorrhée primaire ou secondaire ≥4 mois
- Âge <40 ans
- FSH ≥25 U/l, deux mesures à >4 semaines d’intervalle
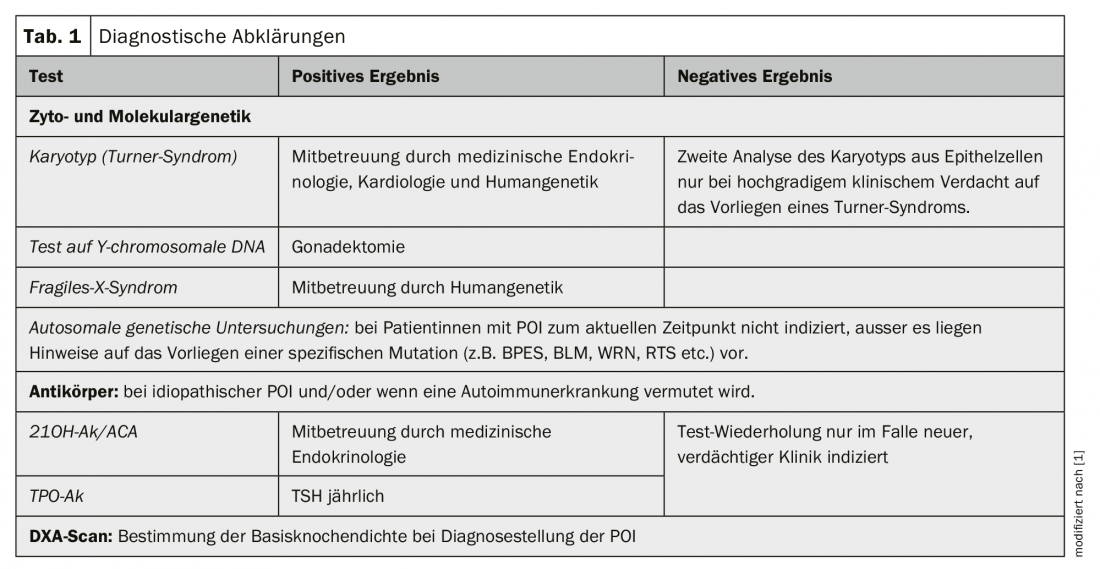
Le tableau 1 donne un aperçu des examens diagnostiques.
Étiologie
POI idiopathiques : dans la grande majorité des POI (85-90%), aucune cause précise ne peut être identifiée. On parle alors d’IOP idiopathique [1].
POI d’origine génétique : des anomalies chromosomiques sont détectables chez 10 à 13% des patientes atteintes de POI. La majorité (94%) sont des aberrations numériques et/ou structurelles du chromosome X (par exemple, le syndrome de Turner) [1]. Dans les cas de dysgénésie gonadique avec ADN chromosomique Y détectable, une gonadectomie prophylactique est recommandée en raison du risque nettement plus élevé (45%) de développer une tumeur maligne gonadique au cours de l’évolution [2]. Un caryotype doit être réalisé chez toutes les femmes présentant une POI non iatrogène [1].
Le syndrome de l’X fragile (syndrome de Martin Bell) est la cause la plus fréquente de retard mental héréditaire. Cette maladie à transmission dominante liée au chromosome X et à pénétrance réduite dans le sexe féminin est causée par une mutation du gène FMR1 (“fragile-X-mental-retardation 1”) situé sur le bras long du chromosome X. Le gène FMR1 est un gène de la famille des gènes de la maladie de Parkinson. En présence d’une prémutation, le risque de développer une POI est de 13 à 26% dans le sexe féminin, mais pas en présence d’une mutation complète. Chez les patientes présentant une POI sporadique, on peut s’attendre à une prévalence de prémutation FraX de 0,8 à 7,5%, voire jusqu’à 13% chez les patientes ayant des antécédents familiaux positifs de POI [3]. L’exclusion génétique d’une prémutation FraX est indiquée chez toutes les patientes atteintes d’IOP [1].
IOP d’origine auto-immune : chez environ 5 % des patientes ayant une IOP, le tableau clinique est dû à une lésion de l’ovaire d’origine auto-immune. Dans la majorité des IOP d’origine auto-immune, d’autres organes que l’ovaire sont impliqués dans le processus auto-immun dans le cadre d’un syndrome auto-immun polyglandulaire de type 1/2. Dans 60 à 80% des cas, l’auto-immunité est dirigée contre le cortex surrénalien et dans 14 à 27% des cas, elle est dirigée contre la thyroïde. La biopsie ovarienne pour diagnostiquer une POI d’origine auto-immune est considérée comme obsolète. La détection sérologique d’anticorps anti-cellules stéroïdes (SCA), tels que l’ ? 21OH-Ak (21-hydroxylase-Ak) ou ACA/NNR-Ak (adrénocortical Ak/corticosurrénaline-Ak), qui sont tous dirigés contre les enzymes impliquées dans la synthèse des hormones stéroïdiennes et donc potentiellement contre le cortex surrénalien, l’ovaire, le testicule et le placenta, est le marqueur présentant la plus grande sensibilité diagnostique pour une IOP d’origine auto-immune. Par conséquent, un dépistage de la 21OH-Ak ou, à défaut, de l’ACA/NNR-Ak doit être proposé à toutes les patientes atteintes d’IOP idiopathique. En outre, un dépistage des Ac thyroïdiens (TPO-Ak) est indiqué chez toutes les patientes présentant une POI idiopathique [1].
POI suite à des interventions iatrogènes (chimiothérapie, radiothérapie, chirurgie) : Les chimiothérapies cytotoxiques ont un effet gonadotoxique plus ou moins important en fonction de l’agent utilisé, de la dose cumulée ainsi que de l’âge de la patiente, ce qui s’accompagne à son tour d’un risque accru de développer une POI.
De même, la radiothérapie affecte la fonction ovarienne jusqu’à l’IOP, en fonction de la dose d’irradiation, du champ d’irradiation et de l’âge de la patiente.
Les interventions chirurgicales sur les ovaires, telles que l’ablation d’endométriomes en cas d’endométriose, entraînent également une diminution significative de l’âge de la ménopause et un risque accru d’IOP en raison de la perte de tissu ovarien sain et de la réduction de la réserve ovarienne qui en résulte [4,5].
Séquences à court terme des POI
Comme pour la ménopause régulière, l’intensité des symptômes liés à la carence en œstrogènes varie en cas d’IOP. La gamme s’étend des patientes complètement asymptomatiques, qui se présentent simplement pour un examen d’aménorrhée, jusqu’aux patientes qui souffrent énormément. Les symptômes typiques de la ménopause comprennent des troubles vasomoteurs, tels que des bouffées de chaleur et des sueurs, des troubles du sommeil, un épuisement physique et mental, une atrophie urogénitale avec une vessie hyperactive, une incontinence à l’effort, une sécheresse vaginale avec dyspareunie consécutive, des infections urinaires récurrentes, des problèmes sexuels avec baisse de la libido et modification de la satisfaction sexuelle, des douleurs articulaires et musculaires diffuses et une humeur dépressive. En fonction des symptômes, le traitement consiste en une substitution œstrogénique systémique et, le cas échéant, en une substitution œstrogénique locale. Mais même les patientes POI qui sont asymptomatiques ont besoin d’un THS systémique conséquent pour prévenir les effets négatifs à long terme de la carence précoce en œstrogènes sur la santé cardiovasculaire, le métabolisme osseux et la fonction cognitive [6].
Conséquences à long terme des POI
Santé cardiovasculaire : en raison de la disparition prématurée de l’effet cardiovasculaire protecteur des œstrogènes, les patientes atteintes d’IOP présentent un risque significativement accru de maladies cardiovasculaires et une mortalité cardiovasculaire significativement plus élevée [7]. Il est recommandé de commencer la substitution par stéroïdes sexuels le plus tôt possible et de la poursuivre jusqu’à l’âge moyen de la ménopause, qui est de 52 ans, afin de lutter au mieux contre l’augmentation du risque cardiovasculaire [1].
Santé osseuse : l’influence favorable des œstrogènes sur la régulation du métabolisme osseux et le maintien de la structure osseuse, ainsi que les conséquences négatives de la ménopause naturelle sur la densité osseuse et le risque de fracture sont parfaitement connus. Il a été démontré que l’IOP est associée à une réduction de la densité osseuse due à une carence en œstrogènes. On peut donc en conclure que l’IOP est consécutivement associée à un risque accru de fracture, même si cette hypothèse n’est pas encore suffisamment étayée par des études à l’heure actuelle [8]. En cas de diagnostic de POI, il est recommandé de réaliser un scanner DXA pour déterminer la densité osseuse de base. En cas de densité osseuse normale pour l’âge et d’initiation d’un THS suffisamment dosé, il n’est pas nécessaire de répéter le scan DXA [1].
L’œstrogénothérapie substitutive est un traitement de choix à la fois pour la prévention et le traitement de l’ostéoporose chez les patientes atteintes d’IOP. Par conséquent, il est recommandé d’initier un THS le plus tôt possible et de le poursuivre jusqu’à l’âge physiologique moyen de la ménopause [6].
Fertilité, grossesse et risques obstétricaux : le THS n’est pas contraceptif et peut/doit donc être recommandé à toutes les patientes qui souhaitent avoir des enfants. Un régime séquentiel est favorisé en cas de désir d’enfant positif. En revanche, les patientes pour lesquelles une grossesse n’est pas envisageable ont besoin d’une anticonception sûre [1].
En raison de l’activité ovarienne intermittente, surtout au début, les chances d’une grossesse spontanée en cas d’IOP ne peuvent pas être totalement exclues, même si elles sont très faibles. Les chances de conception spontanée diminuent naturellement avec la durée de l’aménorrhée. Une revue systématique sur la fertilité et le déroulement de la grossesse en cas d’IOP a révélé une probabilité de conception spontanée de 5 à 10 %. 80% de ces grossesses ont abouti à une naissance vivante et 20% à un avortement – des chiffres qui ne diffèrent pas de ceux des femmes normalement fertiles [9].
À l’heure actuelle, il n’existe aucune mesure de médecine de la reproduction connue pour améliorer de manière fiable l’activité ovarienne et, par conséquent, le taux de conception spontanée en cas d’IOP. Il ne faut pas s’attendre à une réponse ovarienne à une stimulation par des gonadodrophines et/ou à une induction de l’ovulation en raison de l’épuisement de la réserve ovocytaire avec, par conséquent, des gonadotrophines déjà élevées de manière endogène. Une fois que le diagnostic d’IOP est posé, l’option de protection de la fertilité est par conséquent également dépassée. Le don d’ovocytes est une option réaliste et bien établie pour les patientes atteintes d’IOP afin de tomber enceinte malgré tout [1].
Santé neurologique : plusieurs grandes études d’observation ont mis en évidence un risque accru de déclin des fonctions cognitives ou de développement d’une démence chez les patientes atteintes d’IOP. Le risque de troubles cognitifs augmentait avec le jeune âge de la patiente au moment du diagnostic. Chez les patientes ayant suivi un traitement œstrogénique substitutif jusqu’à l’âge de 50 ans, aucune déficience mentale ni aucun risque accru de démence n’ont été observés [10, 11]. Par conséquent, afin de réduire au maximum le risque de troubles cognitifs potentiels liés à la carence hormonale chez les patientes atteintes d’IOP, un THS doit être administré au moins jusqu’à l’âge moyen de la ménopause [1].
Fonction sexuelle et urogénitale : un traitement œstrogénique substitutif systémique adéquat constitue la base d’une fonction sexuelle et urogénitale normale. Si cela ne suffit pas, des œstrogènes locaux peuvent être utilisés en complément. En ce qui concerne une supplémentation optionnelle en androgènes, les données d’efficacité et de sécurité à long terme font défaut [1].
Qualité de vie : le diagnostic d’une IOP a un impact négatif significatif sur le bien-être psychologique et la qualité de vie de la personne concernée. Cela doit être abordé lors d’entretiens et un soutien psychologique doit être proposé.
Thérapie hormonale de substitution
Le THS en cas d’IOP n’est pas seulement indiqué pour soulager les symptômes liés à la carence en œstrogènes, tels que les troubles vasomoteurs, mais également à titre prophylactique. Un THS à dose au moins standard doit être recommandé aux patientes atteintes d’IOP pour la prévention primaire des maladies cardiovasculaires et pour la neuroprotection osseuse et neurologique jusqu’à ce qu’elles atteignent l’âge physiologique moyen de la ménopause [1].
Principe actif : on utilise d’une part le THS classique (œstrogène : estradiol) et d’autre part des contraceptifs oraux combinés (œstrogène : éthinylestradiol). Pour la protection de l’endomètre, on peut utiliser aussi bien des progestatifs synthétiques que la progestérone micronisée “bio-identique”, chacun à une dose de transformation.
Régime : afin d’éviter autant que possible les symptômes de carence en œstrogènes, un traitement œstrogénique substitutif continu est recommandé. La grande majorité des THS autorisés répondent à cette exigence, mais pas la majorité des anticonceptifs hormonaux autorisés. Il n’est pas rare que les femmes atteintes d’IOP sous anticonception orale combinée selon le schéma 21/7 présentent des symptômes pendant l’intervalle sans pilule. En cas de besoin d’anticonception, il est donc conseillé de prescrire des pilules en schéma 24/4 ou 26/2 ou en cycle long.
La question se pose maintenant de savoir s’il est préférable d’administrer les progestatifs de manière additive de façon continue ou cyclique. En principe, les deux régimes de THS peuvent être utilisés, selon la préférence de la patiente. En raison d’une activité ovarienne souvent intermittente, en particulier au début, des saignements vaginaux imprévisibles peuvent se produire de manière répétée dans le cadre d’un régime combiné continu. En raison des saignements de privation hormonale régulés lors de l’utilisation d’un schéma séquentiel, ce dernier est souvent préféré par les patientes, du moins au début. Il en va de même chez les femmes qui souhaitent avoir un enfant, car un régime séquentiel reproduit au mieux le cycle endométrial régulier avec une alternance cyclique de la phase de prolifération et de la phase de sécrétion. La demande d’aménorrhée est satisfaite par le régime combiné continu, qui est supérieur au régime séquentiel en termes de sécurité endométriale [1].
Forme galénique : les données sur le THS chez les femmes ménopausées à temps montrent que les œstrogènes oraux augmentent significativement le risque de TEV. C’est là l’avantage d’un traitement œstrogénique transdermique, qui n’a pas d’incidence sur ce risque [17]. L’administration transdermique d’estradiol, contrairement à la forme per os, permet de contourner l’effet de premier passage dans le foie et donc d’éviter le déplacement de l’équilibre hémostasique vers la procoagulation. Même si l’on manque de données sur l’IOP à ce sujet, l’administration transdermique d’œstrogènes est préférable chez les patientes présentant un risque accru de TEV [1].
Le cancer du sein – le risque le plus redouté : selon les données actuelles, les patientes ayant bénéficié d’une IOP présentent même un risque significativement plus faible de cancer du sein par rapport au groupe témoin. Cela est le plus probablement dû à la carence prématurée en stéroïdes sexuels qui accompagne inévitablement l’IOP. Les femmes atteintes d’IOP doivent être rassurées en ce sens que, selon les données actuelles, le THS avant l’âge normal/physiologique de la ménopause n’entraîne pas de risque accru de cancer du sein par rapport à la population normale. Le fait qu’un THS appliqué à des patientes après 50 ans augmente significativement le risque de cancer du sein en fonction de la durée du traitement ne doit pas être extrapolé aux patientes atteintes d’IOP [1,6].
Messages Take-Home
- L’insuffisance ovarienne prématurée nécessite un diagnostic complet : anamnèse (chimiothérapie, radiothérapie, chirurgie), recherche de causes génétiques, exclusion d’un syndrome auto-immun polyglandulaire.
- Lors de l’établissement du diagnostic, il est recommandé de réaliser un scan DXA pour déterminer la densité osseuse de base.
- Les approches thérapeutiques causales font défaut.
- Un traitement hormonal substitutif (THS) est indiqué jusqu’à ce que l’âge moyen de la ménopause soit atteint, afin de contrecarrer les effets négatifs à long terme de la maladie, liés à la carence en œstrogènes, sur la santé osseuse, le système cardiovasculaire et la fonction cognitive.
Littérature :
- European Society for Human Reproduction and Embyology (ESHRE) Guideline Group on POI, et al : ESHRE Guideline : management of women with premature ovarian insufficiency. Hum Reprod 2016 ; 31(5) : 926-937.
- Michala L, et al : Swyer syndrome : presentation and outcomes. BJOG 2008 ; 115(6) : 737-741.
- Wittenberger MD, et al : La prémutation FMR1 et la reproduction. Fertil Steril 2007 ; 87(3) : 456-465.
- Raffi F, Metwally M, Amer S : The impact of excision of ovarian endometrioma on ovarian reserve : a systematic review and meta-analysis. J Clin Endocrinol Metab 2012 ; 97(9) : 3146-3154.
- Coccia ME, et al : La chirurgie de l’ovaire pour les endométriomes bilatéraux influence l’âge à la ménopause. Hum Reprod 2011 ; 26(11) : 3000-3007.
- Hamoda H : British Menopause Society and Women’s Health Concern : The British Menopause Society and Women’s Health Concern recommendations on the management of women with premature ovarian insufficiency. Post Reprod Health 2017 ; 23(1) : 22-35.
- Roeters van Lennep JE, et al : Risque de maladie cardiovasculaire chez les femmes souffrant d’insuffisance ovarienne prématurée : une revue systématique et une méta-analyse. Eur J Prev Cardiol 2016 ; 23(2) : 178-186.
- Kanis JA, et al : A systematic review of intervention thresholds based on FRAX : A report prepared for the National Osteoporosis Guideline Group and the International Osteoporosis Foundation. Arch Osteoporos 2016 ; 11(1) : 25.
- van Kasteren YM, Schoemaker J : Insuffisance ovarienne précoce : une revue systématique des interventions thérapeutiques visant à restaurer la fonction ovarienne et à obtenir une grossesse. Hum Reprod Update 1999 ; 5(5) : 483-492.
- Rocca WA, et al : Risque accru de déficience cognitive ou de démence chez les femmes ayant subi une oophorectomie avant la ménopause. Neurology 2007 ; 69(11) : 1074-1083.
- Phung TK, et al : Hystérectomie, oophorectomie et risque de démence : une étude de cohorte historique à l’échelle nationale. Dement Geriatr Cogn Disord 2010 ; 30(1) : 43-50.
- Langrish JP, et al : Effets cardiovasculaires des régimes de remplacement des stéroïdes sexuels physiologiques et standard dans l’infertilité ovarienne précoce. Hypertension 2009 ; 53(5) : 805-811.
- Crofton PM, et al : Physiological versus standard sex steroid replacement in young women with premature ovarian failure : effects on bone mass acquisition and turnover. Clin Endocrinol (Oxf) 2010 ; 73(6) : 707-714.
- Cartwright B, et al : Hormone Replacement Therapy Versus the Combined Oral Contraceptive Pill in Premature Ovarian Failure : A Randomized Controlled Trial of the Effects on Bone Mineral Density. J Clin Endocrinol Metab 2016 ; 101(9) : 3497-3505.
- Mueck AO : Traitement de substitution hormonale post-ménopausique et maladie cardiovasculaire : la valeur de l’estradiol transdermique et de la progestérone micronisée. Climacteric 2012 ; 15(Suppl 1) : 11-17.
- Davey DA : HRT : quelques questions cliniques non résolues dans le cancer du sein, le cancer endométrial et l’insuffisance ovarienne précoce. Womens Health (Lond) 2013 ; 9(1) : 59-67.
- Canonico M, et al : Hormone replacement therapy and risk of venous thromboembolism in postmenopausal women : systematic review and meta-analysis. BMJ 2008 ; 336(7655) : 1227-1231.
PRATIQUE DU MÉDECIN DE FAMILLE 2019 ; 14(5) : 9-12