Au cours des dernières années, l’éventail des traitements disponibles pour les patients atteints de maladies inflammatoires chroniques de l’intestin (MICI) s’est considérablement élargi. En se basant sur le fait que les inflammations chroniques et non traitées ont une influence défavorable sur l’évolution de la maladie, on prône aujourd’hui une intervention médicamenteuse précoce et une surveillance intensive afin de prévenir les complications.
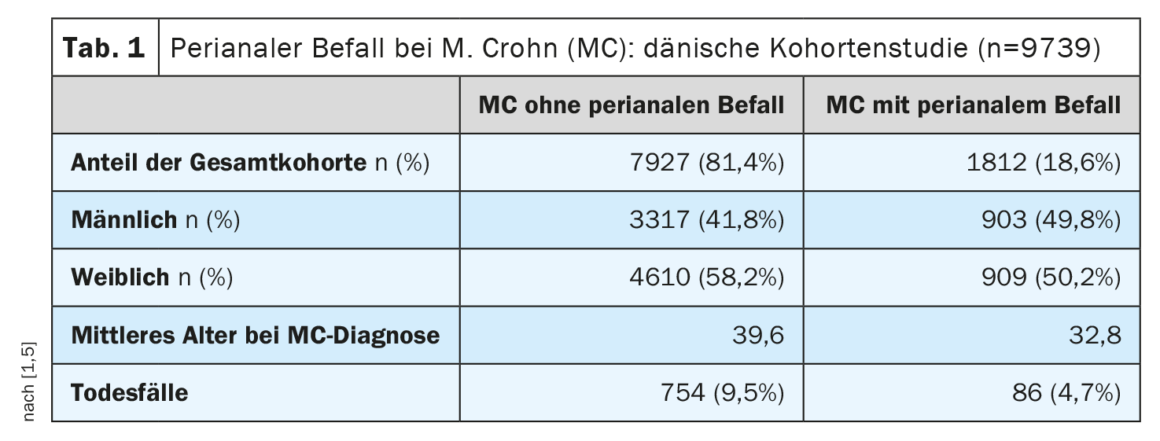
La maladie de Crohn (MC) se caractérise par un tableau hétérogène de différents phénotypes [1]. L’évaluation de l’activité et de la gravité de la MC repose principalement sur des paramètres de laboratoire ainsi que sur des données cliniques et anamnestiques (par ex. fréquence des selles, état de santé, douleurs). Ces paramètres ont été regroupés dans divers scores cliniques, le plus courant étant le Crohn’s Disease Activity Index (CDAI) [2]. Selon la FDA/EMA, la valeur seuil pour un MC modéré à sévère est CDAI ≥220 [3]. Le professeur David T. Rubin, MD, University of Chicago, a souligné que les patients présentant une MC légère mais une affection périanale devraient également être considérés comme modérés à sévères en termes de traitement. Une atteinte périanale est observée chez environ 20% des patients atteints de MC au cours de la maladie [4,5]. C’est ce qui ressort notamment d’une étude de cohorte danoise à grande échelle (tableau 1).
Suivi de l’évolution de la maladie et du traitement
Le traitement vise d’abord à induire une rémission. L’objectif à long terme est de maintenir la rémission. Dans la MC, le contrôle de la maladie est considéré comme une construction multidimensionnelle (encadré). L’éventail des options de traitement médicamenteux s’est considérablement élargi. Après l’introduction des anticorps anti-facteur de nécrose tumorale (TNF) α, le vedolizumab, anticorps α4β7, et l’ustékinumab, anticorps (IL)-12/ IL-23, ont suivi. Selon le professeur Rubin, il est important d’évaluer l’évolution de la maladie et du traitement en tenant compte de la dimension temporelle. Plusieurs analyses post-hoc ont montré que la réponse des patients atteints de MC dont la durée de la maladie est plus courte est meilleure avec un traitement par anticorps anti-TNF-α, ustékinumab et vedolizumab qu’avec une durée de maladie plus longue [1,6,7].
| Décision thérapeutique basée sur des preuves Le choix du traitement repose sur une évaluation du rapport bénéfice/risque, en tenant compte de différents facteurs et de situations de traitement particulières. Pour prendre des décisions thérapeutiques fondées sur des preuves, il est indispensable d’interpréter correctement les données disponibles. Les études randomisées contrôlées sont considérées comme des preuves empiriques solides, puis viennent, avec un degré de preuve décroissant, les études en tête-à-tête, les données post-marketing, les méta-analyses de réseau, les données du monde réel, les rapports de cas et enfin les avis d’experts. |
Par exemple, une méta-analyse publiée en 2020 et portant sur 18 471 patients a montré que l’utilisation précoce de médicaments biologiques (c.-à-d. dans un délai de 2 ans) était associée à une amélioration de la qualité de vie. dans les deux ans suivant le diagnostic) était associée à une probabilité deux à trois fois plus élevée de rémission clinique à 6-12 mois (OR 2,10 [IC à 95% : 1,69-2,60], n=2763, p<0,00001) et à des taux plus élevés de cicatrisation des muqueuses (OR 2,37 [IC à 95% : 1,78-3,16], n=994, p<0,00001) [8].
Vedolizumab et ustékinumab : données d’études récentes
Dans l’étude SEAVUE, l’ustékinumab et l’adalimumab ont été comparés tête-bêche [9]. Il s’agissait d’une étude randomisée, en double aveugle, contrôlée activement, avec un design de groupe parallèle. Au total, 386 patients naïfs de traitement biologique, traités soit par ustékinumab (n=191) soit par adalimumab (n=195), ont fourni des résultats évaluables. Le critère d’évaluation clinique à la semaine 52 n’a pas montré de différence significative entre les deux agents biologiques : les taux de réponse pour l’adalimumab et l’ustékinumab étaient respectivement de 61,0% et 64,9% (p=0,417), la rémission clinique ayant été opérationnalisée comme CDAI <150 à la semaine 52. En revanche, l’ustékinumab a été légèrement mieux toléré.
Dans une analyse secondaire publiée en 2022, l’ustékinumab s’est révélé supérieur au vedolizumab en deuxième ligne (après un traitement anti-TNF). L’analyse était basée sur 5 études (4 rétrospectives et 1 prospective) chez des patients MC en échec de traitement anti-TNF. En phase d’entretien, l’ustékinumab a obtenu de meilleurs résultats que le vedolizumab, et en phase d’induction, les deux anticorps monoclonaux ont eu des effets thérapeutiques similaires [10].
Exploiter les possibilités de traitement
D’autres traitements biologiques font actuellement l’objet d’études d’homologation, parmi lesquels le risankizumab, par exemple. Cet anticorps se lie à la sous-unité p19 de l’interleukine-23 humaine (IL-23) et inhibe ainsi l’interaction avec son récepteur. Dans les études cliniques, le risankizumab s’est avéré efficace en première ligne et chez les patients ayant déjà reçu des traitements biologiques [11]. Une bonne réponse au risankizumab a également été observée, entre autres, chez les patients préalablement traités par ustekinumab. Selon l’orateur, le risankizumab est adapté à une phase précoce du traitement en raison de sa bonne sécurité et de sa bonne tolérance. Selon les données actuelles, il est également judicieux de l’utiliser dans des séquences de traitement ultérieures.
| Contrôle de la maladie en tant que construction multidimensionnelle Les facteurs importants liés au patient pour l’évaluation du contrôle de la maladie sont par exemple l’IMC, le sexe, l’alimentation, la pharmacogénomique, l’adhérence, le tabagisme. Les facteurs liés à la maladie prennent en compte non seulement la gravité et l’activité de la maladie, mais aussi la latence du diagnostic, le phénotype, les facteurs extra-intestinaux et les tentatives de traitement antérieures. Les facteurs liés au traitement concernent les propriétés pharmacocinétiques et pharmacodynamiques de la substance active, ainsi que la voie d’administration et le profil bénéfice/risque global. Parmi les facteurs prédictifs d’une évolution complexe de la MC, au sens de facteurs de risque indépendants au moment du diagnostic (tableau 2) , on a identifié un âge plus jeune, des manifestations périanales et la nécessité d’une stéroïdothérapie précoce. |
| d’après [3] |
En ce qui concerne la séquence du traitement biologique et de l’intervention chirurgicale, les recommandations actuelles préconisent de ne pas arrêter le traitement biologique à long terme, mais de placer la date de l’intervention chirurgicale à la fin de l’intervalle normal d’administration du traitement biologique, à condition que l’activité de la maladie le permette [1].
Dans les petites molécules, le tofacitinib, un inhibiteur de la Janus kinase (JAK), n’est pour l’instant autorisé que pour la colite ulcéreuse. Upadacitinib, également un inhibiteur de JAK, fait actuellement l’objet d’essais cliniques de phase III pour le traitement de la maladie de Crohn [12].
Congrès : European Crohns and Colitis Organisation
Littérature :
- “Diagnostic et traitement de la maladie de Crohn”, Société allemande de gastro-entérologie, de maladies digestives et métaboliques (DGVS), ligne directrice S3 actualisée, août 2021 – numéro de registre AWMF : 021-004.
- Best WR, et al : Développement d’un indice d’activité de la maladie de Crohn. Étude nationale coopérative sur la maladie de Crohn. Gastroenterology 1976 ; 70 : 439-444.
- “Treatment Sequencing in moderate-to-severe CD : Who’s first and who’s last ?”, Prof. Dr. med. David T. Rubin, ECCO, Copenhagen, March 1-4, 2023.
- Eglinton TW, et al : Facteurs de risque cliniques et génétiques pour la maladie de Crohn périanale dans une cohorte basée sur la population. Am J Gastroenterol 2012 ; 107 : 589-596.
- Wewer MD, et al : The Incidence and Disease Course of Perianal Crohn’s Disease : A Danish Nationwide Cohort Study, 1997-2015. J Crohns Colitis 2020 ; 15 : 5-13
- Alric H, et al : L’efficacité de l’ustekinumab ou du vedolizumab chez 239 patients atteints de la maladie de Crohn réfractaire aux anti-tumour necrosis factor. Aliment Pharmacol Ther 2020 ; 51 : 948-957.
- Hamdeh S, et al : Early vs Late Use of Anti-TNFa Therapy in Adult Patients With Crohn Disease : A Systematic Review and Meta-Analysis. Inflamm Bowel Dis 2020 ; 26 : 1808-1818.
- ngaro RC, et al : Systematic review and meta-analysis : efficacy and safety of early biologic treatment in adult and paediatric patients with Crohn’s disease. Aliment Pharmacol Ther 2020 ; 51(9) : 831-842.
- Sands BE, et al. : SEAVUE Study Group. Ustekinumab versus adalimumab pour l’induction et l’entretien du traitement chez les patients biologiquement naïfs atteints de la maladie de Crohn modérément à sévèrement active : un essai multicentrique, randomisé, en double aveugle, en groupes parallèles, phase 3b. Lancet 2022 ; 399(10342) : 2200-2211.
- Parrot L, et al : Systematic review with meta-analysis : the effectiveness of either ustekinumab or vedolizumab in patients with Crohn’s disease refractory to anti-tumour necrosis factor. Aliment Pharmacol Ther 2022 ; 55(4) : 380-388.
- Farrante M, et al : Présenté à l’UEGW. Oct 2022. OP128.
- Chugh R, et al : Multicentre Real-world Experience of Upadacitinib in the Treatment of Crohn’s Disease. J Crohns Colitis 2023 ; 17(4) : 504-512.
- (ACG) Lichtenstein GR, et al : ACG Clinical Guidelines : Management of Crohn’s disease in adults. Am J Gastroenterol 2018 ; 113 : 481-517.
HAUSARZT PRAXIS 2023 ; 18(5) : 37-38 (publié le 25.5.23, ahead of print)