Les questions relatives aux performances cérébrales en raison de plaintes subjectives ou de problèmes cognitifs rapportés par l’entourage sont de plus en plus fréquentes lors des consultations chez les médecins généralistes. Cela est dû à l’évolution démographique. Les démences augmentent avec l’âge : les personnes âgées de 75 à 84 ans présentent un taux de prévalence de 10,9% et les personnes âgées de 85 à 93 ans un taux de prévalence de 30% pour les démences. Les femmes sont plus souvent touchées que les hommes. Environ 5% des diagnostics de démence concernent des patients de moins de 65 ans qui sont potentiellement encore en activité.
Les questions relatives aux performances cérébrales en raison de plaintes subjectives ou de problèmes cognitifs rapportés par l’entourage sont de plus en plus fréquentes lors des consultations chez les médecins généralistes. Cela est dû à l’évolution démographique. Les démences augmentent avec l’âge : les personnes âgées de 75 à 84 ans présentent un taux de prévalence de 10,9% et les personnes âgées de 85 à 93 ans un taux de prévalence de 30% pour les démences. Les femmes sont plus souvent touchées que les hommes. Environ 5% des diagnostics de démence concernent des patients de moins de 65 ans qui sont potentiellement encore en activité [1].
Selon Alzheimer Suisse, il y a actuellement environ 144 300 personnes atteintes de démence en Suisse et on estime qu’il y a environ 30 900 nouveaux cas par an. Les chiffres sont très imprécis, car on estime qu’à peine la moitié des diagnostics de démence ont été correctement posés. Les troubles cérébraux sont souvent mal interprétés et parfois acceptés sans conséquences comme des oublis liés à l’âge.
Les conséquences financières en Suisse ont été estimées à 11,8 milliards de francs en 2020. Ces coûts se composent de coûts directs pour les examens médicaux et les traitements ainsi que de coûts indirects pour la prise en charge des malades. Jusqu’à 60% des personnes atteintes de démence sont soignées par leurs proches, ce qui a un impact important sur leur vie (1 à 3 proches concernés par patient) [2]. Ces proches effectuent généralement des missions non rémunérées et ne sont pas ou peu indemnisés financièrement. Les coûts réels imputables aux démences seraient plusieurs fois plus élevés si ce bénévolat était rémunéré.
Un diagnostic précoce est très important, tant pour les personnes concernées que pour les soignants et les aidants, que ce soit pour organiser leur vie en conséquence, pour pouvoir planifier un traitement optimal ou pour préparer à temps les procurations correspondantes. De plus, dans 2 à 5% des cas, on trouve des causes potentiellement réversibles qui peuvent être traitées, ce qui rend indispensable un diagnostic précoce et approfondi.
Nous présentons ci-dessous le processus d’évaluation recommandé pour les généralistes, basé sur les recommandations de 2018 des Swiss Memory Clinics pour le diagnostic des démences [3].
Définition
Tous les troubles de la mémoire ne sont pas des démences et toutes les démences ne s’accompagnent pas de troubles de la mémoire. On parle souvent à tort de “l’oubli de l’âge” et l’on suppose que vieillir rend oublieux en soi. Différentes études neuropsychologiques ont montré que la réduction de la mémoire à court terme n’est pas un processus de vieillissement physiologique. Avec l’âge, il est possible que certaines fonctions de la mémoire soient limitées, mais cela ne devrait pas affecter le fonctionnement quotidien. Les modifications typiques des performances cérébrales associées à l’âge sont d’une part l’augmentation de l’intelligence cristalline (connaissances factuelles) et d’autre part une diminution de l’intelligence fluide (traitement de l’information comme la précision/vitesse). De même, la “mémoire de travail” diminue, ce qui signifie que moins de nouvelles informations peuvent être stockées par unité de temps. La flexibilité de la pensée diminue également. La mémoire procédurale, c’est-à-dire le souvenir de choses apprises antérieurement, comme faire du vélo ou nouer ses lacets, reste généralement inchangée. L’attention partagée (faire plusieurs choses en même temps, par exemple téléphoner en préparant le déjeuner) diminue avec l’âge. L'”oubli de l’âge” est donc dû soit à un retard de la vitesse de traitement, soit, s’il est plus prononcé, à une maladie (le plus souvent la maladie d’Alzheimer) qu’il convient de diagnostiquer correctement [4].
Tant qu’il n’y a “que” des troubles de la mémoire sans impact sur la vie quotidienne, on parle de troubles cognitifs légers ou de “Mild Cognitive Impairment”, MCI. On estime que jusqu’à 10% des MCI évoluent vers une démence [5].
La définition du diagnostic de “démence” peut se faire d’une part selon la Classification statistique internationale des maladies et des problèmes de santé connexes (CIM, 10e version : CIM-10) : “La démence est un syndrome résultant d’une maladie du cerveau, généralement chronique ou évolutive, avec perturbation de nombreuses fonctions corticales supérieures, y compris la mémoire, le raisonnement, l’orientation, la compréhension, le calcul, l’apprentissage, le langage et le jugement. La conscience n’est pas troublée. Les troubles cognitifs s’accompagnent généralement d’altérations du contrôle émotionnel, du comportement social ou de la motivation, mais il arrive que ces altérations soient plus fréquentes. Ce syndrome est présent dans la maladie d’Alzheimer, dans les troubles cérébrovasculaires et dans d’autres conditions qui affectent le cerveau de manière primaire ou secondaire” (conditions telles que la maladie de Parkinson, l’hydrocéphalie ou la neuroborréliose) [6].
Comme alternative, on utilise principalement dans les pays anglo-saxons une classification selon le DSM-5 (Diagnostic and Statistical Manual, version 5). Dans le but de faciliter la classification étiologique et d’éviter la stigmatisation du terme “démence”, le DSM-5 parle de trouble neurocognitif (en anglais : neurocognitive disorder). Les critères de diagnostic sont énumérés dans l’aperçu 1 . Cette classification autorise différentes combinaisons de la gravité et des causes du trouble neurocognitif [7].

En Suisse, cette catégorisation est déjà utilisée dans les cliniques spécialisées dans la mémoire. Dans les relations quotidiennes avec les patients, mais aussi avec les caisses d’assurance maladie, pour la codification ou les autorités, on continue à parler de “syndrome démentiel”.
Les domaines des fonctions corticales supérieures mentionnées sont présentés dans le tableau 1. plus en détail. Différents domaines sont typiquement affectés par différentes maladies. Ainsi, des tests neuropsychologiques approfondis permettent souvent de limiter les causes de la démence sur la base du profil de déficit cognitif, à condition que la démence ne soit pas trop avancée et que tous les domaines soient touchés. A titre d’exemple, dans le cas de la maladie d’Alzheimer, les troubles de la mémoire sont souvent au premier plan. Dans la démence parkinsonienne, les troubles de la mémoire sont rares au début, mais l’attention et les fonctions exécutives sont rapidement affectées.
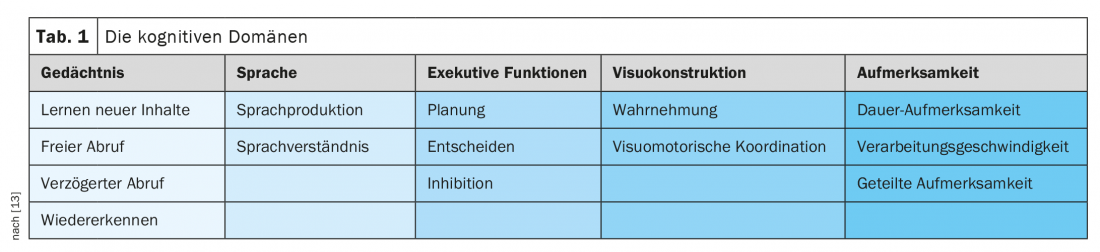
Comme nous l’avons déjà mentionné, les limitations dans la vie quotidienne dues à des pertes cognitives sont obligatoires pour le diagnostic d’un syndrome démentiel. La classification de la sévérité de la démence est basée sur le besoin d’assistance dans les activités de la vie quotidienne (ADL, Activities of Daily Living) et est une évaluation clinique qui peut être étayée par l’importance des déficits neurocognitifs issus d’un test neuropsychologique.
On parle de syndrome démentiel léger en cas de besoin d’assistance ponctuelle dans les activités instrumentales de la vie quotidienne (IADLs comme par exemple la gestion de l’argent, la préparation des repas). Le syndrome démentiel modéré nécessite un soutien dans les activités de base de la vie quotidienne, les BADL, telles que l’hygiène corporelle, les repas, la toilette, etc). Dans le cadre d’un syndrome démentiel sévère, on a besoin d’une aide complète.
Comme mentionné ci-dessus, la prévalence de la démence augmente avec l’âge. Tous les patients devraient-ils alors être examinés, par exemple à partir de 70 ans ?
Qui et comment clarifier ?
Il n’est pas recommandé de dépister l’ensemble de la population âgée pour les problèmes de performance cérébrale. Un examen au cabinet du médecin généraliste devrait être effectué dans l’esprit d’un “case-finding” en cas de signes d’alerte, appelés “red flags” (aperçu 2) [3].

Si auparavant il est recommandé de procéder à un examen somatique et psychologique après une anamnèse détaillée et une anamnèse externe. Il est important de reconnaître l’évolution et l’ampleur des troubles cognitifs (fluctuations, changement continu, impact sur la vie quotidienne). L’anamnèse médicamenteuse, ainsi que les questions sur les troubles du sommeil, l’incontinence, les indices de symptômes de la maladie de Parkinson, la dépressivité et les toxines, sont des informations anamnestiques importantes.
Un test de dépistage peut très bien être réalisé dans la pratique. Qu’il s’agisse du très répandu Mini Mental Status Examination (MMSE de Folstein) combiné au Test de l’Horloge (TU), du Montreal Cognitive Assessment (MoCA) ou du Test de Détection de la Démence (DemTect), cela n’a pas beaucoup d’importance. Le MMSE est peu sensible aux stades précoces, c’est pourquoi il est recommandé de l’associer à l’UT. Il est important de veiller à ce que l’environnement de test soit calme et de compenser autant que possible les difficultés auditives et visuelles des patients avant le test [3]. Le test ne doit pas être effectué chez les patients en hypoglycémie ou en hypotension symptomatique. Si le dépistage cognitif est normal, un nouveau test peut être effectué 6 à 12 mois plus tard. Toutefois, si le test de dépistage est anormal, il est recommandé de procéder à des investigations supplémentaires pour en rechercher la cause.
Poursuite des investigations dans la pratique
En cas d’anomalies lors du dépistage, le médecin généraliste peut procéder à des examens complémentaires. Ainsi, un ECG (en particulier la question des troubles du rythme, des images de bloc, des signes d’ischémie) et un test de laboratoire de base sont recommandés. L’objectif est de détecter les troubles cognitifs d’origine métabolique, infectieuse ou endocrinologique. Les tests de laboratoire de base recommandés sont énumérés dans le tableau 3.

L’urémie ou l’hypercalcémie sont des causes traitables de troubles cognitifs. Un contrôle des fonctions cognitives au cours de l’évolution peut permettre de déterminer si une évaluation plus approfondie de la démence est nécessaire en cas de persistance des troubles.
L’imagerie du neurocrâne fait formellement partie de toute évaluation de la démence, car elle permet également de découvrir des causes traitables, comme un hématome sous-dural ou une hydrocéphalie à pression normale. De plus, la morphologie du cerveau permet de conclure à l’étiologie d’une démence (atrophie focale de la formation hippocampique et du lobe temporal dans la maladie d’Alzheimer ou lésions vasculaires dans la démence vasculaire).
L’étalon-or est l’imagerie par résonance magnétique (IRM), qui permet de rechercher une atrophie focale ou généralisée, des modifications vasculaires, des troubles de la circulation du LCR, des foyers ronds ou, en cas de suspicion, des modifications inflammatoires. Si l’IRM n’est pas réalisable, un scanner, si possible avec produit de contraste, peut être envisagé comme alternative. L’imagerie fonctionnelle n’a sa place qu’à un stade ultérieur, souvent sur demande d’une clinique de la mémoire spécialisée. Par exemple, une TEP-FDG (tomographie par émission de positons au 18F-fluoro-désoxy-glucose) peut permettre de différencier la maladie d’Alzheimer de la démence frontotemporale en cas de sous-occupation focale.
Le diagnostic du liquide céphalorachidien a gagné en importance et peut être utilisé pour différencier la cause d’une démence. La ponction de LCR est indiquée pour exclure les formes de démence non dégénératives primaires, notamment les maladies inflammatoires chroniques du SNC (neuroborréliose, vascularite par exemple). De même, en cas de démence rapidement progressive (suspicion de maladie de Creutzfeld-Jakob) ou comme essai thérapeutique en cas d’hydrocéphalie à pression normale, une ponction de LCR devrait être effectuée de manière standard. La constellation des “marqueurs de démence” que sont la bêta-amyloïde 1-42, la phospho-tau et la tau totale peut donner une indication sur l’étiologie d’une démence d’origine neurodégénérative si la clinique et l’imagerie ne sont pas concluantes. Il est important de suivre les recommandations pré-analytiques de chaque laboratoire [3].
Il est vivement recommandé d’adresser les jeunes patients à une clinique de la mémoire pour un test neuropsychologique approfondi et une évaluation interdisciplinaire. Il est également utile de référer les patients dont la clinique n’est pas claire ou dont la présentation est atypique, par exemple avec des troubles du comportement.
Après une évaluation cognitive, il est essentiel que le diagnostic soit annoncé rapidement aux personnes concernées et à leur famille. Il convient également de fournir des informations sur les offres de soutien. Ainsi, l’association Alzheimer peut conseiller les malades et leurs familles (informations disponibles sur www.alzheimer-schweiz.ch). L’implication de l’entourage est un pilier important de la prise en charge des personnes atteintes de démence.
Prévention
Heureusement, plusieurs mesures efficaces de prévention de la démence ont été démontrées. Il est ainsi possible d’obtenir à la fois une réduction absolue du risque de développer une démence et du risque de progression du MCI vers la démence.
Cette prévention implique, dès la prémorbidité, un bon contrôle de la pression artérielle et des facteurs de risque cardiovasculaire (glycémie, cholestérol) ainsi qu’une activité physique suffisante. Des contacts sociaux stimulants ainsi qu’une bonne formation scolaire ont un effet protecteur. L’étude Finger de 2015 a montré un impact positif de l’activité physique, des mesures diététiques et du contrôle des facteurs de risque cardiovasculaire sur les fonctions cognitives [8]. Des études nutritionnelles telles que celles portant sur le “régime MIND” ont également démontré une réduction du risque [9]. Le régime MIND est l’abréviation de “Mediterranean-DASH Intervention for Neurodegenerative Delay” et est un mélange de régime méditerranéen et de régime DASH. Le régime méditerranéen vise à consommer le moins possible d’aliments transformés, ce qui permet de réduire les acides gras saturés et de privilégier les aliments frais et complets. Le régime DASH se concentre principalement sur l’encouragement des patients à manger des aliments pauvres en sodium afin de réduire leur tension artérielle.
L’apparition de la dépression à un âge avancé est associée à un risque accru de développer une démence. Il n’a pas encore été possible de déterminer si la dépression est l’expression de la démence qui s’installe ou si la démence est un effet de la dépression [10]. Il existe des preuves que le traitement de la dépression peut retarder la progression du MCI vers la démence [11].
Enfin, il est important de souligner que les démences sont fréquentes chez les personnes âgées et qu’elles doivent être diagnostiquées rapidement et correctement. De nombreuses étapes de l’évaluation peuvent être réalisées ou initiées au cabinet du médecin généraliste (anamnèse, tests de dépistage, état somatique et psychique, examens de laboratoire et imagerie cérébrale). Si les résultats ne sont pas concluants ou si une prise en charge/un conseil plus approfondi est nécessaire, il est recommandé de s’adresser à une clinique de la mémoire. Une évaluation interdisciplinaire détaillée y est réalisée selon les normes en vigueur et les malades ainsi que leur entourage peuvent bénéficier de conseils compétents. Une liste des cliniques de la mémoire suisses est disponible sur le site de l’association “swiss memory clinics” [12].
Messages Take-Home
- Une stratégie de case-finding pour le dépistage de la démence est recommandée en cas de signes d’alerte (problèmes de mémoire subjectifs, altérations de la cognition rapportées par l’anamnèse étrangère ou nouveaux problèmes apparus par exemple dans la gestion de la glycémie ou de la tension artérielle, antécédents de délire).
- Les problèmes de cognition, qu’ils soient perçus subjectivement ou rapportés par l’anamnèse d’un tiers, doivent être examinés, car des causes réversibles sont trouvées dans jusqu’à 5% des cas.
- Dans la mesure du possible, il convient de recueillir les antécédents médicaux d’autrui afin de détecter des changements dans les performances cérébrales ou le comportement qui peuvent ne pas être perçus par les personnes concernées.
- Outre l’anamnèse et le statut, le laboratoire de base et l’imagerie cérébrale sont indispensables dans le diagnostic de la démence.
- Il est important d’orienter rapidement les patients vers une clinique de la mémoire pour une évaluation approfondie, en particulier chez les jeunes patients et en cas de présentation atypique ou d’évaluation d’un traitement médicamenteux.
Remerciements
Dr. med. Andreas Zeller, directeur du Centre universitaire de médecine générale des deux Bâle (uniham-bb), pour sa relecture et ses suggestions constructives d’amélioration.
Littérature :
- Office fédéral de la statistique “Coûts de la démence en Suisse”, www.bag.admin.ch/bag/de/home/zahlen-und-statistiken/zahlen-fakten-demenz.html.
- Alzheimer Suisse, www.alzheimer-schweiz.ch/fileadmin/dam/Alzheimer_Schweiz/Dokumente/Publikationen-Produkte/07.01D_2020_Zahlen-Demenz-Schweiz-neu.pdf.
- Bürge M, et al. : Les recommandations des Swiss Memory Clinics pour le diagnostic des démences. Pratique 2018 ; 107(8) : 435-451.
- Harada CN, et al : Vieillissement cognitif normal. Clin Geriatr Med 2013 ; 29(4) : 737-752.
- Campbell NL, et al : Risk Factors for the Progression of Mild Cognitive Impairment to Dementia. Clin Geriatr Med 2013 ; 29(4) : 873-893.
- CIM-10, www.dimdi.de/static/de/klassifikationen/icd/icd-10-gm/kode-suche/htmlgm2020/block-f00-f09.htm ; consulté le 18.04.2021.
- Falkai P, et al. : American Psychiatric Association (APA) : Manuel diagnostique et statistique des troubles mentaux DSM-5 2015.
- Ngandu T, et al : A 2year multidomain intervention of diet, exercise, cognitive training, and vascular risk monitoring versus control to prevent cognitive decline in at-risk elderly people (Finger), a randomized controlled trial. Lancet 2015 ; 385 : 2255-2263.
- Morris MC, et al : MIND diet associated with reduced incidence of Alzheimer’s disease. Alzheimers Dement 2015 ; 11(9) : 1007-1014.
- Singh-Manoux A, et al. : Trajectoires de la dépression avant le diagnostic de démence. JAMA Psychiatry 2017 ; 74(7) : 712-718.
- Dafsari FS, Jessen F : Depression- an underrecognized target for prevention of dementia in Alzheimer’s disease. Translational Psychiatry 2020 ; 10 : 160-173.
- www.swissmemoryclinics.ch
- Oedekoven C, Dodel R : Neurologie up2date 2019 ; 2 (1) : 91-105.
PRATIQUE DU MÉDECIN DE FAMILLE 2022 ; 17(2) : 6-9











