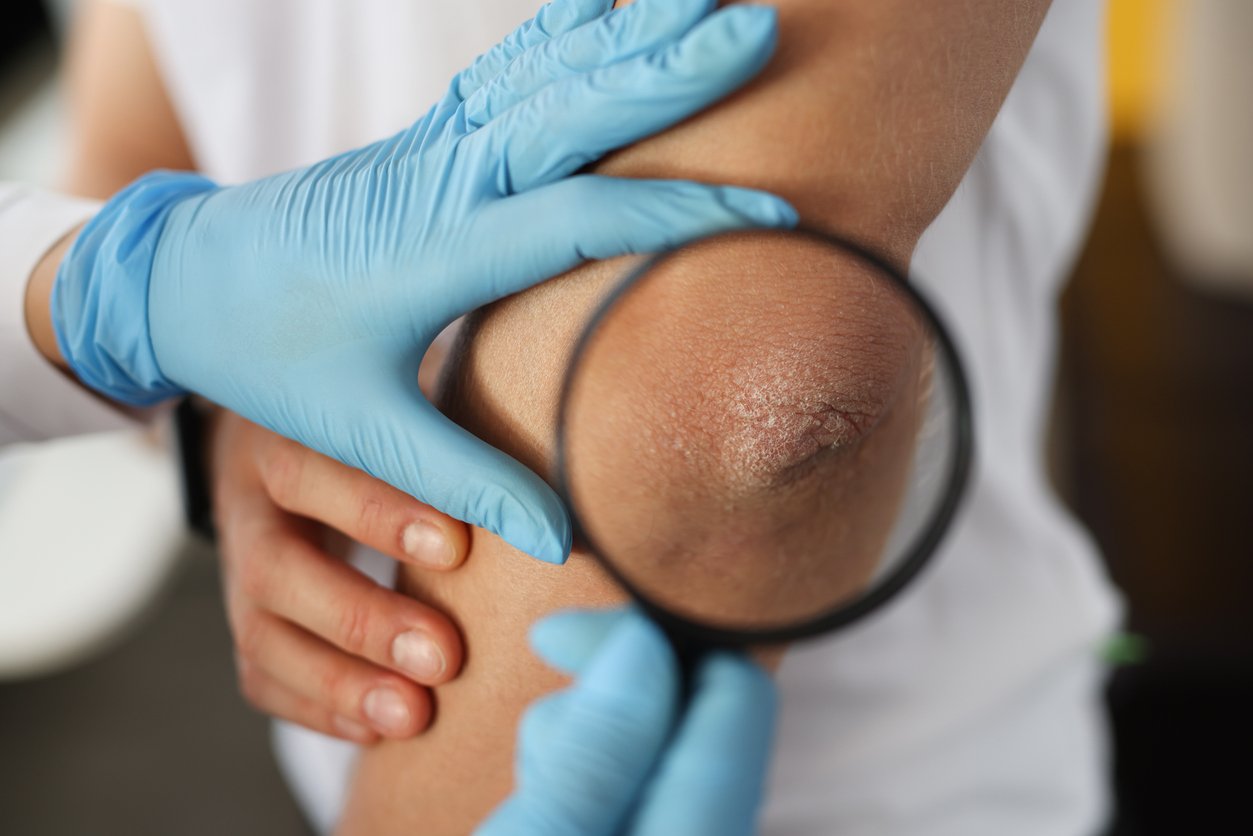
L’arthrite psoriasique (APs), une maladie chronique inflammatoire des articulations, apparaît souvent chez les patients atteints de psoriasis [1]. L’hétérogénéité des symptômes complique le diagnostic. Un diagnostic précoce et un début de traitement rapide sont cependant extrêmement importants. Au cours de ces dernières années, de nombreux nouveaux médicaments ont été autorisés pour le traitement de l’APs. Dans cette CME, le diagnostic, la pharmacothérapie et les recommandations du Groupe de recherche et d’évaluation du psoriasis et de l’arthrite psoriasique (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis, GRAPPA) et de la Ligue européenne contre le rhumatisme (EULAR) seront discutés.
L’arthrite psoriasique (APs) est une maladie chronique inflammatoire de l’appareil locomoteur qui survient chez jusqu’à 30 % des patients atteints de psoriasis [1]. Les manifestations musculosquelettiques et cutanées sont typiques. Dans les premières, on compte l’arthrite périphérique, la spondylarthrite, les dactylites et les enthésites ; les dernières englobent les affections des ongles et les nombreux phénotypes de psoriasis, parmi lesquels le psoriasis vulgaire (comprenant le psoriasis en plaques) est le plus souvent associé à l’APs. De plus, les patients atteints d’APs souffrent souvent de fatigue, de limitation des fonctions physiques, de troubles du sommeil ainsi que d’une réduction de l’aptitude au travail et de la participation sociale [2]. L’APs n’est pas uniquement associée aux manifestations extra-articulaires telles que l’uvéite et les maladies intestinales (MICI), mais elle est également liée à différentes comorbidités telles que l’obésité et les affections métaboliques (diabète, hypertension, hyperlipidémie, stéatose hépatique, affections cardiovasculaires), la dépression, l’anxiété et l’ostéoporose [3, 4]. L’APs est en outre associée à une mortalité plus élevée qui augmente avec la gravité de la maladie [5].
Épidémiologie: Prévalence et incidence
La prévalence de l’APs présente de nettes différences ethniques et géographiques. Elle survient plus souvent dans le nord, plus froid, que sous les tropiques. L’APs concerne presque aussi souvent les hommes que les femmes. Elle apparaît le plus souvent entre la 40e et la 50e année [3]. Selon les études, la prévalence de l’APs chez les hommes d’origine européenne est la plus élevée [6]. Bien que la méthodologie de l’étude et la définition des cas expliquent en partie cette observation, les facteurs génétiques et environnementaux jouent également un rôle important [6]. Un lien entre une série de gènes, dont l’interleukine (IL)-12B et IL-23R a récemment été confirmé. Parmi les facteurs de risque environnementaux associés à l’APs, on trouve les pharyngites à streptocoques, les événements stressants de la vie, un faible taux d’humidité de l’air, la consommation de drogues, l’infection par le VIH, les traumatismes, le tabagisme et l’obésité [6].
Pathogenèse
Les mécanismes à la base de la pathogenèse de l’APs sont complexes et la relation entre la maladie articulaire et d’autres facteurs d’influence potentiels est encore insuffisamment comprise [7].
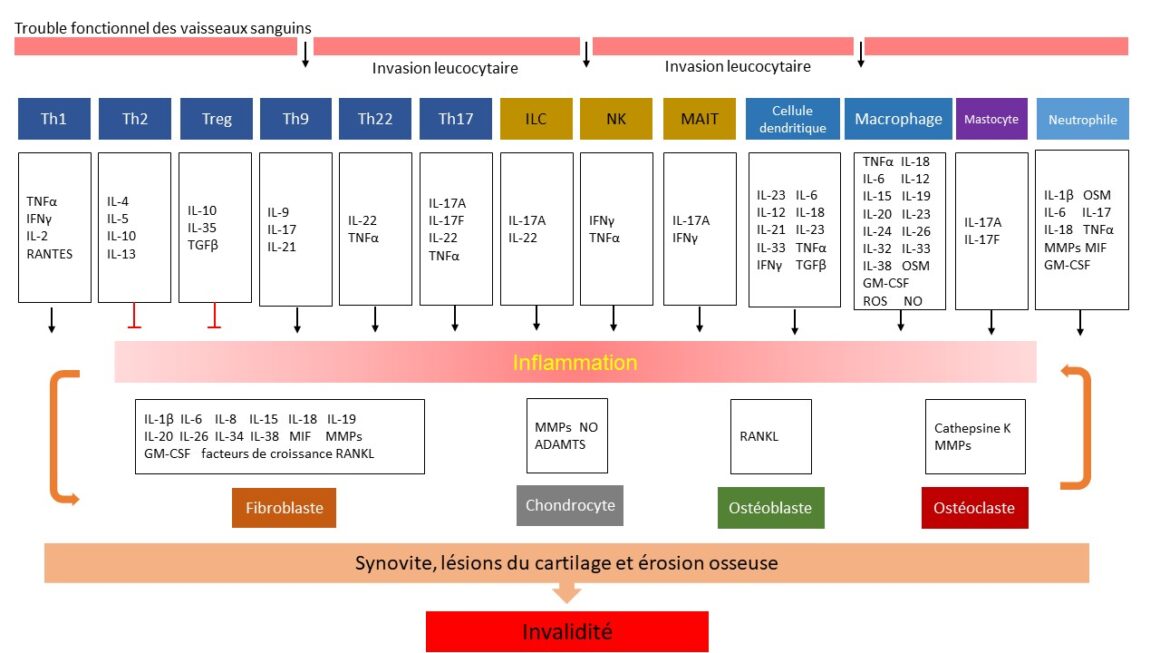
L’un des principaux marqueurs de l’APs est l’inflammation de la membrane synoviale, caractérisée par une augmentation de la vascularisation et l’infiltration de cellules immunitaires [8-10]. Les cellules immunitaires infiltrées libèrent des cytokines pro-inflammatoires qui activent les fibroblastes synoviaux. Ceux-ci produisent des métalloprotéinases qui dégradent le cartilage et activent les ostéoclastes, qui détruisent l’os. L’activation des cellules précurseurs monocytaires pour former des ostéoclastes accélère la résorption osseuse, ce qui entraîne des déformations articulaires et une perte de fonction [11]. L’inflammation synoviale et l’érosion osseuse sont des caractéristiques importantes pour le diagnostic et le traitement, car des modifications radiologiques surviennent chez 47 % des patients dans les deux ans suivant l’apparition de la maladie [12]. La figure 1 montre les cellules les plus importantes impliquées dans la réaction inflammatoire et les cytokines pro-inflammatoires ou anti-inflammatoires qu’elles sécrètent.
Figure 1: Cellules clés et sécrétion des médiateurs importants de l’inflammation en cas d’APs. Adapté de [7]
Diagnostic et diagnostic différentiel [13, 14]
Le diagnostic précoce et un début de traitement rapide sont déterminants pour éviter les lésions articulaires et les déformations, pour réduire les comorbidités et pour améliorer la réponse au traitement. Le diagnostic est généralement établi sur la base de l’anamnèse, de l’examen physique, des résultats de laboratoire et des résultats d’imagerie [14]. Cela est cependant difficile en raison de l’hétérogénéité de la maladie, ce qui entraîne souvent un retard de diagnostic, avec des conséquences importantes [15]: un retard de diagnostic de douze mois est, selon les études, lié à une plus forte limitation des fonctions physiques à dix ans malgré un traitement actif [16]. Même un retard de six mois seulement est associé à une plus forte probabilité de maladie érosive périphérique et à une fonction physique plus dégradée [17]. Au contraire, un diagnostic et un traitement précoces de l’APs entraînent de meilleurs résultats à long terme en ce qui concerne la sévérité de la maladie et les lésions radiographiques [16, 18].
Les difficultés pour établir le diagnostic sont dues au recoupement des symptômes avec plusieurs autres maladies rhumatismales et à l’absence de critères diagnostiques harmonisés ainsi que de biomarqueurs spécifiques [19]. La plupart des patients présentent déjà un psoriasis avant de développer une APs. Chez ces patients, il convient donc de vérifier régulièrement si une maladie inflammatoire de l’appareil locomoteur est présente [20].
Jusqu’aux travaux de Wright [21] et Baker [22], l’arthrite a été décrite en lien avec le psoriasis comme une polyarthrite rhumatoïde (PR). Plus tard, l’APs a été reconnue comme une affection clinique à part entière et classée sous le terme générique de spondylarthrite (SpA) [23]. En 1973, le premier système de classification de l’APs a été élaboré par Moll et Wright [20]. Dans ce système, l’APs est définie comme une arthrite inflammatoire (arthrite périphérique et/ou sacro-iliite ou spondylarthrite) en présence de psoriasis [20]. Les critères se concentrent cependant sur l’arthrite périphérique et non sur d’autres aspects de la maladie musculosquelettique. Au fil des décennies, une série d’autres systèmes de classification ont été élaborés, dont aucun n’a toutefois été utilisé à grande échelle avant l’introduction des critères CASPAR (Classification Criteria for Psoriasis Arthritis) en 2006 [14, 24]. Les règles de diagnostic CASPAR ont été proposées par des experts sur la base d’une étude internationale à laquelle plus de 580 personnes atteintes d’APs et plus de 530 personnes présentant un autre type d’arthrite inflammatoire ont participé [25]. Les critères CASPAR sont largement utilisés depuis 2006 pour la classification de l’APs.
Encadré 1: Critères CASPAR pour l’APs. Adapté de [26]
MALADIE INFLAMMATOIRE DES ARTICULATIONS, DE LA COLONNE VERTÉBRALE OU DES ENTHÈSES ET EN PLUS, ≥ 3 POINTS (P) DES CRITÈRES CI-APRÈS:
- PRÉSENCE ACTUELLE DE PSORIASIS (2P) OU ANTÉCÉDENTS DE PSORIASIS (1P) OU PRÉSENCE DE PSORIASIS CHEZ UN PARENT AU 1er OU 2e DEGRÉ (1P)
- DYSTROPHIE UNGÉALE PSORIASIQUE (1P)
- FACTEUR RHUMATOLOGIQUE NÉGATIF (1P)
- DACTYLITE OU ANTÉCÉDENTS DE DACTYLITE DOCUMENTÉE PAR UN MÉDECIN (1P)
- NÉOFORMATION OSSEUSE JUXTA-ARTICULAIRE EN RADIOGRAPHIE CONVENTIONNELLE (1P)
Manifestations musculosquelettiques dans le diagnostic de l’APs
Lors du diagnostic, les protéines de phase active comme la CRP (protéine C réactive) et la VS (vitesse de sédimentation) sont souvent dans la norme en dépit de l’activité de la maladie [27]. Le diagnostic d’APs repose sur la mise en évidence d’une maladie inflammatoire caractéristique de l’appareil locomoteur associée au psoriasis (psoriasis actuel ou antécédents personnels ou familiaux). Au sein de l’appareil locomoteur, on distingue quatre zones concernées: l’arthrite périphérique, l’enthésite, la dactylite et l’arthrite axiale: [19]
- L’arthrite périphérique, ou plutôt l’atteinte inflammatoire des structures articulaires périphériques avec synovite, est la manifestation la plus fréquente de l’APs installée. Au début, elle est généralement asymétrique et oligo-articulaire, au cours de l’évolution, elle peut devenir polyarticulaire et symétrique et ressembler à la polyarthrite rhumatoïde (PR) [28].
- L’enthésite (inflammation des insertions des tendons, des ligaments et des fibres de la capsule articulaire sur l’os) est l’une des caractéristiques de la SpA, y compris l’APs [19]. Cependant, les maladies enthésiques sont également fréquentes chez les patients présentant un syndrome métabolique, une ostéoarthrite et chez d’autres personnes par ailleurs en bonne santé [29].
- Environ la moitié des patients atteints d’APs souffrent de dactylite au cours de l’évolution de la maladie. Elle est définie par un gonflement régulier de l’ensemble du doigt ou de l’orteil à la suite d’une inflammation de l’articulation, des parties molles et des tendons [30]. La dactylite est à la fois corrélée à l’activité de la maladie et à sa progression chez les patients atteints d’APs [31].
- Il n’existe pas encore de définition généralement valable de l’APs axiale, la plupart des nouvelles études recommandent cependant d’appliquer les critères de New York modifiés pour la spondylarthrite ankylosante [32]. On estime que seulement 2 à 5 % des patients atteints d’APs ont une maladie axiale isolée, alors que 25 à 70 % des patients ayant une APs depuis de nombreuses années présentent une maladie axiale [33]. Le premier pas vers le diagnostic de la maladie axiale consiste à distinguer les symptômes de l’inflammation des douleurs dorsales et cervicales non spécifiques. L’Assessment of Spondyloarthritis International Society (ASAS) a élaboré des critères pour les lombalgies inflammatoires (LI) [34]. Le diagnostic différentiel de l’arthrite axiale inclut souvent l’hyperostose squelettique idiopathique diffuse (HSID). L’HSID est diagnostiquée chez environ 10 % des plus de 50 ans et se caractérise par des calcifications et des ossifications articulaires touchant principalement la colonne vertébrale et les zones enthésogènes périphériques [35].
Biomarqueurs
Contrairement à de nombreuses autres maladies rhumatismales telles que la PR, il n’existe aucun auto-anticorps sérique validé pour l’APs, ni aucun autre biomarqueur qui pourrait faciliter le dépistage et le diagnostic précoce [19]. Les biomarqueurs génomiques, en particulier les variations au sein du complexe majeur d’histocompatibilité (CMH), se sont révélés utiles pour distinguer le psoriasis de l’APs. Okada et al. ont démontré que l’hétérogénéité entre l’APs et le psoriasis cutané (PsC) dépend de la position 45 de l’acide aminé HLA-B. Le phénotype du psoriasis est associé à deux modèles dans le gène CMH. Alors que le HLA-C*06 conduit à un phénotype à prédominance cutanée, il a été constaté que le HLA-B*27 est associé au développement précoce de l’arthrite chez les patients atteints de psoriasis [36].
Imagerie
Dans les études cliniques, des modifications radiologiques typiques de l’APs ont été observées et ont alors été intégrées dans les critères de classification. Ces modifications radiologiques apparaissent plus souvent lorsque la durée de la maladie augmente. Au stade précoce de la maladie, les radiographie semblent toutefois souvent normales car les os ne sont pas encore endommagés [14]. Dans une étude sur des patients atteints d’arthrite périphérique, il a été constaté qu’environ 27 % des patients présentaient déjà des érosions lors de la première présentation [37]. L’étendue des érosions observées était cependant faible et ne touchait que peu d’articulations chez la plupart des patients examinés. Sur les radiographies, l’APs se caractérise par des érosions articulaires, un rétrécissement de l’espace articulaire, des excroissances osseuses, une ostéolyse, une acro-ostéolyse, une ankylose, la formation d’éperons et une spondylarthrite [25, 38]. L’échographie est particulièrement adaptée au diagnostic précoce de l’APs, car elle permet de détecter des inflammations articulaires subcliniques chez des patients psoriasiques encore asymptomatiques [39]. L’échographie permet de visualiser les changements des enthèses, des ligaments et de la synovie dès les premiers stades de l’APs. Ainsi, des anomalies des enthèses étaient présentes chez 33 % des patients cliniquement asymptomatiques ayant eu une échographie [40].
Questionnaires de dépistage
Pour le dépistage et le diagnostic précoce de l’APs, plusieurs questionnaires de dépistage validés sont disponibles: Le questionnaire GEPARD (German Psoriasis Arthritis Diagnostic Questionnaire) [41] a une sensibilité de 88,64 % et une spécificité de 89,74 % [42]. Le questionnaire ToPAS (Toronto PsA Screening Questionnaire) [43] a été élaboré pour être utilisé dans la population générale et peut également être utilisé par le généraliste pour contrôle [44]. La sensibilité de cet instrument de dépistage est de 94 % et sa spécificité de 92 %. En revanche, le questionnaire PASE (Psoriatic Arthritis Screening and Evaluation Questionnaire) a été spécialement conçu pour les patients atteints de psoriasis [45] et convient également pour le suivi de l’évolution de la maladie [44]. La sensibilité et la spécificité du diagnostic sont estimées à 76 % chacune [46]. Le questionnaire PEST (Psoriasis Epidemiology Screening Tool) est également exclusivement prévu pour le dépistage chez les patients atteints de psoriasis. Il contient en outre une représentation graphique permettant de noter les articulations touchées. La sensibilité est estimée à 97 % et la spécificité à 79 % [47].
Sévérité
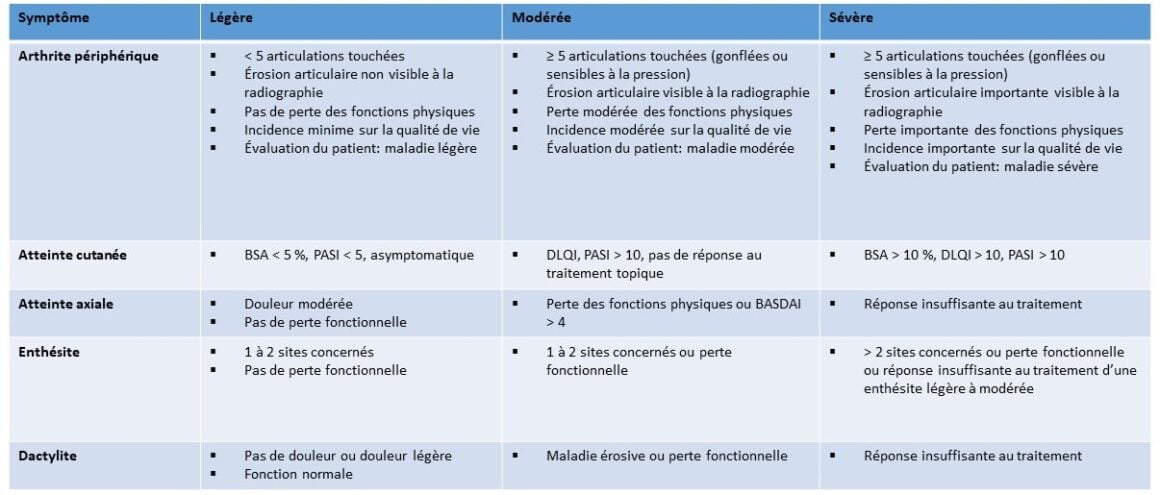
Afin d’obtenir une image de la sévérité de l’APs et de l’évolution sous traitement, des unités de mesures dérivées de la PR ou du psoriasis ont été traditionnellement utilisées. Celles-ci se rapportent d’une part aux articulations, selon les critères de l’American College of Rheumatology (ACR) et les critères du score d’activité de la maladie (DAS) ou d’autre part, à la peau, comme l’indice de sévérité et d’étendue du psoriasis (PASI) [48]. Pour la PR, la gestion du traitement par la mesure de l’activité de la maladie à l’aide du score d’activité de la maladie sur 28 articulations (DAS28, Disease Activity Score) a permis d’améliorer les soins et les résultats à long terme [49]. Bien que plusieurs échelles de mesure de l’activité de la maladie aient été développées, aucun consensus n’a encore été atteint quant à celle à utiliser [50]. Afin de prendre en compte toutes les zones cliniques de l’APs, y compris la peau, dans une seule mesure, le GRAPPA a développé 3 nouvelles variables composites spécifiques à l’APs: l’indice «Composite Psoriasis Disease Activity Index» (CPDAI), le score «Psoriatic Arthritis Disease Activity Score» (PASDAS), et la moyenne «Arithmetic Mean of Desirability Functions» (AMDF). Celles-ci doivent cependant encore être validées dans des études cliniques [51, 52]. Les recommandations du GRAPPA proposent une classification des stades de la maladie en légère, modérée et sévère [53] (voir tableau 1).
Tableau 1: Classification des degrés de gravité de l’APs modifiée selon le GRAPPA [53]
Pharmacothérapie
Avant l’an 2000, les options de traitement pharmacologique de l’APs se limitaient essentiellement aux anti-inflammatoires non stéroïdiens (AINS), aux glucocorticoïdes, aux médicaments antirhumatismaux de synthèse modificateurs de la maladie conventionnels (csDMARD) tels que le méthotrexate (MTX) et la sulfasalazine, ainsi que la ciclosporine Depuis, le traitement de l’APs a été révolutionné par de nombreux développements [14]. Aux côtés des nombreux csDMARD, différents DMARD biologiques (bDMARD) comme les inhibiteurs du TNF, de l’interleukine (IL)-17 et de l’IL-23 sont disponibles. Ceux-ci sont complétés par des DMARD synthétiques ciblés (tsDMARD) qui inhibent la phosphodiestérase (PDE)4 ou les Janus kinases (JAK).
En l’absence de directives nationales, le traitement de l’APs s’appuie sur les recommandations des associations de spécialistes GRAPPA et EULAR. Les deux ont été révisées récemment.
Les recommandations du GRAPPA sont basées sur une approche couvrant les six zones cliniques de l’APs (arthrite périphérique, APs axiale, enthésite, dactylite, psoriasis et atteinte unguéale) ainsi que les comorbidités associées (MICI, uvéite). En revanche, les recommandations de l’EULAR sont basées sur quatre domaines cliniques (polyarthrite, mono/oligo-arthrite, enthésite et manifestation axiale prédominante de l’APs) et sur une organisation en quatre phases. Dans les paragraphes suivants, les principes de traitement et les recommandations thérapeutiques des deux associations de spécialistes seront abordés.
Recommandations du GRAPPA [54]
Les recommandations de traitement émises par le GRAPPA, actualisées en 2021, s’appuient sur six principes généraux pour la prise de décision commune. De plus, les recommandations pour les maladies modérées à sévères ont été révisées: Dans les nouvelles recommandations, les agents biologiques, les thérapies ciblées ou les deux sont recommandés en première ligne en cas de maladie modérée à sévère pour les six zones de l’APs. Parmi les agents biologiques et les thérapies ciblées, seuls les inhibiteurs du TNF et de l’IL-17 ont été qualifiés de préférables pour chacune des six zones. Les inhibiteurs de l’IL-12/23 ou de l’IL-23, qui ont été ajoutés aux options thérapeutiques en cas d’APs depuis 2016, ne sont pas recommandés dans les nouvelles recommandations de traitement du GRAPPA pour une utilisation contre la composante axiale de l’APs. Cette distinction est importante non seulement pour les patients présentant des symptômes axiaux prononcés, mais aussi pour le principe de sélection des traitements du GRAPPA, qui appelle à privilégier les thérapies couvrant le plus de zones possibles [54]. La figure 2 présente un aperçu graphique des recommandations de traitement.
Figure 2: Recommandations basées sur les données probantes adaptées de [54]
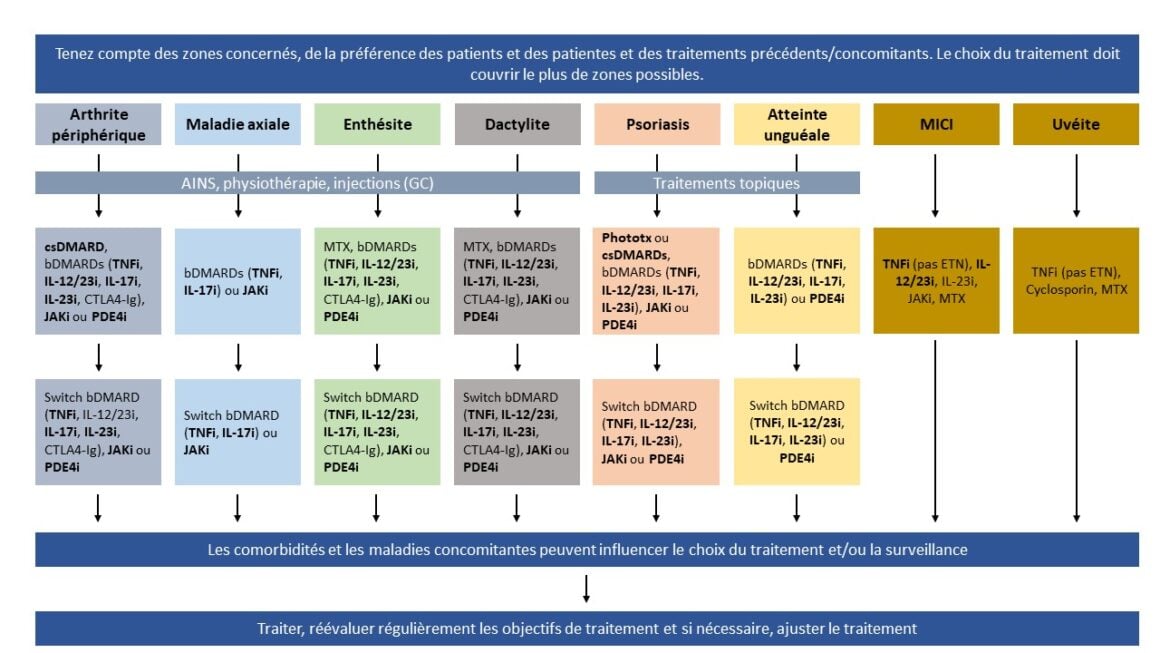
Bien que les recommandations du GRAPPA suivent une approche en fonction des zones, la majorité des patients présentent une maladie dans plusieurs zones. C’est pourquoi les recommandations pour chaque zone ont été regroupées en un seul schéma de traitement, afin de faciliter les décisions thérapeutiques (voir figure 2) [54].
Le schéma souligne qu’au début du traitement, l’activité de la maladie dans chacune des zones doit être évaluée et que les maladies concomitantes, les traitements antérieurs et les préférences du patient doivent être pris en compte. Compte tenu de la portée internationale de ces recommandations et des preuves limitées concernant la stratégie de traitement, l’ordre de traitement requiert de la flexibilité et dépend des conditions du système de santé, y compris le statut d’enregistrement des substances mentionnées [54].
Le schéma comprend de ce fait des approches progressives standard, en commençant par des traitements topiques pour le psoriasis et des csDMARD pour l’arthrite, ainsi que des voies de traitement accélérées dans lesquelles les bDMARD ou les tsDMARD peuvent être utilisés comme traitement de première ligne. Il est important de noter que ce schéma exige un processus itératif avec une réévaluation régulière de l’efficacité et de la tolérance et, si nécessaire, une adaptation du traitement.
Lorsque c’est possible, il convient de choisir le traitement de sorte que toutes les zones actives de l’APs et les affections associées soient traitées. Il est judicieux de cibler le traitement sur l’aspect le plus grave ou le plus lourd de conséquences de la maladie, surtout s’il existe des différences en termes d’efficacité. Des indications complémentaires en fonction des différentes zones sont données ci-après [54].
Arthrite périphérique
Les AINS ainsi que les glucocorticoïdes intra-articulaires ou oraux ne sont recommandés pour le soulagement de l’arthrite périphérique que dans certaines conditions. Il existe encore peu de preuves de l’efficacité des csDMARD dans le traitement de l’arthrite périphérique chez les patients naïfs de traitement. Cependant, l’utilisation des csDMARD MTX, sulfasalazine ou léflunomide est fortement recommandée sur la base de données d’observation [55-58] et de la disponibilité générale [55-58]. Dans de nombreux cas, les csDMARD sont utilisés en première ligne, la réponse clinique doit alors être vérifiée régulièrement (toutes les 12 à 24 semaines) et une optimisation précoce du traitement est recommandée (entre 12 et 24 semaines) [54].
De nouvelles données d’une grande valeur qualitative confirment la supériorité des inhibiteurs du TNF par rapport aux csDMARD en traitement de première ligne, en particulier chez les patients présentant une maladie précoce [55-57].
Chez les patients ayant une réponse insuffisante aux csDMARD, des preuves de grande qualité attestent l’efficacité des inhibiteurs du TNF, de l’IL-17, de l’IL-23 et de JAK. Il n’existe toutefois actuellement que peu d’études cliniques randomisées (ECR) réalisant une comparaison directe entre les inhibiteurs de phosphodiestérase-4 (PDE4i), les inhibiteurs du TNF, de l’IL-17, de l’IL-12/23, de l’IL-23 et de JAK [54]. Par conséquent, nous ne savons toujours pas si l’efficacité des différents bDMARD est équivalente.
Maladie axiale
Chez les patients présentant des symptômes axiaux qui ne répondent pas aux traitements par AINS, physiothérapie et/ou injections de glucocorticoïdes dans l’articulation sacro-iliaque (si appropriées), une thérapie ciblée est fortement recommandée. Les inhibiteurs du TNF et de l’IL-17 se sont avérés efficaces en cas de SpA axiale radiographique comme non radiographique [54].
Enthésite
Les nouvelles thérapies ayant apporté la preuve de leur efficacité et qui sont donc recommandées comme options de traitement de l’enthésite active chez les patients atteints d’APs comprennent les inhibiteurs du TNF, de l’IL-17, de l’IL-12/23, de l’IL-23, des JAK et de la PDE4, bien qu’aucun d’entre eux ne soit systématiquement supérieur aux autres [54].
Dactylite
Sur la base des preuves disponibles, le GRAPPA a exprimé une recommandation conditionnelle en faveur de l’utilisation du MTX et contre l’utilisation d’autres csDMARD dans le traitement de la dactylite. De même, l’utilisation d’AINS, d’injections locales de glucocorticoïdes ainsi que du CTLA4-Ig a été fortement recommandée. Le GRAPPA recommande fortement les inhibiteurs du TNF, de l’IL-12/23, de l’IL-23, de l’IL-17, de JAK et de la PDE4 pour le traitement de la dactylite dans le cadre de l’APs [54].
Peau
En cas d’étendue limitée de l’atteinte de la peau, les médicaments topiques sont fortement recommandés en premier traitement. En cas de psoriasis étendu, ou de psoriasis ne répondant pas aux médicaments topiques, la photothérapie, les traitements oraux (MTX, cyclosporine, inhibiteurs de la PDE4 et de JAK) et les bDMARD (Inhibiteurs du TNF, de l’IL-17, de l’IL-12/23 et de l’IL-23) sont recommandés. La photothérapie est efficace en cas de psoriasis sur le tronc et les extrémités. L’acitrétine, un rétinoïde oral, est recommandée sous réserves en cas de arthrite psoriasique, car son efficacité en monothérapie est limitée pour le psoriasis en plaques et les données disponibles chez les patients atteints de psoriasis sont rares [54].
Les inhibiteurs du TNF, de l’IL-17, de l’IL-12/23 et de l’IL-23 sont fortement recommandés, sachant que dans les études cliniques, les inhibiteurs de l’IL-17, de l’IL-12/23 et de l’IL-23 ont montré une efficacité plus élevée chez les patients atteints de psoriasis et/ou d’APs que les inhibiteurs du TNF. Il convient de choisir le médicament à l’aide des résultats d’étude sur les populations atteintes de psoriasis, des éventuelles comorbidités et de l’activité de la maladie dans les autres zones touchées par l’APs [54].
Il faut noter que les preuves de l’efficacité du léflunomide et de la sulfasalazine sont limités pour les maladies de peau et que leur efficacité a été considérée comme limité contre le psoriasis par rapport aux autres traitement disponibles. Pour le CTLA4-Ig il n’existe également que des preuves limitées concernant son efficacité en cas de maladie de peau [54].
Ongles
Sur la base de données probantes issues d’ECR, une forte recommandation a été émise en faveur des bDMARD. Des recommandations conditionnelles ont été émises pour les thérapies topiques et systémiques suivantes: Préparations à base de calcipotriol et de glucocorticoïdes, tacrolimus topique, ciclosporine topique, glucocorticoïdes intra-lésionnels et laser à colorant pulsé. Les médicaments systémiques qui peuvent être pris en compte sont la cyclosporine, le MTX, l’acitrétine, les inhibiteurs de JAK et de la PDE4 [54].
Maladies concomitantes
Il existe deux sous-types de maladies concomitantes appartenant aux MICI (Maladie de Crohn et colite ulcéreuse) ainsi que l’uvéite antérieure non infectieuse. Plusieurs ECR de haute qualité ont montré l’efficacité des inhibiteurs du TNF (à l’exception de la protéine de fusion des récepteurs étanercept) et des inhibiteurs de l’IL- 12/23 pour la maladie de Crohn et la colite ulcéreuse. L’inhibiteur de JAK tofacitinib s’est avéré efficace en cas de colite ulcéreuse. Les inhibiteurs de JAK upadacitinib et filgotinib ainsi que les inhibiteurs de l’IL-23 ont donné des résultats préliminaires prometteurs pour la maladie de Crohn et sont actuellement évalués dans le cadre d’études de phase III [54].
Quelques ECR ont montré l’efficacité du MTX dans la maladie de Crohn de la colite ulcéreuse. Dans certains ECR, les inhibiteurs de l’IL-17 (sécukinumab et brodalumab) ont aggravé l’état des patients dont la maladie de Crohn était connue et devraient donc être évités [59].
Le MTX est actuellement un traitement de l’uvéite souvent prescrit et il est recommandé avec réserves. Les inhibiteurs du TNF (sauf l’étanercept) sont également recommandés avec réserves pour le traitement de l’uvéite. Deux ECR de phase III ont apporté la preuve de l’efficacité de l’adalimumab, inhibiteur du TNF, dans le traitement de l’uvéite. Des ECR plus récents ont également apporté des preuves solides concernant l’utilisation de l’adalimumab, cependant dans les formes d’uvéite qui ne sont généralement pas associées à la SpA [59]. L’utilisation de l’inhibiteur du TNF étanercept est fortement déconseillée en raison de sa faible efficacité et du risque d’aggravation de l’uvéite par rapport aux anticorps monoclonaux. Le tableau 2 résume les recommandations de traitement de l’APs [54].
Tableau 2: Résumé des recommandations pour le traitement de l’APs. Adapté de [54]
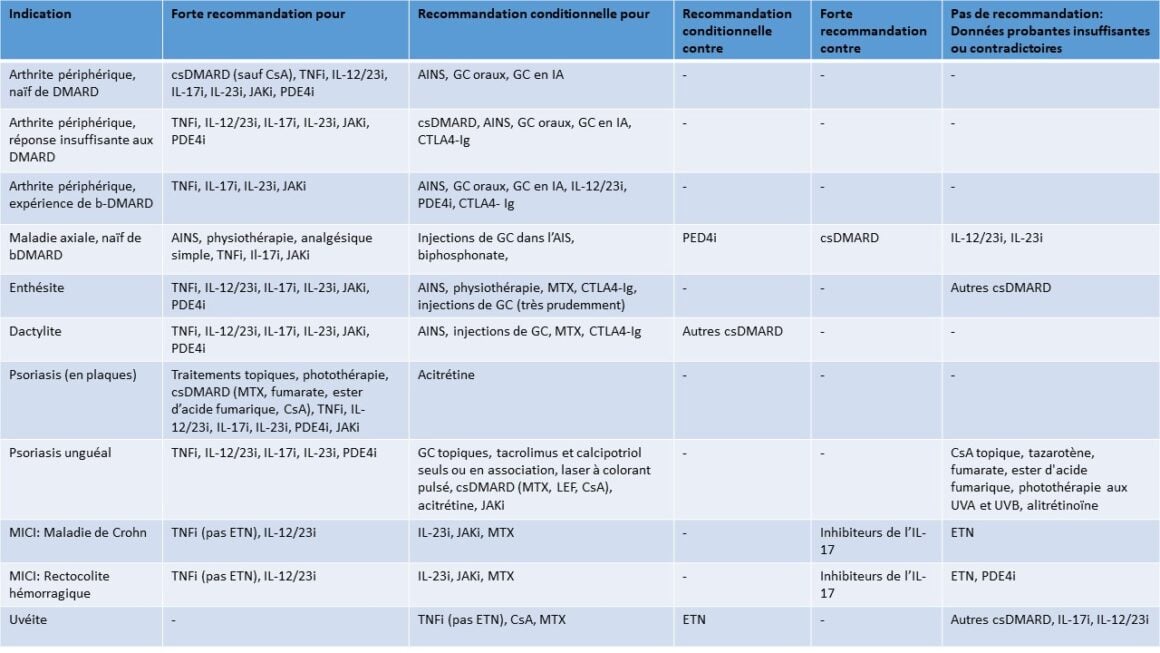
Comorbidités
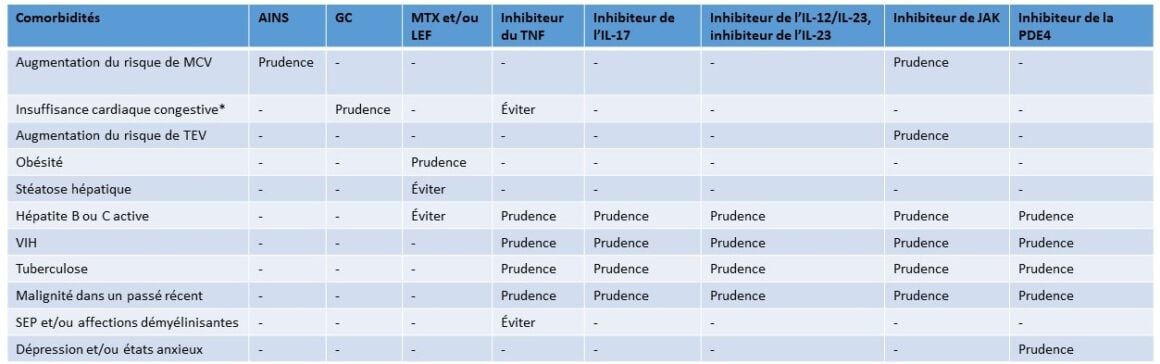
Le psoriasis et l’APs sont tous deux accompagnés de nombreuses maladies chroniques qui peuvent influencer le traitement, la réponse au traitement, la qualité de vie et la mortalité. Les comorbidités importantes pour l’APs sont les maladies cardiovasculaires, l’obésité, le syndrome métabolique, les maladies hépatiques (en particulier la stéatose hépatique), troubles de l’humeur, y compris dépression et états anxieux, infections chroniques (hépatite B, hépatite C, VIH, tuberculose et infections fongiques), affections cancéreuses (par ex., cancer de la peau et lymphome), ostéoporose et fibromyalgie et/ou sensibilisation centrale [14].
Les recommandations concernant ces comorbidités importantes sont présentées dans le tableau 3 [54].
Tableau 3: Résumé des recommandations pour le traitement de l’APs en cas de comorbidités. Adapté de [54]
Recommandations EULAR 2019 pour le traitement de l’APs avec des traitements pharmacologiques [60]
Les recommandations EULAR 2019, faisant actuellement l’objet d’une nouvelle révision, contiennent six principes généraux pour le traitement de l’APs, tels que la prise en compte des manifestations musculosquelettiques et non-musculosquelettiques dans le choix du traitement, la nécessité d’une prise en charge multidisciplinaire des patients et d’une prise de décision partagée. Elles contiennent en outre douze recommandations qui indiquent des stratégies thérapeutiques médicamenteuses concrètes. L’importance des manifestations musculosquelettiques de l’APs est désormais soulignée et il est fait référence aux atteintes d’organes associées à l’APs [60].
L’EULAR souligne qu’un traitement optimal des patients atteints de psoriasis nécessite également des stratégies non pharmacologiques, telles que l’éducation des patients et la pratique régulière d’une activité physique, et que des médicaments topiques peuvent également être nécessaires (en particulier en cas d’atteinte cutanée) [60].
Recommandations [60]
- Le traitement doit viser l’obtention d’une rémission ou d’une faible activité de la maladie, en évaluant régulièrement l’activité de la maladie et en adaptant le traitement en conséquence.
- Les AINS peuvent être utilisés pour soulager les symptômes musculosquelettiques.
- Les injections locales de glucocorticoïdes doivent être considérées comme un traitement complémentaire en cas d’APs; les glucocorticoïdes systémiques peuvent être appliqués avec précaution à la dose efficace la plus faible.
- Chez les patients atteints de polyarthrite, il convient d’instaurer rapidement un traitement par csDMARD, dans ce cas, le MTX devra être privilégié chez les patients ayant une atteinte cutanée significative.
- Chez les patients atteints de mono-arthrite ou d’oligo-arthrite, en particulier en présence de facteurs pronostiques défavorables tels que la présence de lésions structurelles, de VS et de CRP élevées, de dactylite ou d’atteinte unguéale, un csDMARD doit être envisagé.
- Chez les patients présentant une arthrite périphérique et une réponse insuffisante à au moins un csDMARD, il convient de débuter un traitement par bDMARD; si l’atteinte cutanée est significative, un inhibiteur de l’IL-17 ou de l’IL-12/23 doit être privilégié.
- Chez les patients présentant une arthrite périphérique et une réponse insuffisante à au moins un csDMARD et au moins un bDMARD, ou si le bDMARD n’est pas adapté, un inhibiteur de JAK peut être envisagé.
- Chez les patients présentant une maladie légère et une réponse insuffisante à au moins un csDMARD, si un bDMARD et un inhibiteur de JAK ne sont pas adaptés, un inhibiteur de la PDE4 peut être envisagé.
- Chez les patients présentant une enthésite nette et une réponse insuffisante aux anti-inflammatoires non-stéroïdiens (AINS) ou aux injections locales de glucocorticoïdes, il convient d’envisager un traitement avec un bDMARD.
- Chez les patients présentant une maladie active principalement axiale et qui ne répondent que de manière insuffisante aux AINS, il convient d’envisager un traitement par un bDMARD, en l’état actuel de la pratique, il s’agira d’un inhibiteur du TNF. En cas d’atteinte cutanée importante, un inhibiteur de l’IL-17 peut être préféré.
- Chez les patients qui ne répondent pas suffisamment à un bDMARD ou qui ne le tolèrent pas, il convient d’envisager le passage à un autre bDMARD ou à un tsDMARD, y compris un passage dans la même classe.
- Chez les patients en rémission durable, un arrêt prudent des DMARD peut être envisagé.
Traitement médicamenteux selon les recommandations EULAR actuelles [60]
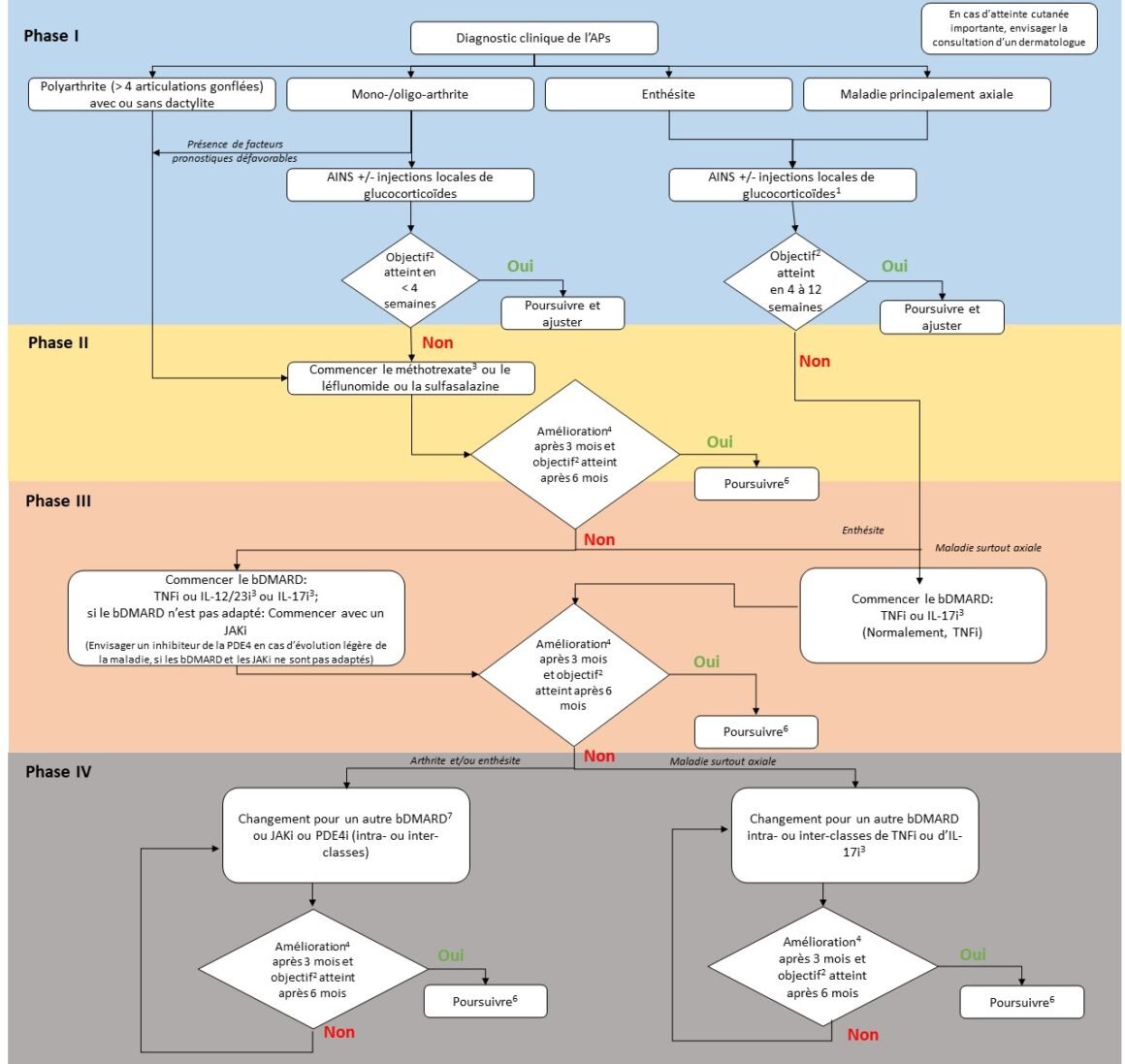
Pour chaque manifestation de l’APs, il convient, selon EULAR, d’utiliser différents instruments d’évaluation. De plus, il convient de tenir compte des contre-indications et des risques de chaque médicament. L’algorithme de traitement recommandé par EULAR est présenté en figure 3 [60].
En traitement initial, les AINS et les injections locales de glucocorticoïdes sont proposés. Chez les patients atteints d’arthrite et présentant des facteurs de risque défavorables tels qu’une polyarthrite ou une mono-/oligo-arthrite associée à une dactylite ou à des lésions articulaires, l’instauration rapide d’un csDMARD est recommandée [60].
Si l’objectif de traitement n’est pas atteint avec cette stratégie, il est possible, en tenant compte d’une éventuelle atteinte cutanée, de passer à un bDMARD dirigé contre le TNF, l’IL-17A ou l’IL-12/23. En cas de maladie axiale dominante, il convient de prescrire un inhibiteur du TNF ou de l’IL-17A en traitement de première ligne. L’utilisation d’inhibiteurs de JAK est recommandée en première ligne, après échec d’un bDMARD. Les inhibiteurs de la PDE-4 sont proposés aux patients chez lesquels d’autres médicaments ne sont pas adaptés, en règle générale, en cas de maladie légère [60].
Recommandations basées sur des données probantes
Figure 3: Algorithme thérapeutique EULAR Adapté de [60]
Conclusion
L’arthrite psoriasique (APs) est une maladie inflammatoire chronique de l’appareil locomoteur accompagnée de psoriasis et associée à différentes manifestations (arthrite périphérique, spondylarthrite, enthésite, dactylite, atteinte de la peau et des ongles) et à diverses comorbidités. Le diagnostic repose sur la détection d’une maladie inflammatoire caractéristique de l’appareil locomoteur associée au psoriasis. L’hétérogénéité de la maladie complique le diagnostic. Un diagnostic précoce et un début rapide du traitement sont très importants pour éviter des lésions articulaires irréversibles et préserver les capacités fonctionnelles sur le long terme. Il convient, dans la mesure du possible, de réduire l’inflammation afin de pouvoir atteindre une rémission. Pour cela, une surveillance étroite de l’activité de la maladie est indiquée ainsi qu’un ajustement du traitement aux symptômes et au degré d’activité.
Le traitement de l’APs s’oriente en fonction des recommandations du GRAPPA et d’EULAR. Toutes les formes de manifestations doivent être prises en compte individuellement et l’approche thérapeutique comprend différents médicaments anti-inflammatoires et immunomodulateurs. Les AINS et les injections de glucocorticoïdes peuvent être initialement utilisés pour contrôler les symptômes. Selon le degré de gravité et la forme des manifestations de l’APs, des csDMARD, des bDMARD ou des tsDMARD sont prescrits. L’objectif thérapeutique principal est d’obtenir une faible activité de la maladie ou une rémission et de préserver ainsi la fonction articulaire à long terme. Pour le choix du traitement, il convient de tenir compte de la qualité de vie et des comorbidités. Pour cela, le traitement doit, dans la mesure du possible, être programmé en interdisciplinarité.
Littérature
- Ritchlin, C.T., R.A. Colbert, and D.D. Gladman, Psoriatic Arthritis. N Engl J Med, 2017. 376(21): p. 2095-6.
- Orbai, A.M., et al., International patient and physician consensus on a psoriatic arthritis core outcome set for clinical trials. Ann Rheum Dis, 2017. 76(4): p. 673-680.
- Ocampo, D.V. and D. Gladman, Psoriatic arthritis. F1000Res, 2019. 8.
- Ogdie, A., S. Schwartzman, and M.E. Husni, Recognizing and managing comorbidities in psoriatic arthritis.Curr Opin Rheumatol, 2015. 27(2): p. 118-26.
- Gladman, D.D., et al., Mortality studies in psoriatic arthritis: results from a single outpatient center. II. Prognostic indicators for death. Arthritis Rheum, 1998. 41(6): p. 1103-10.
- Chandran, V. and S.P. Raychaudhuri, Geoepidemiology and environmental factors of psoriasis and psoriatic arthritis. J Autoimmun, 2010. 34(3): p. J314-21.
- Veale, D.J. and U. Fearon, The pathogenesis of psoriatic arthritis. Lancet, 2018. 391(10136): p. 2273-2284.
- Veale, D., et al., Reduced synovial membrane macrophage numbers, ELAM-1 expression, and lining layer hyperplasia in psoriatic arthritis as compared with rheumatoid arthritis. Arthritis Rheum, 1993. 36(7): p. 893-900.
- Kruithof, E., et al., Synovial histopathology of psoriatic arthritis, both oligo- and polyarticular, resembles spondyloarthropathy more than it does rheumatoid arthritis. Arthritis Res Ther, 2005. 7(3): p. R569-80.
- Veale, D.J. and U. Fearon, What makes psoriatic and rheumatoid arthritis so different? RMD Open, 2015. 1(1): p. e000025.
- Sucur, A., et al., Chemokine signals are crucial for enhanced homing and differentiation of circulating osteoclast progenitor cells. Arthritis Res Ther, 2017. 19(1): p. 142.
- Kane, D., et al., A prospective, clinical and radiological study of early psoriatic arthritis: an early synovitis clinic experience. Rheumatology (Oxford), 2003. 42(12): p. 1460-8.
- Cartron, A.M., et al., Janus kinase inhibitors for atopic dermatitis: a promising treatment modality. Clin Exp Dermatol, 2021. 46(5): p. 820-824.
- FitzGerald, O., et al., Psoriatic arthritis. Nat Rev Dis Primers, 2021. 7(1): p. 59.
- Ogdie, A. and P. Weiss, The Epidemiology of Psoriatic Arthritis. Rheum Dis Clin North Am, 2015. 41(4): p. 545-68.
- Tillett, W., et al., Smoking and delay to diagnosis are associated with poorer functional outcome in psoriatic arthritis. Ann Rheum Dis, 2013. 72(8): p. 1358-61.
- Haroon, M., P. Gallagher, and O. FitzGerald, Diagnostic delay of more than 6 months contributes to poor radiographic and functional outcome in psoriatic arthritis. Ann Rheum Dis, 2015. 74(6): p. 1045-50.
- Gladman, D.D., et al., Do patients with psoriatic arthritis who present early fare better than those presenting later in the disease? Ann Rheum Dis, 2011. 70(12): p. 2152-4.
- Rida, M.A. and V. Chandran, Challenges in the clinical diagnosis of psoriatic arthritis. Clin Immunol, 2020. 214: p. 108390.
- Moll, J.W.V., Psoriatic arthritis. Semin. Arhtritis Theum, 1973. 3: p. 55-78.
- Wright, V., Rheumatism and psoriasis: a re-evaluation. Am J Med, 1959. 27: p. 454-62.
- Baker, H., D.N. Golding, and M. Thompson, PSORIASIS AND ARTHRITIS. Br Med J, 1963. 2(5371): p. 1527.
- Blumberg, B.S., et al., NOMENCLATURE AND CLASSIFICATION OF ARTHRITIS AND RHEUMATISM (TENTATIVE) ACCEPTED BY THE AMERICAN RHEUMATISM ASSOCIATION. Bull Rheum Dis, 1964. 14: p. 339-40.
- Chandran, V., C.T. Schentag, and D.D. Gladman, Sensitivity of the classification of psoriatic arthritis criteria in early psoriatic arthritis. Arthritis Rheum, 2007. 57(8): p. 1560-3.
- Taylor, W., et al., Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum, 2006. 54(8): p. 2665-73.
- Herold G. Innere Medizin, 2023
- Rajendran, C.P., et al., Psoriatic arthritis. J Assoc Physicians India, 2003. 51: p. 1065-8.
- Chandran, V., et al., Patterns of peripheral joint involvement in psoriatic arthritis-Symmetric, ray and/or row?Semin Arthritis Rheum, 2018. 48(3): p. 430-435.
- D’Agostino, M.A. and I. Olivieri, Enthesitis. Best Pract Res Clin Rheumatol, 2006. 20(3): p. 473-86.
- Gladman, D.D., et al., Dactylitis in psoriatic arthritis: prevalence and response to therapy in the biologic era. J Rheumatol, 2013. 40(8): p. 1357-9.
- Brockbank, J.E., et al., Dactylitis in psoriatic arthritis: a marker for disease severity? Ann Rheum Dis, 2005. 64(2): p. 188-90.
- Chandran, V., et al., Axial psoriatic arthritis: update on a longterm prospective study. J Rheumatol, 2009. 36(12): p. 2744-50.
- Sieper, J., et al., New criteria for inflammatory back pain in patients with chronic back pain: a real patient exercise by experts from the Assessment of SpondyloArthritis international Society (ASAS). Ann Rheum Dis, 2009. 68(6): p. 784-8.
- Feld, J., V. Chandran, and D.D. Gladman, What Is Axial Psoriatic Arthritis? J Rheumatol, 2018. 45(12): p. 1611-1613.
- Mader, R., et al., Diffuse idiopathic skeletal hyperostosis (DISH): where we are now and where to go next.RMD Open, 2017. 3(1): p. e000472.
- Winchester, R., et al., HLA associations reveal genetic heterogeneity in psoriatic arthritis and in the psoriasis phenotype. Arthritis Rheum, 2012. 64(4): p. 1134-44.
- Coates, L.C., et al., Effect of tight control of inflammation in early psoriatic arthritis (TICOPA): a UK multicentre, open-label, randomised controlled trial. Lancet, 2015. 386(10012): p. 2489-98.
- Gottlieb, A., et al., Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 2. Psoriatic arthritis: overview and guidelines of care for treatment with an emphasis on the biologics. J Am Acad Dermatol, 2008. 58(5): p. 851-64.
- Wiell, C., et al., Ultrasonography, magnetic resonance imaging, radiography, and clinical assessment of inflammatory and destructive changes in fingers and toes of patients with psoriatic arthritis. Arthritis Res Ther, 2007. 9(6): p. R119.
- De Filippis, L.G., et al., Ultrasonography in the early diagnosis of psoriasis-associated enthesopathy. Int J Tissue React, 2005. 27(4): p. 159-62.
- Härle, P., et al., [Detection of psoriasis arthritis with the GEPARD patient questionnaire in a dermatologic outpatient setting]. Z Rheumatol, 2010. 69(2): p. 157-60, 162-3.
- Martire, M.V., et al., Spanish Validation of the GEPARD Questionnaire for the Detection of Psoriatic Arthritis in Argentinian Patients with Psoriasis. Dermatology, 2019. 235(2): p. 101-106.
- Gladman, D.D., et al., Development and initial validation of a screening questionnaire for psoriatic arthritis: the Toronto Psoriatic Arthritis Screen (ToPAS). Ann Rheum Dis, 2009. 68(4): p. 497-501.
- Kiedrowski, R., K. Becker, and G. Krähn-Senftleben, Psoriasis mit Gelenkbeteiligung. EIn interdisziplinärer Leitfaden für die Diagnosestellung und Therapie. Beilage 387037 in Der Deutsche Dermatologe Nr. 3/2013.
- Husni, M.E., et al., The PASE questionnaire: pilot-testing a psoriatic arthritis screening and evaluation tool. J Am Acad Dermatol, 2007. 57(4): p. 581-7.
- Dominguez, P.L., et al., Validity, reliability, and sensitivity-to-change properties of the psoriatic arthritis screening and evaluation questionnaire. Arch Dermatol Res, 2009. 301(8): p. 573-9.
- Ibrahim, G.H., et al., Evaluation of an existing screening tool for psoriatic arthritis in people with psoriasis and the development of a new instrument: the Psoriasis Epidemiology Screening Tool (PEST) questionnaire. Clin Exp Rheumatol, 2009. 27(3): p. 469-74.
- Mease, P., Psoriatic arthritis and spondyloarthritis assessment and management update. Curr Opin Rheumatol, 2013. 25(3): p. 287-96.
- Stoffer, M.A., et al., Evidence for treating rheumatoid arthritis to target: results of a systematic literature search update. Ann Rheum Dis, 2016. 75(1): p. 16-22.
- Smolen, J.S., et al., Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international task force. Ann Rheum Dis, 2018. 77(1): p. 3-17.
- Helliwell, P.S., et al., The development of candidate composite disease activity and responder indices for psoriatic arthritis (GRACE project). Ann Rheum Dis, 2013. 72(6): p. 986-91.
- Helliwell, P.S., et al., Composite Measures in Psoriatic Arthritis: a report from the GRAPPA 2009 annual meeting. J Rheumatol, 2011. 38(3): p. 540-5.
- Coates, L.C., et al., Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 Treatment Recommendations for Psoriatic Arthritis. Arthritis Rheumatol, 2016. 68(5): p. 1060-71.
- Coates, L.C., et al., Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA): updated treatment recommendations for psoriatic arthritis 2021. Nat Rev Rheumatol, 2022. 18(8): p. 465-479.
- Mease, P.J., et al., Etanercept and Methotrexate as Monotherapy or in Combination for Psoriatic Arthritis: Primary Results From a Randomized, Controlled Phase III Trial. Arthritis Rheumatol, 2019. 71(7): p. 1112-1124.
- Vieira-Sousa, E., et al., GO-DACT: a phase 3b randomised, double-blind, placebo-controlled trial of GOlimumab plus methotrexate (MTX) versus placebo plus MTX in improving DACTylitis in MTX- naive patients with psoriatic arthritis. Ann Rheum Dis, 2020. 79(4): p. 490-498.
- van Mens, L.J.J., et al., Achieving remission in psoriatic arthritis by early initiation of TNF inhibition: a double-blind, randomised, placebo-controlled trial of golimumab plus methotrexate versus placebo plus methotrexate.Ann Rheum Dis, 2019. 78(5): p. 610-616.
- Coates, L.C. and P.S. Helliwell, Methotrexate Efficacy in the Tight Control in Psoriatic Arthritis Study. J Rheumatol, 2016. 43(2): p. 356-61.
- Jadon, D.R., et al., Management of Concomitant Inflammatory Bowel Disease or Uveitis in Patients with Psoriatic Arthritis: An Updated Review Informing the 2021 GRAPPA Treatment Recommendations. J Rheumatol, 2023. 50(3): p. 438-450.
- Gossec, L., et al., EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. Ann Rheum Dis, 2020. 79(6): p. 700-712.
Article en ligne depuis 14.08.2023
Auteurs:
Prof. Wolf-Henning Boencke, Chefarzt Dermatologie und Venerologie, Universitätsspital Genf
Prof. Dr. Diego Kyburz, Chefarzt Rheumatologie, Universitätsspital Basel