Le choix du traitement approprié et des pansements les mieux adaptés sont des facteurs décisifs dans le processus de guérison. La prise en compte du microenvironnement individuel de la plaie joue un rôle important, comme le montrent les connaissances actuelles.
Contrairement à d’autres spécialités médicales, il existe une base de preuves relativement faible dans le domaine de la recherche sur les plaies, ce qui devrait changer à l’avenir. Les synergies entre la pratique clinique et la recherche scientifique sont particulièrement importantes dans ce domaine. Le professeur Ewa K. Stürmer, directrice de l’Institut de recherche translationnelle sur les plaies de l’Université de Witten/Herdecke (Allemagne) [1], a fait un exposé sur les connaissances actuelles dans ce domaine dans le cadre du Congrès de Nuremberg sur les plaies 2019.
Biofilm : que peut-on faire dans le cadre d’un traitement ambulatoire ?
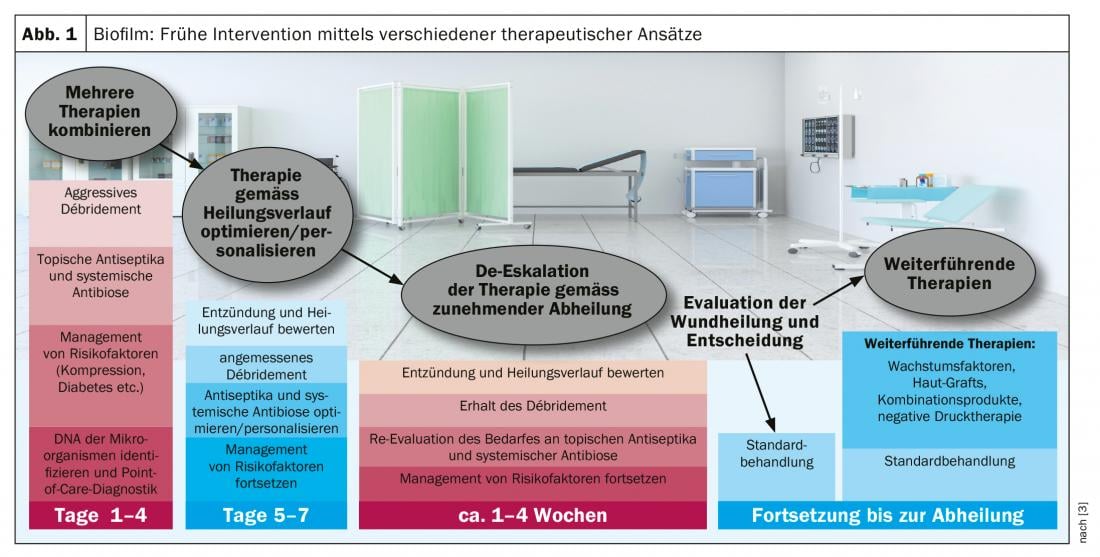
Un biofilm (encadré) se forme dans 78% des plaies chroniques, avec des effets potentiellement négatifs sur la cicatrisation [2]. Le fait que l’environnement de la plaie soit un facteur central de la performance antimicrobienne dans le contexte de la thérapie par biofilm est l’une des découvertes actuelles dans ce domaine [2]. Seul un débridement mécanique permet de nettoyer complètement un biofilm. Le traitement ambulatoire des plaies permet toutefois de réduire la charge bactérienne et d’éviter que le biofilm ne se transforme en infection (Fig. 1). Les méthodes qui ont fait leurs preuves à cet égard sont : l’essuyage intensif et le NaCl, les solutions de rinçage des plaies, la désinfection par pulvérisation, les pansements antiseptiques. En général, les principes suivants s’appliquent aux soins des berges et des alentours de la plaie : les substances antimicrobiennes ont plutôt un effet antiprolifératif ; l’œdème doit être pris en compte, l’hydratation de la peau doit être assurée et des soins de base doivent être fournis. Un biofilm n’implique pas en soi une infection et peut être présent sur une plaie qui ne semble pas infectée. Les bords de la plaie sont souvent affectés par le biofilm. Ceci peut être mis en évidence par la mesure de la fluorescence, car les bactéries ont une fluorescence propre et, lorsqu’elles sont exposées à la lumière UV, la colonisation bactérienne est colorée à une concentration >104/m2. L’intervenante illustre son propos par le cas d’un ulcère du pied diabétique. “Pour éliminer le biofilm, le meilleur et le seul traitement de choix à l’heure actuelle est l’élimination mécanique par curette ou scalpel” [1]. C’est également la conclusion des recommandations actuelles du consensus [3].
Filets hydrophobes et pansements intelligents
“Les filets pour plaies hydrophobes permettent non seulement de réduire les coûts, mais aussi de préserver les cellules” [1]. Dans le cas d’une plaie infectée localement, la conférencière recommande de passer à un pansement hydrophobe après 7 à 10 jours de pansements antimicrobiens et de solutions de rinçage de la plaie. Le mécanisme d’action est notamment dû à la structure de ce réseau de plaies, qui a une influence favorable sur l’absorption des bactéries.
Le sujet des technologies de cicatrisation intelligentes fait l’objet de controverses. D’une part, l’industrie propose déjà des produits permettant de mesurer, par exemple, le pH, la température et l’hypoxie. D’autre part, la question de savoir ce que l’on peut faire sur la base de ces informations est une autre dimension. L’intervenante attire l’attention sur le fait qu’il existe encore un écart important à cet égard. Reconnaître quelle plaie est indiquée pour quel traitement et quels matériaux et méthodes sont favorables ou non au processus de guérison est une question centrale dont le traitement se situe à un autre niveau. Peut-être y aura-t-il à l’avenir d’autres synergies entre ces domaines.
| Biofilm Le biofilm est une communauté microbienne structurée avec une diversité génétique et une expression génétique variable, qui crée des comportements et des mécanismes de défense conduisant à la production d’infections uniques (chroniques) avec une tolérance significative aux antibiotiques et aux antimicrobiens, tout en protégeant de l’immunité de l’hôte [1]. |
Place de l’argent dans les traitements antiseptiques
L’argent est présent dans de nombreux produits de traitement des plaies et, selon une méta-analyse récente [4], son utilisation ciblée et limitée dans le temps présente, outre des effets antimicrobiens, des preuves d’une amélioration de la qualité de vie et d’un bon rapport coût-efficacité. Il est essentiel que l’indication soit correctement posée et que la durée du traitement soit de 14 jours maximum [4]. Une résistance à l’argent cliniquement significative n’a pas été démontrée [5]. La conclusion d’un article publié en 2019 à ce sujet est qu’il n’existe actuellement aucune preuve que la résistance à l’argent constitue une menace sérieuse pour la santé [5]. D’autres études sont nécessaires pour pouvoir tirer des conclusions plus claires à ce sujet et déterminer la quantité d’argent nécessaire pour obtenir un effet thérapeutique optimal.
Source : Le site : Congrès sur les plaies de Nuremberg (D)
Littérature :
- Stürmer EK : Colonisation de plaies, infection ou allergie ? Comment les reconnaître et les traiter ? Ewa K. Stürmer, Institut de recherche translationnelle sur les plaies, Université de Witten/Herdecke (D), présentation de transparents, Nürnberger Wundkongresses 06.12.2019.
- Hülsbömer LF, Rembe JD, Besser M, Stürmer EK : Évaluation quantitative et qualitative de l’efficacité anti-biofilm de substances antimicrobiennes et antiseptiques modernes dans un nouveau modèle de biofilm bactérien in vitro (hpBIOM). Contribution FV37, Nürnberger Wundkongress, 07.12.2019.
- Schultz G, et al. : (pour le groupe d’experts mondial sur les biofilms dans les plaies) : Consensus guidelines for the identification and treatment of biofilms in chronic non healing wounds. Wound Repair and Regeneration 2017 ; 25 (5) : 744-757.
- Dissemond J, et al. : Evidence for silver in wound care – meta-analysis of clinical studies from 2000-2015. J Dtsch Dermatol Ges 2017 ; 15(5) : 524-535.
- Percival SL, Salisbury AM, Chen R : Silver, biofilms and wounds : resistance revisited. Crit Rev Microbiol 2019 ; 45(2) : 223-237.
HAUSARZT PRAXIS 2020 ; 15(1) : 28-30 (publié le 25.1.20, ahead of print)