Le type et la durée du traitement antithrombotique combiné varient. Les facteurs décisifs sont le contexte clinique (coronaropathie stable vs SCA), la nécessité d’une anticoagulation supplémentaire (par ex. fibrillation auriculaire) et le risque de saignement spécifique au patient. La prévention secondaire fait partie intégrante de la prise en charge après une revascularisation.
L’automne 2017 marquera le 40e anniversaire de l’intervention coronarienne percutanée (“percutaneous coronary intervention”, PCI), réalisée pour la première fois avec succès en 1977 par Andreas Grüntzig à l’hôpital universitaire de Zurich [1]. Depuis lors, la méthode n’a cessé de s’améliorer, notamment grâce à l’utilisation et au développement de stents coronaires, avec une diminution progressive des risques périprocéduraux [2]. Pour l’évolution à plus long terme, outre la cicatrisation optimale dans la section coronaire traitée par cathétérisme (en évitant la thrombose de stent [ST] et la resténose d’instent [ISR]), une prévention secondaire adéquate et un éventuel traitement médicamenteux des troubles pectangineux résiduels sont déterminants [3].
Supériorité des “stents à élution de médicament” (DES) modernes
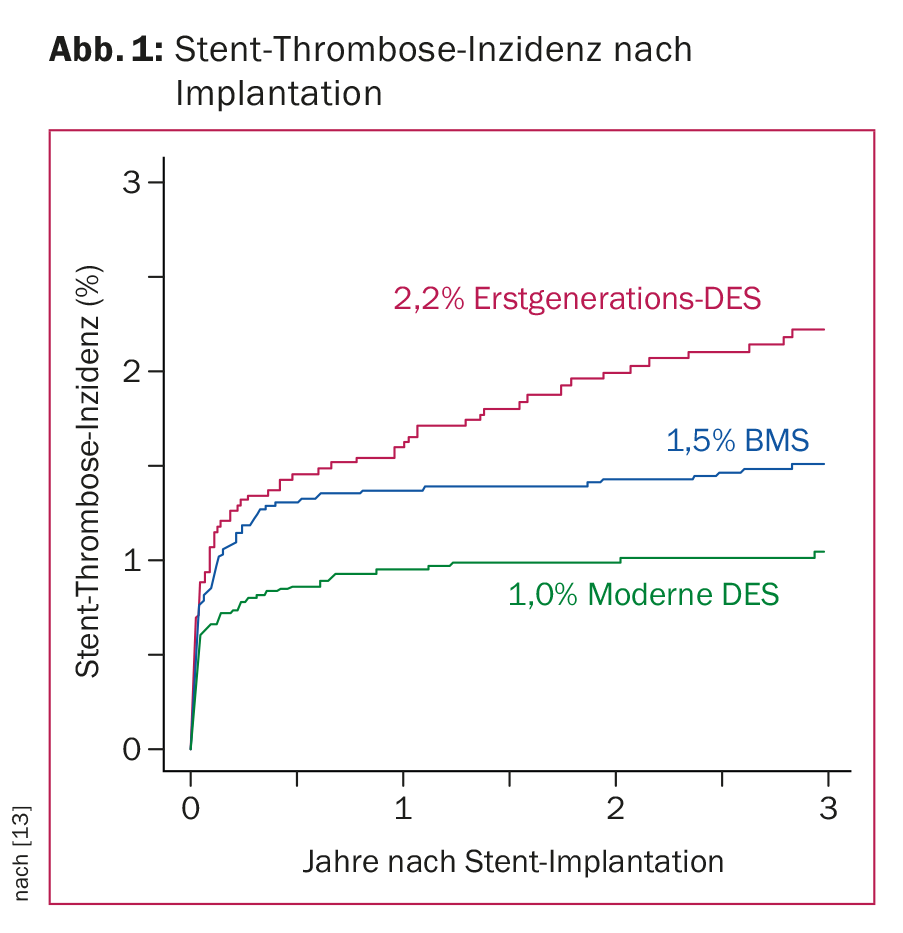
Les excellents résultats obtenus par la technologie actuelle des stents reposent sur les progrès de la pharmacothérapie et l’innovation en matière de dispositifs, combinés à une technique d’implantation optimale [4]. Il est essentiel de prévenir l’ISR et le ST. Des études de registre et des études comparatives récentes sur les DES modernes, menées sur des groupes de patients représentatifs, montrent leur supériorité par rapport aux stents en métal nu (“bare metal stents”, BMS), avec un taux moyen de ST inférieur à 1% au cours de la première année après l’implantation du stent et de 0,2 à 0,4% par an par la suite. (Fig. 1). Avec les DES modernes, l’ISR cliniquement manifeste survient dans moins de 5% des cas. En raison des données optimales disponibles sur le DES moderne, les stents non recouverts (BMS) ne sont plus implantés que dans de rares cas en Suisse aujourd’hui. De nouveaux développements tels que l’utilisation de ballons recouverts de médicaments ou de “scaffolds” résorbables (c’est-à-dire des structures de stents qui se dissolvent avec le temps) sont certes prometteurs, mais ils restent pour l’instant réservés à des groupes de patients spécifiques compte tenu des données encore limitées disponibles.
Thérapie antithrombotique
Le choix ou la combinaison du traitement antithrombotique dépend en premier lieu du contexte clinique (maladie coronarienne stable (MCS), infarctus du myocarde sans élévation du segment ST (NSTEMI) ou infarctus du myocarde avec élévation du segment ST (STEMI)). En fin de compte, il s’agit de trouver une combinaison d’un risque d’ischémie et d’un risque de saignement aussi bas que possible. Les indications de gastroprotection pendant le traitement antithrombotique combiné sont généreuses (âge supérieur à 65 ans, antécédents de saignement gastro-intestinal antérieur, association avec des stéroïdes). En cas d’utilisation de clopidogrel, l’oméprazole doit être évité en raison du potentiel d’interaction.
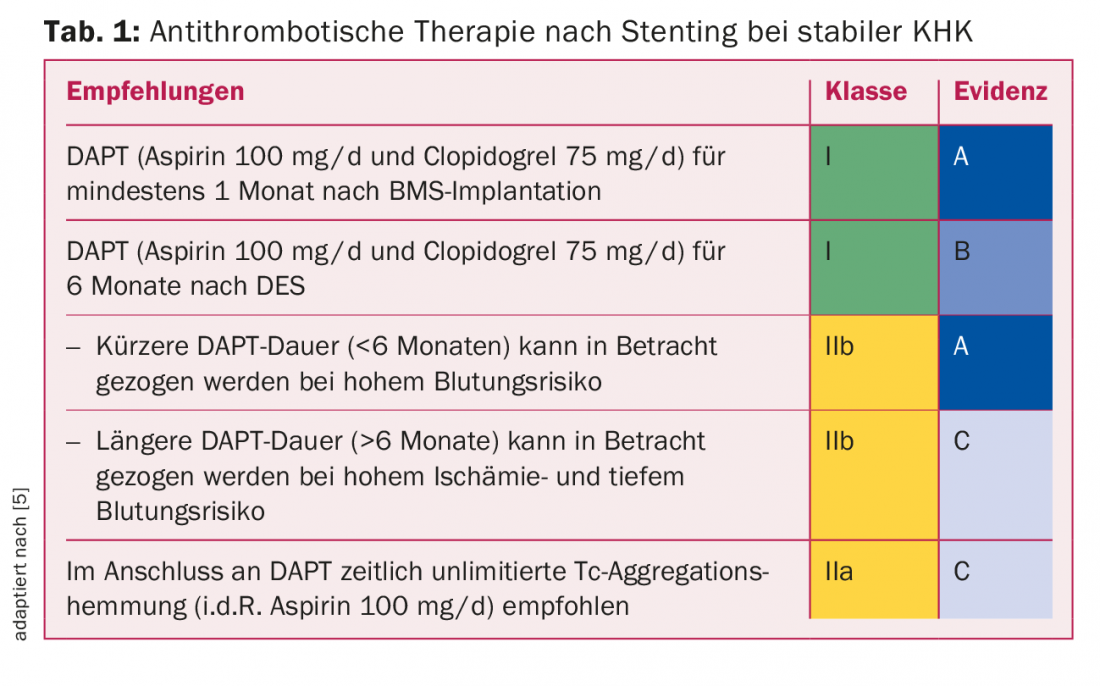
Inhibition de l’agrégation plaquettaire en cas de coronaropathie stable : pour l’ICP avec implantation de stent en cas de coronaropathie stable, il existe surtout des données avec l’association d’aspirine et de clopidogrel. Le tableau 1 présente les directives actuelles en vigueur en Suisse, en s’appuyant sur les guidelines européennes [5]. En raison de la survenue relativement fréquente de ST très tardifs, une durée de douze mois de la double thérapie antiplaquettaire (“dual antiplatelet therapy”, DAPT) était recommandée pour les DES de première génération jusqu’à il y a quelques années. Cependant, l’endothélialisation vasculaire dans les DES modernes est déjà terminée quelques mois après l’implantation du stent, c’est pourquoi six mois de DAPT sont en général absolument suffisants. Une éventuelle adaptation de cette durée de DAPT est déterminée par le cardiologue interventionnel lors de l’implantation du stent : une extension à douze mois en cas de lésions complexes, une réduction à un à six mois en cas de risque hémorragique très élevé.
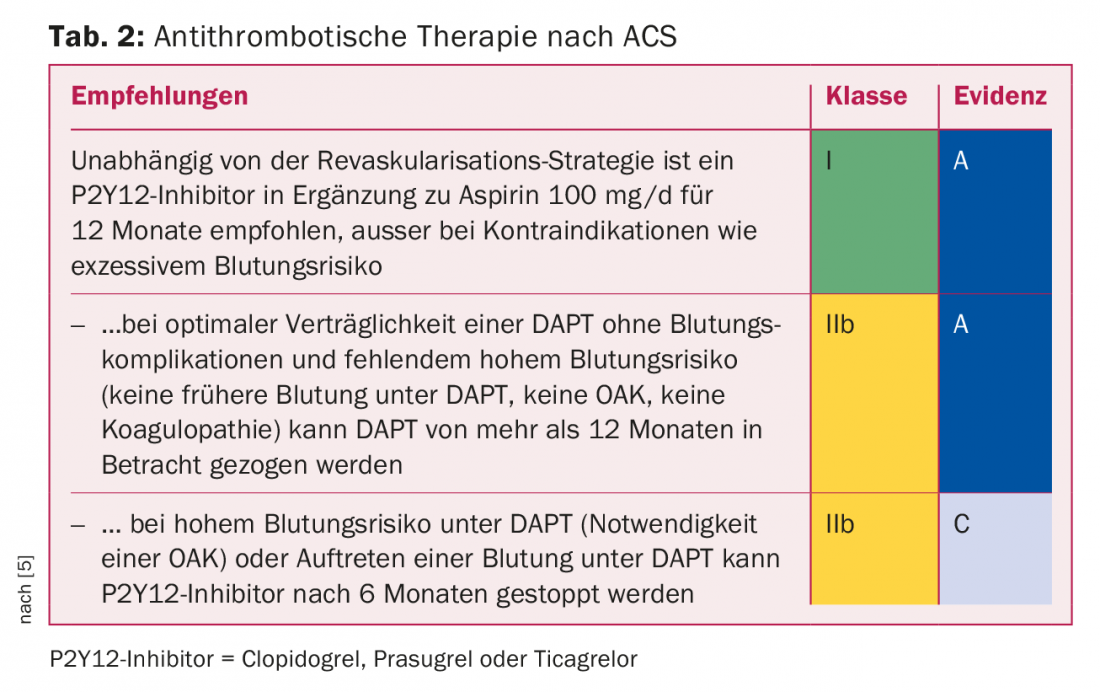
Inhibition de l’agrégation plaquettaire après un syndrome coronarien aigu (SCA) : Le risque d’ischémie reste élevé pendant plusieurs années (Tab.2). Les grandes études comparatives entre le prasugrel et le clopidogrel [6] d’une part, et entre le ticagrelor et le clopidogrel [7] d’autre part, menées chez des patients atteints de SCA au cours des douze premiers mois suivant le SCA, ont montré une réduction significative des infarctus du myocarde et des décès d’origine cardiovasculaire sous prasugrel et ticagrelor par rapport au clopidogrel. En l’absence d’études comparatives directes entre le ticagrelor et le prasugrel, il n’est pas possible de se prononcer clairement sur la différence d’efficacité entre les deux substances. L’étude PLATO, menée en tant qu’étude “allcomers” avec le ticagrelor, permet une transposition à tous les collectifs de patients atteints de SCA, l’étude TRITON, menée avec le prasugrel, est une étude PCI pure et ne permet donc pas de transposition à un collectif de SCA traités de manière conservatrice. Si l’on tient compte des contre-indications (hémorragie aiguë, hémorragie intracrânienne, insuffisance hépatique modérée à sévère) et des effets secondaires (dyspnée), le ticagrelor s’impose comme un médicament de premier choix pour tous les patients atteints de SCA.
Une autre question est : “SCA : DAPT pour plus de douze mois ?” Le risque cardiovasculaire reste plus élevé que la moyenne dans les années suivant un SCA, principalement en raison d’une progression générale de l’athérosclérose coronaire avec des ruptures de plaques ou de nouvelles sténoses pertinentes à d’autres endroits du système coronaire [8].
Environ la moitié des récidives cardiovasculaires sont dues à une nouvelle lésion. De manière pas tout à fait inattendue, l’étude PEGASUS, menée avec le ticagrelor (2× 60 mg vs 2× 90 mg vs placebo), montre une réduction significative des événements cardiovasculaires (réduction du risque absolu de près de 2%, number needed to treat 70) sous ticagrelor – au prix d’un plus grand nombre d’hémorragies non mortelles, principalement gastro-intestinales.
Que faut-il penser des nouveaux scores de stratification du risque de saignement (www.precisedapt.com) ? Des scores cliniques faciles à utiliser, basés sur Internet ou sur des applications, permettent d’identifier les patients à haut risque à l’aide de paramètres anamnestiques et cliniques au niveau individuel, avec une réduction correspondante de la durée du DAPT en cas de risque élevé de saignement et avec une durée normale (ou plus longue) du DAPT en cas de risque “non élevé” de saignement [9]. Cependant, la validation pour la pratique clinique quotidienne n’a pas encore eu lieu.
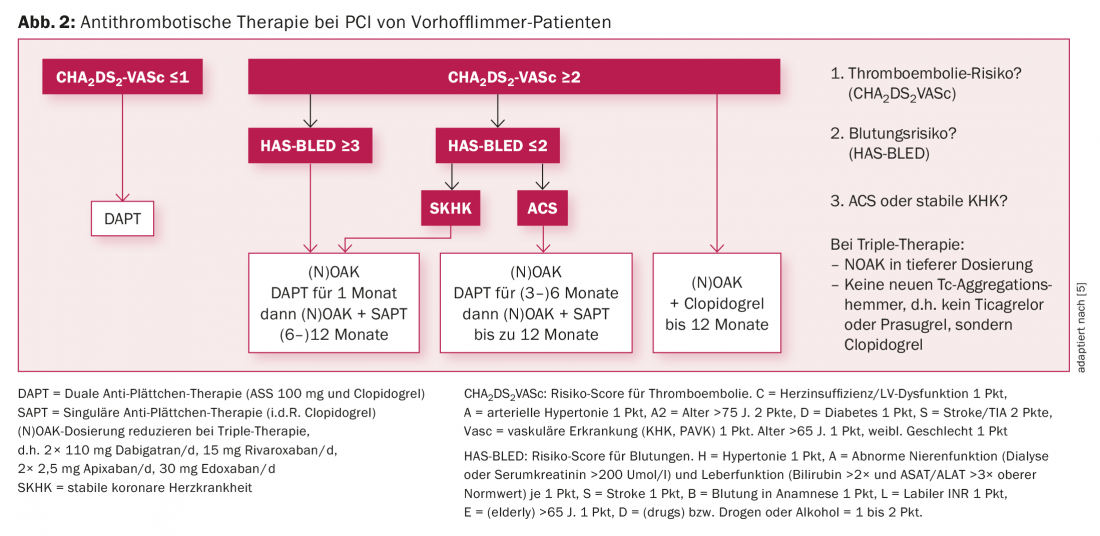
Fibrillation auriculaire et ICP (Fig. 2) : La fibrillation auriculaire est une comorbidité fréquente chez les patients coronariens, en particulier chez les personnes âgées [10]. En conséquence, la question de l’association d’un traitement anti-agrégant plaquettaire et d’un traitement anticoagulant plasmatique se pose en cas d’ICP et surtout après celle-ci. Les avantages des NOAK démontrés par les grandes études sur la fibrillation auriculaire, avec moins d’hémorragies (notamment intracrâniennes) par rapport aux AVK, peuvent être transposés, sur la base de sous-analyses, au collectif de patients coronariens souffrant de fibrillation auriculaire. Mais là encore, il y a un équilibre à trouver entre la prévention du ST/stroke d’une part et l’hémorragie d’autre part. Dans les directives établies depuis plusieurs années, il est important de déterminer le type et la durée de la thérapie combinée sur la base du risque hémorragique et thromboembolique estimé par des scores et de la situation individuelle de l’IRC, en impliquant les équipes de traitement de suivi dans la décision.
La récente étude Pioneer-ACS a confirmé qu’une bithérapie avec rivaroxaban 15 mg et 75 mg de clopidogrel ou l’association avec une très faible dose de rivaroxaban (2× 2,5 mg/d plus aspirine 100 mg/d plus clopidogrel 75 mg/d) est associée à un risque hémorragique plus faible par rapport à une trithérapie classique, avec un taux de thrombose de stent et d’AVC probablement inchangé à un niveau bas [11].
En résumé, dans le collectif de fibrillation auriculaire avec ICP, il faut individualiser le traitement antithrombotique sur la base du risque individuel de saignement et de thrombose de stent. L’association du ticagrelor ou du prasugrel avec les (N)OAK n’est pas autorisée. Si une trithérapie est nécessaire, le clopidogrel doit être utilisé à la place du ticagrelor ou du prasugrel.
Traitement anti-ischémique
En cas de revascularisation incomplète ou de récidive de l’angine de poitrine, un traitement médicamenteux anti-ischémique doit être poursuivi ou réinstauré. Les principes d’un traitement en principe individualisé et la question d’un (nouveau) examen invasif s’orientent d’une part sur l’efficacité de la mesure à réduire les symptômes et d’autre part sur le bénéfice potentiel en termes de pronostic [12]. Les médicaments antiangineux qui n’améliorent pas le pronostic, comme les nitrates, doivent en principe être arrêtés en l’absence de symptômes.
Prévention secondaire
Importance de la rééducation : Une prévention secondaire optimale est d’une importance capitale pour un succès durable de l’ICP. Il est bien connu que l’ICP initiale ne fait que résoudre le problème mécanique aigu et ne guérit pas la maladie (coronarienne). Le contrôle des facteurs de risque cardiovasculaire est d’autant plus important pour le succès du traitement. Les valeurs cibles pour la pression artérielle, la dyslipidémie et la glycémie sont présentées dans le tableau 3. Après une intervention par cathéter, il est possible de poser de nouveaux jalons pour un changement durable du mode de vie.
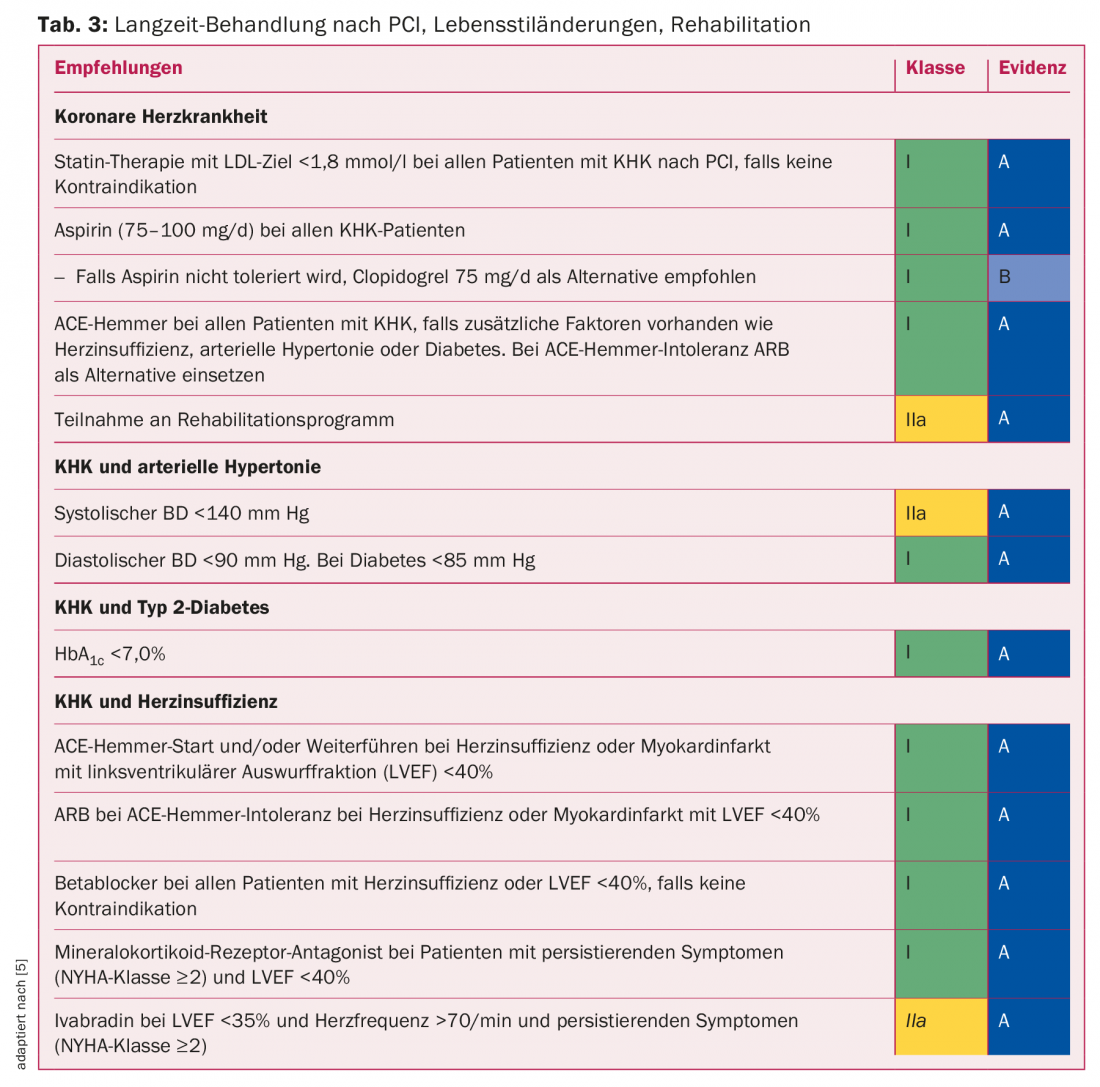
Les changements de style de vie tels que l’arrêt du tabac, l’augmentation de l’activité physique, le contrôle du poids, l’alimentation, la gestion du stress et autres sont encore beaucoup plus difficiles à mettre en œuvre par rapport aux mesures médicamenteuses. La rééducation ambulatoire ou hospitalière qui suit immédiatement l’intervention de revascularisation permet d’instruire et d’accompagner le patient dans la mise en œuvre des changements de mode de vie et de le réintégrer dans son environnement antérieur. Selon une méta-analyse récente, la réadaptation permet de réduire d’environ 20% les futures hospitalisations pour causes cardiovasculaires. Même la mortalité cardiovasculaire peut être influencée favorablement, à savoir réduite d’environ un quart [13]. La réadaptation cardiaque est rentable et fait partie des prestations obligatoires de l’assurance maladie obligatoire.
Contrôles de suivi recommandés
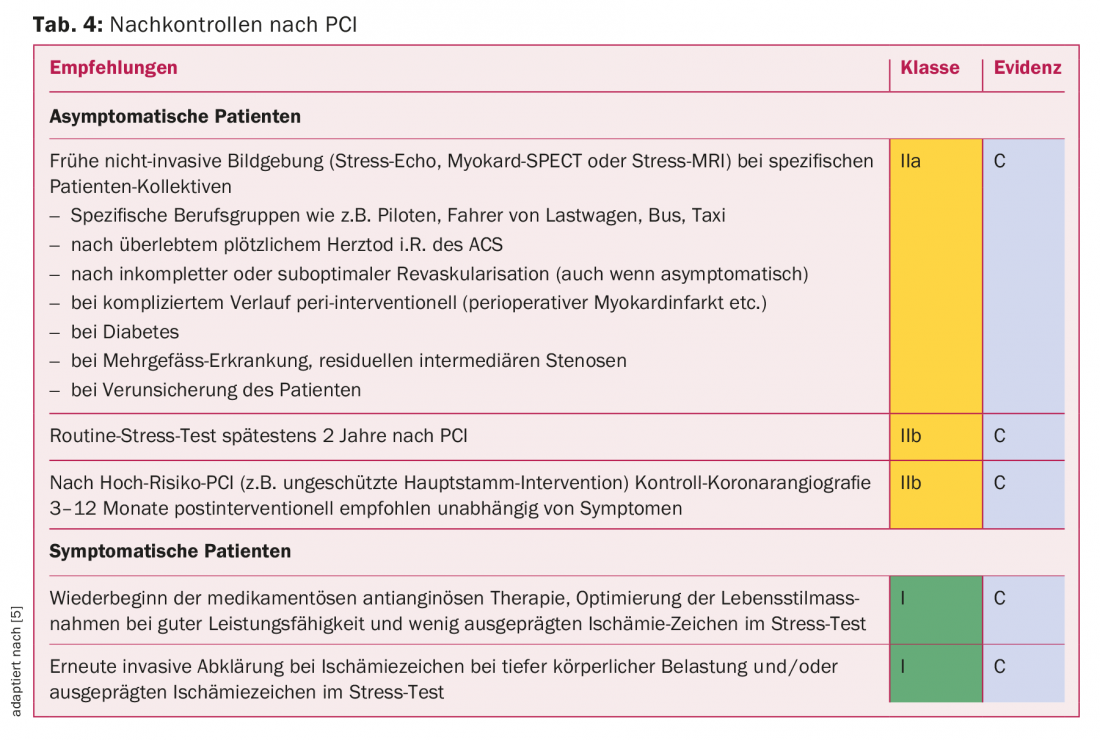
En ce qui concerne le suivi, il existe certes des recommandations, mais elles sont peu fondées sur des preuves, faute d’études de grande envergure. En raison de l’amélioration des performances des DES modernes, les ISR sont aujourd’hui relativement rares (<5% des cas) et une nouvelle ischémie est majoritairement l’expression d’une progression de la maladie coronarienne. L’attention lors du suivi porte non seulement sur la réapparition de l’ischémie coronarienne, mais aussi sur l’optimisation individuelle du profil de risque cardiovasculaire et l’adaptation du traitement antithrombotique. Les principaux aspects supplémentaires sont résumés dans le tableau 4.
Messages Take-Home
- Avec les stents modernes recouverts de médicaments, le taux moyen de thrombose de stent attendu est désormais inférieur à 1% et le taux de resténose d’instent inférieur à 5%.
- Le type et la durée du traitement antithrombotique combiné varient assez fortement et dépendent principalement du contexte clinique (coronaropathie stable vs SCA), de la nécessité d’une anticoagulation supplémentaire (p. ex. fibrillation auriculaire) et du risque hémorragique spécifique au patient.
- Une prévention secondaire durable intégrant une approche cardiaque
- La réadaptation fait partie intégrante de la prise en charge après revascularisation, améliore le pronostic à long terme et réduit l’apparition de nouveaux symptômes ischémiques.
- Selon l’avis des experts, un suivi médical continu des patients coronariens après ICP est important pour soutenir la mise en œuvre d’une prévention secondaire optimale et la détection précoce d’une resténose instent pertinente ou d’une progression de la maladie coronarienne.
Littérature :
- Gruentzig A : Dilatation transluminale de la sténose de l’artère coronaire. Lancet 1978 ; 1(8058) : 263.
- Stefanini GG, Holmes DR Jr : Stents coronariens à élution de drogue. N Engl J Med 2013 ; 368(3) : 254-265.
- Piepoli MF, et al : 2016 European Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J 2016 ; 37 : 2315-2381.
- Byrne RA, Johner, Kastrati A : Thrombose et resténose de stent : qu’avons-nous appris et où allons-nous ? La conférence Andreas Gruentzig ESC 2014. Eur Heart J 2015 ; 36 : 2608-2620.
- Auteurs/membres du groupe de travail : 2014 ESC/EACTS Guidelines on myocardial revascularization. The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2014 ; 35 : 2541-2619.
- Wiviott SD, et al : Triton-TIMI 38 Investigators : Prasugrel versus clopidogrel in patients with acute coronary syndromes. New Engl J Med 2007 ; 357 : 2001-2015.
- Wallentin L, et al. : PLATO Investigators. Ticagrelor versus clopidogrel chez les patients atteints de syndromes coronariens aigus. N Engl J Med 2009 ; 361 : 1045-1057.
- Bhatt DL, et al. : Investigateurs du registre REACH. Déterminants comparatifs des taux d’événements cardiovasculaires à 4 ans chez les patients stables à risque d’athérothrombose ou avec athérothrombose. JAMA 2010 ; 304(12) : 1350-1357.
- Costa F, et al : Derivation and validation of the predicting bleeding complications in patients undergoing stent implantation and subsequent dual antiplatelet therapy (PRECISE-DAPT) score : a pooled analysis of individual-patient datasets from clinical trials. Lancet 2017 ; 389 : 1025-1034.
- Van Diepen S, et al : Mortalité et réadmission des patients atteints de défaillance cardiaque, de fibrillation auriculaire ou de maladie coronarienne subissant une chirurgie non cardiaque : une analyse de 38,047 patients. Circulation 2011 ; 124(3) : 289-296.
- Gibson CM, et al : Prevention of Bleeding in Patients with Atrial Fibrillation Undergoing PCI. New Engl J Med 2016 ; 375(25) : 2423-2434.
- Rickli H, et al. : Angine de poitrine stable : traitement médicamenteux vs stent. Le médecin informé 2017 ; 2.
- Tada T, et al : Risk of stent thrombosis among bare-metal stents, first-generation drug-eluting stents, and second-generation drug-eluting stents : results from a registry of 18,334 patients. JACC Cardiovasc Interv 2013 ; 6 : 1267-1274.
CARDIOVASC 2017 ; 16(3) : 15-19











