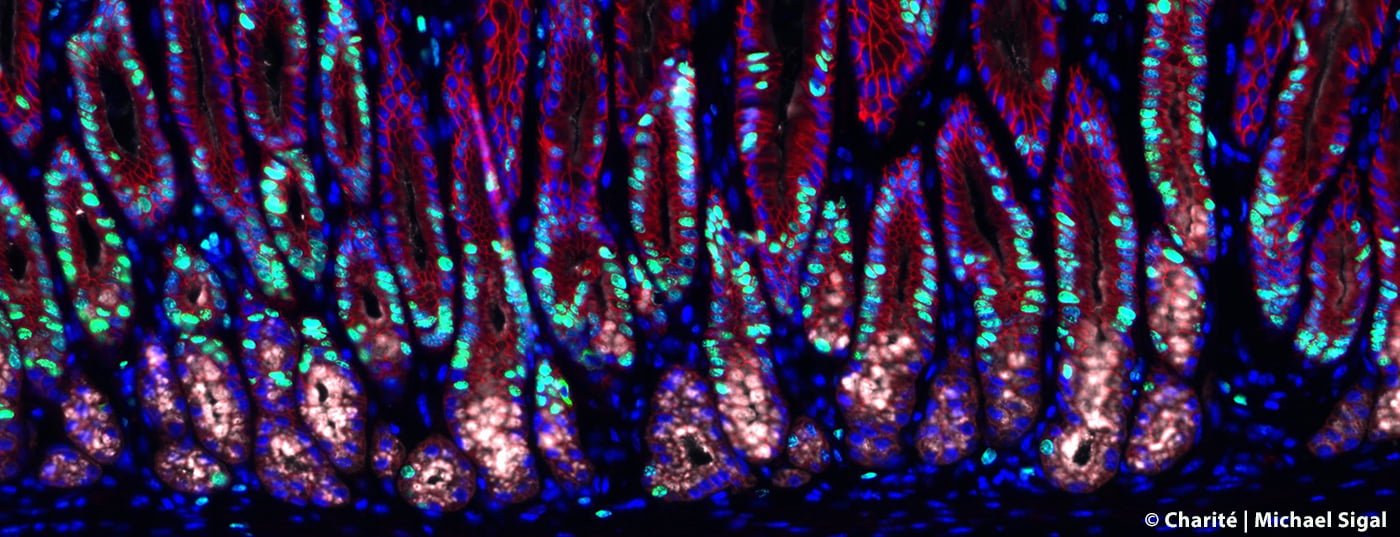
Une infection de la muqueuse gastrique par la bactérie Helicobacter provoque des inflammations de l’estomac et augmente également le risque de cancer de l’estomac. Une équipe de recherche de la Charité – Médecine universitaire de Berlin et du Centre Max Delbrück pour la médecine moléculaire dans la communauté Helmholtz (MDC) a pu mettre en évidence des changements caractéristiques dans les glandes gastriques au cours d’une infection. Les scientifiques ont ainsi découvert un mécanisme jusqu’ici inconnu qui limite la division cellulaire dans les tissus sains et protège ainsi contre le développement du cancer. Mais une infection de l’estomac annule cette protection, ce qui permet aux cellules de se développer de manière incontrôlée.
La colonisation de l’estomac par Helicobacter pylori concerne environ la moitié de l’humanité dans le monde. Elle fait donc partie des infections bactériennes chroniques les plus fréquentes. Par la suite, des inflammations de l’estomac ou un cancer de l’estomac peuvent se développer. En raison du contact permanent avec l’acide gastrique, la muqueuse gastrique saine se renouvelle complètement en quelques semaines, sa structure et sa composition restant toujours inchangées. “Michael Sigal, directeur du groupe de travail Emmy Noether à la Clinique médicale spécialisée en hépatologie et gastroentérologie de la Charité et à l’Institut de biologie des systèmes médicaux de Berlin (BIMSB), qui fait partie du Centre Max Delbrück de médecine moléculaire de la Communauté Helmholtz (MDC). “Notre équipe a maintenant découvert que les interactions complexes entre différentes cellules et signaux qui assurent la stabilité des tissus sont perturbées par une infection”.
Pour suivre les modifications des glandes gastriques dues à l’infection par Helicobacter, l’équipe de recherche, en collaboration avec des scientifiques de l’Institut Max Planck de biologie infectieuse, a utilisé des modèles de souris complexes dans lesquels certaines cellules des glandes gastriques peuvent être visualisées, isolées et étudiées avec précision grâce à des technologies de pointe, telles que l’imagerie et le séquençage de cellules individuelles sur les tissus. En outre, ils ont développé en laboratoire des microstructures spéciales ressemblant à des organes – appelées organoïdes – afin de pouvoir limiter l’utilisation de modèles animaux. Ces minuscules estomacs miniatures leur ont permis de reproduire de nombreuses caractéristiques des glandes et d’étudier l’influence de multiples signaux sur les cellules souches qui s’y trouvent et qui peuvent donner naissance à différents types de cellules.
“Nous avons découvert que les cellules dites stromales, qui entourent les glandes, ne sont pas seulement responsables de la stabilité mécanique, comme on le pensait jusqu’à présent. Elles produisent également des messagers qui influencent considérablement le comportement des glandes”, décrit le professeur Sigal. Parmi ces messagers, on trouve la “Bone Morphogenetic Protein” (BMP), qui joue un rôle important dans le développement des tissus. Les chercheurs ont pu montrer que les cellules stromales qui entourent la base de la glande suppriment continuellement la voie de signalisation BMP et stimulent ainsi la division des cellules souches qui s’y trouvent. En revanche, les cellules stromales situées à l’extrémité de la glande activent la voie de signalisation et empêchent ainsi la division cellulaire à cet endroit. Cette influence de l’environnement est à la base de la stabilité de la structure glandulaire. L’infection à Helicobacter entraîne la libération de substances inflammatoires telles que l’interféron gamma (IFN-γ). Dans le cadre de cette réaction inflammatoire, des messagers sont désormais produits en plus grand nombre, ce qui stimule la division cellulaire des cellules souches dans les glandes. Cela conduit finalement à ce que l’on appelle l’hyperplasie, c’est-à-dire à une augmentation de la taille des tissus et à l’apparition de précurseurs de cancer.
“Nos découvertes montrent qu’une infection et l’inflammation qui l’accompagne ont beaucoup plus d’effets sur les tissus qu’on ne le pensait jusqu’à présent : les substances inflammatoires classiques comme l’IFN-γ n’ont pas seulement un effet antimicrobien direct, mais influencent également la division cellulaire et le comportement des cellules souches dans les tissus. En cas de lésion tissulaire, une division cellulaire rapide peut être très utile pour permettre une guérison rapide. Cependant, dans le cas d’une inflammation chronique due à une infection par Helicobacter, elle pourrait favoriser le développement de précurseurs de cancer”, résume le professeur Sigal. Les voies de signalisation dans l’interaction entre le système immunitaire et les cellules souches, qui pourraient également être importantes pour d’autres organes que l’estomac, constituent donc un point de départ pour de nouvelles thérapies – à la fois dans la prévention du cancer et dans la médecine régénérative.
Source originale :
Kapalczynska M, et al : Schmidt F, et al : BMP feed-forward loop promotes terminal differentiation in gastric glands and is interrupted by H. pylori-driven inflammation. Nature Communication 2022 ; doi : 10.1038/s41467-022-29176-w.