La radiothérapie fait partie intégrante de la prise en charge du NSCLC. Les progrès récents de la radiothérapie dans le NSCLC reposent à la fois sur les avancées techniques et sur une meilleure compréhension de la biologie des rayonnements, des tolérances des tissus normaux et des doses tumorales maximales tolérables les plus élevées. La radiothérapie stéréotaxique du corps est désormais une option thérapeutique acceptable pour le CBNPC de stade précoce situé en périphérie chez les patients inaptes à subir une chirurgie définitive. D’autres stratégies récentes impliquent l’augmentation de la dose de radiation, l’utilisation de la planification du traitement basée sur la TEP-CT, la radiothérapie isotoxique et l’utilisation de la radiothérapie par faisceau de particules.
Le cancer du poumon est l’un des cancers les plus répandus dans le monde. Selon le rapport GLOBOCAN 2012 [1], on estime qu’à l’échelle mondiale, une incidence de 16,7 % fait du cancer du poumon le cancer le plus fréquent chez les hommes et contribue également à la mortalité annuelle la plus élevée liée au cancer, soit 34,2 %. Chez les femmes, l’incidence est de 8,8% avec une mortalité de 13,8%. Les incidences du taux standardisé pour l’âge (ASR) pour les hommes et les femmes ont été rapportées comme étant de 34,2 pour 100 000 et 8,8 pour 100 000 respectivement. Pour les deux sexes confondus, le cancer du poumon a été signalé comme la maladie la plus mortelle, avec une mortalité de 19,4 % de toutes les affections malignes.
En 2012, l’Institut national d’épidémiologie et d’enregistrement du cancer (NICER) a indiqué qu’environ 2500 et 1200 nouveaux cas sont détectés chaque année chez les hommes et les femmes respectivement en Suisse [2]. Par conséquent, le cancer du poumon représente le deuxième et le troisième cancer le plus fréquent chez les hommes et les femmes respectivement dans le pays. Au cours de la période entre 1995-1999 et 2005-2009, le pourcentage de survie relative standardisée selon l’âge pour les hommes et les femmes combinés avait montré une amélioration pour la 1ère année suivant le diagnostic de 37,8 à 44,5% et pour la 5ème année de 12,4 à 15,9%. La survie relative s’est avérée être systématiquement meilleure chez les femmes que chez les hommes au cours de ces deux périodes calendaires.
Environ 85 à 90% de tous les cancers du poumon sont des cancers du poumon non à petites cellules (NSCLC). Un diagnostic précoce et l’amélioration des interventions thérapeutiques par le biais de la chirurgie, de la radiothérapie et de la chimiothérapie, ont certainement pu contribuer à l’amélioration des résultats constatés au cours de cette période. La chirurgie est toujours considérée comme la principale modalité de traitement des patients médicalement aptes présentant un CBNPC opérable à un stade précoce. La chimiothérapie dispose désormais d’une gamme de nouveaux agents chimiothérapeutiques et de plusieurs composés ciblés prometteurs. La radiothérapie, élément clé de la prise en charge de ces cancers, a également fait l’objet d’améliorations techniques considérables ces dernières années. Cet article a pour but de présenter une vue d’ensemble des différentes indications de la radiothérapie dans les différents stades du NSCLC et de discuter des développements récents dans l’état de l’art de la radiothérapie pour le NSCLC.
Options de radiothérapie dans le NSCLC
Les différentes options de radiothérapie utilisées dans le cas du NSCLC dépendent du stade de la maladie, de l’état général du patient et de la disponibilité d’installations de radiothérapie spécifiques dans un établissement donné. Ainsi, sur la base des directives du NCCN, de l’ESMO et de la DEGRO, la radiothérapie dans le CBNPC pourrait être largement utilisée comme résumé (Fig. 1) [3–5]:
– Radiothérapie définitive ou radicale seule :
- a) Avec des photons : radiothérapie conformationnelle 3D (3D CRT), radiothérapie à modulation d’intensité (IMRT) ou thérapie à arc modulé volumétrique (VMAT) soutenue par la radiothérapie guidée par l’image (IGRT) et la radiothérapie corporelle stéréotaxique (SBRT). Toutes ces opérations peuvent être réalisées à l’aide de diverses techniques de gating respiratoire disponibles dans un centre donné ;
- b) La thérapie par faisceau de protons
– Radiothérapie préopératoire ou postopératoire : en utilisant la technique appropriée comme indiqué ci-dessus.
– Radiothérapie en association avec la chimiothérapie : Chimioradiothérapie concomitante (CTRT) ou utilisation séquentielle des deux modalités.
– Radiothérapie palliative par faisceau externe ou curiethérapie intraluminale.

Les approches récentes de la radiothérapie pour le NSCLC impliquant la planification du traitement avec gating respiratoire, la planification du traitement basée sur le PET-CT, l’augmentation de la dose avec des stratégies de fractionnement modifiées, la radiothérapie corporelle stéréotaxique (SBRT), les approches de radiothérapie isotoxique et l’utilisation de faisceaux de particules – protons et ions carbone – sont résumées dans les sections suivantes.
Planification du traitement et gating respiratoire
La plupart des patients font l’objet d’une évaluation détaillée dans les différents comités multidisciplinaires de lutte contre les tumeurs afin de définir l’approche thérapeutique optimale en fonction de la tumeur et des caractéristiques du patient. Une fois la radiothérapie envisagée, le patient subit une série d’étapes pour la planification de la radiothérapie visant principalement à minimiser la dose aux structures critiques tout en délivrant des doses adéquates à la tumeur et aux stations nodales adjacentes (Fig. 2).
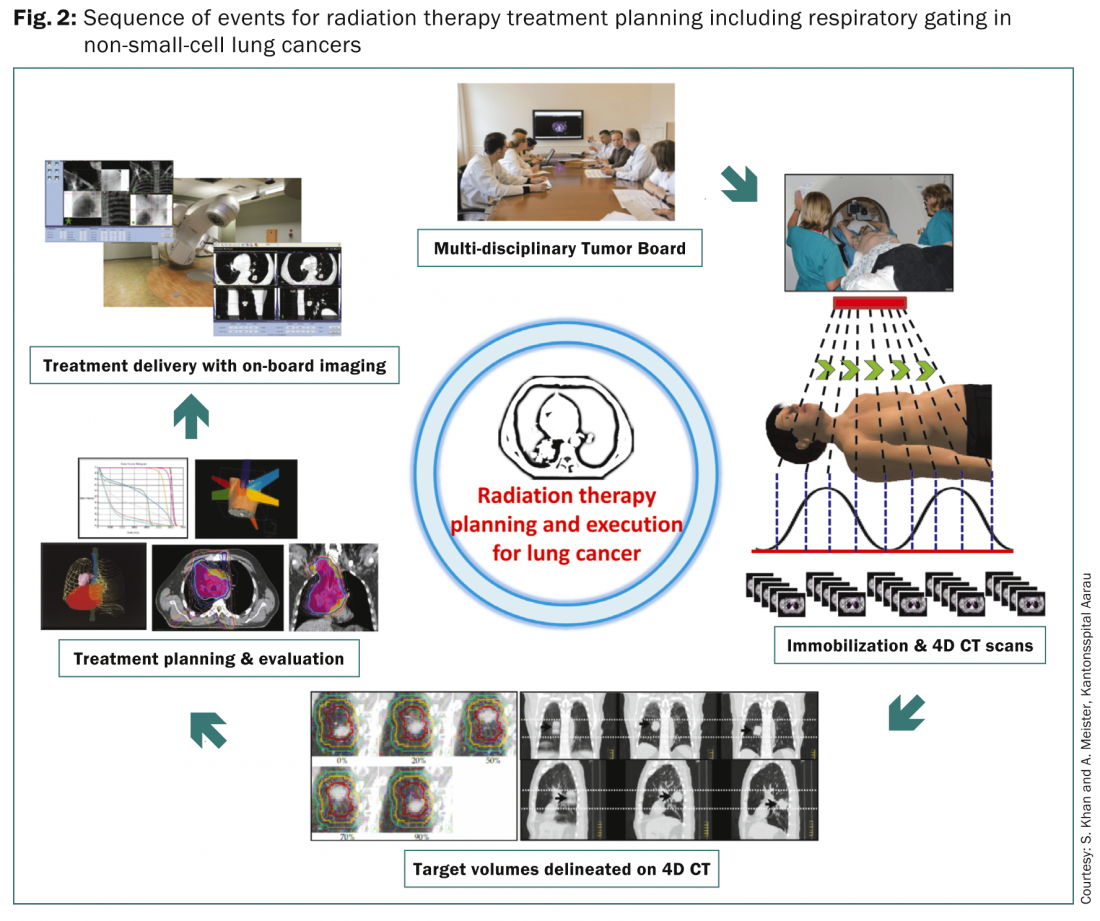
Comme les tumeurs pulmonaires suivent les mouvements respiratoires, il est obligatoire de prendre en compte le mouvement respiratoire et les déplacements résultants de la lésion primaire dans le poumon. Plusieurs méthodes sont actuellement disponibles. Il s’agit notamment de la respiration libre ou du volume cible non interne (VCI) à l’aide d’une simulation standard de tomodensitométrie sans tomodensitométrie 4D ou fusion de scans d’inhalation ou d’expiration ; de l’approche non VCI de l’apnée ou du gating dans laquelle une seule image de tomodensitométrie 3D est acquise à un niveau de respiration prédéterminé ; de l’utilisation de compressions abdominales pendant la tomodensitométrie ; Approche CT 4D, qui implique l’acquisition d’au moins deux ensembles d’images CT 3D en fin d’inspiration ou en fin d’expiration et jusqu’à dix ensembles de données CT 3D correspondant aux différents niveaux du cycle respiratoire. Le CT 4D serait utilisé pour définir les volumes cibles tandis qu’un CT séparé à respiration libre est acquis pour la planification du traitement et les calculs de dose. Les volumes cibles résultants sont généralement définis selon les rapports 62 et 83 de l’ICRU [6,7]. Une discussion détaillée à ce sujet dépasse le cadre de cet article et les lecteurs intéressés peuvent se référer aux rapports 62 et 83 de l’ICRU pour un examen complet.
Une fois les volumes cibles et les organes à risque délimités, la planification du traitement est entreprise afin d’optimiser la combinaison de faisceaux coplanaires ou non coplanaires avec des pondérations, des angles, des formes et des temps de passage des faisceaux différents, en fonction de la technique de traitement à utiliser – 3D CRT, IMRT et VMAT. Une dose de rayonnement définie et le calendrier de fractionnement sont décrits avec des contraintes de dose spécifiées pour divers organes à risque, notamment les poumons, la moelle épinière, l’œsophage, le plexus brachial et le cœur. Les différents plans de traitement alternatifs font l’objet d’une évaluation minutieuse et le plan final est sélectionné sur la base de l’évaluation des histogrammes dose-volume pour les doses aux volumes cibles et aux différents organes à risque. L’administration du traitement se fait généralement sous une surveillance attentive et se déroule en respiration libre, en apnée ou en gating. Tous ces éléments auraient besoin d’une imagerie embarquée pour minimiser les erreurs entre les plans de traitement et leur exécution quotidienne.
Planification de la radiothérapie basée sur le PET-CT
La TEP-TDM au FDG est désormais l’une des modalités diagnostiques utilisées de manière routinière à des fins de stadification dans le CBNPC. Elle est également utilisée pour la planification de la radiothérapie en raison de plusieurs avantages [8] (Fig. 3 ).
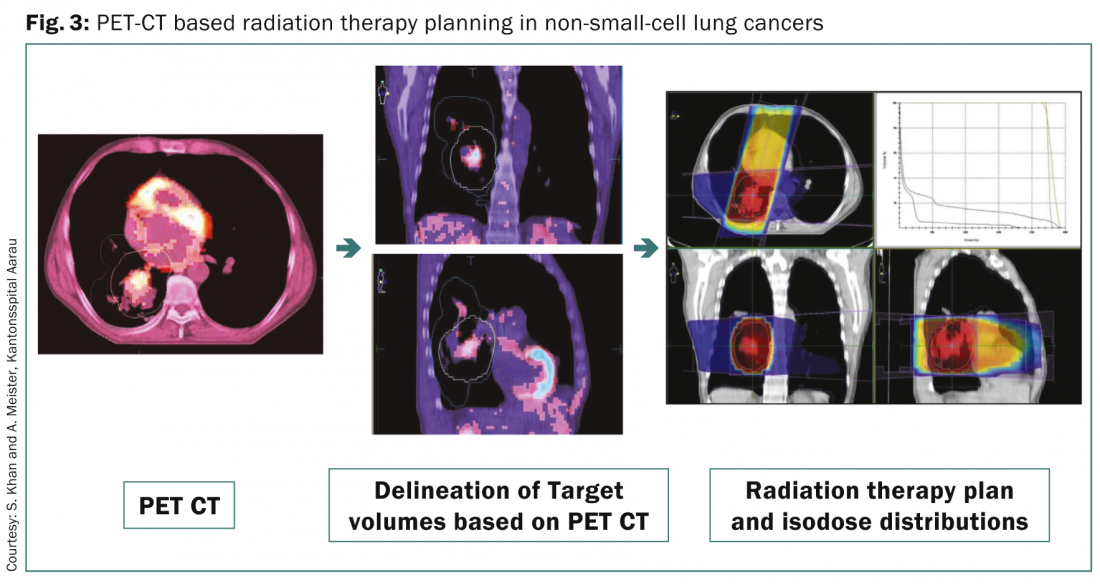
Il s’agit notamment de délimiter les volumes cibles bruts dans un poumon affaissé ; d’aider à l’identification des ganglions lymphatiques régionaux impliqués pour l’irradiation et la planification du CTV ; de détecter toute propagation extrathoracique de la maladie qui pourrait modifier le stade de la maladie et le plan de traitement pour l’escalade de la dose à la maladie brute sur la base des images anato-métaboliques obtenues par FDG-PET. La TEP-CT 4D s’est également avérée utile pour la localisation précise des patients atteints de petites tumeurs nécessitant un traitement et une planification de la radiothérapie par gating respiratoire.
Les résultats cliniques basés sur la planification par TEP-TDM sont assez prometteurs et semblent présenter une faible incidence de récidive loco-régionale. Dans une étude portant sur 137 patients atteints d’un NSCLC de stade III, la récidive loco-régionale était de 14,6 % pour les patients dont le traitement était planifié par TEP-CT [9]. Les résultats d’une étude pilote portant sur 32 patients n’ont fait état que d’un seul patient présentant un échec régional et une progression tumorale locale après une chimioradiothérapie simultanée basée sur la TEP-CT [10]. Actuellement, plusieurs groupes en Europe et aux États-Unis explorent l’utilisation de la TEP-FDG pour la radiothérapie dans le cas du CBNPC (identifiant ClinicalTrials.gov : NCT01024829 et 01507428). L’application de la planification basée sur la TEP-TDM pourrait être élargie dans de futures études impliquant une escalade de dose vers les tumeurs primaires. Cela pourrait être réalisé avec la TEP en utilisant des traceurs hypoxiques, comme le F-MISO, le 18F-FAZA ou le 18F-HX4 qui peuvent identifier les zones radiorésistantes hypoxiques qui pourraient particulièrement bénéficier d’une escalade de dose sélective [8].
Stratégies d’escalade de la dose et de fractionnement modifié
Des études d’escalade de dose ont été entreprises dans le but d’améliorer le contrôle local et ont montré une amélioration de la survie médiane de 20 à 26 mois avec des doses augmentées à 74 Gy dans de multiples études de groupe coopératives de phase I/II avec une chimioradiothérapie simultanée [11–13]. Cependant, les résultats récemment publiés de l’essai de phase III, RTOG 0617, randomisant les patients entre 74 Gy en 37 fractions et le standard 60 Gy en 30 fractions avec paclitaxel/carboplatine hebdomadaire avec ou sans cetuximab, n’ont pas montré de bénéfice avec 74 Gy [14]. De manière surprenante, les échecs locaux et loco-régionaux étaient plus graves dans le bras à plus forte dose, bien que les toxicités entre les deux groupes aient été comparables. Les raisons possibles de ce phénomène pourraient être l’augmentation de la dose cardiaque et la prolongation de la durée globale du traitement dans le bras à forte dose. Le rapport final et les raisons possibles de l’absence d’amélioration avec des doses plus élevées sont en cours d’investigation.
Des schémas de fractionnement modifiés utilisant l’hyperfractionnement (par exemple, CHART : 54 Gy en trois fractions quotidiennes de 1,5 Gy pendant douze jours continus) ont également été explorés dans le CBNPC et des essais randomisés ont montré un avantage en termes de survie par rapport aux schémas de fractionnement conventionnels [15–17]. Ce régime est toutefois difficile à mettre en œuvre sur le plan logistique, même s’il promet d’améliorer les résultats en matière de survie.
Grâce à la disponibilité de la planification du traitement basée sur la TEP-TDM et aux techniques de pointe en matière de radiothérapie, les programmes d’irradiation hypofractionnée avec l’administration de doses supérieures à la norme de 2 Gy par fraction sont actuellement explorés et se sont avérés prometteurs pour les tumeurs de stade précoce, entraînant une survie médiane de 38,5 mois [18]. Ils ont conduit à leur utilisation dans la radiothérapie corporelle stéréotaxique dans les stades précoces du NSCLC, en particulier chez les patients médicalement inaptes à la chirurgie.
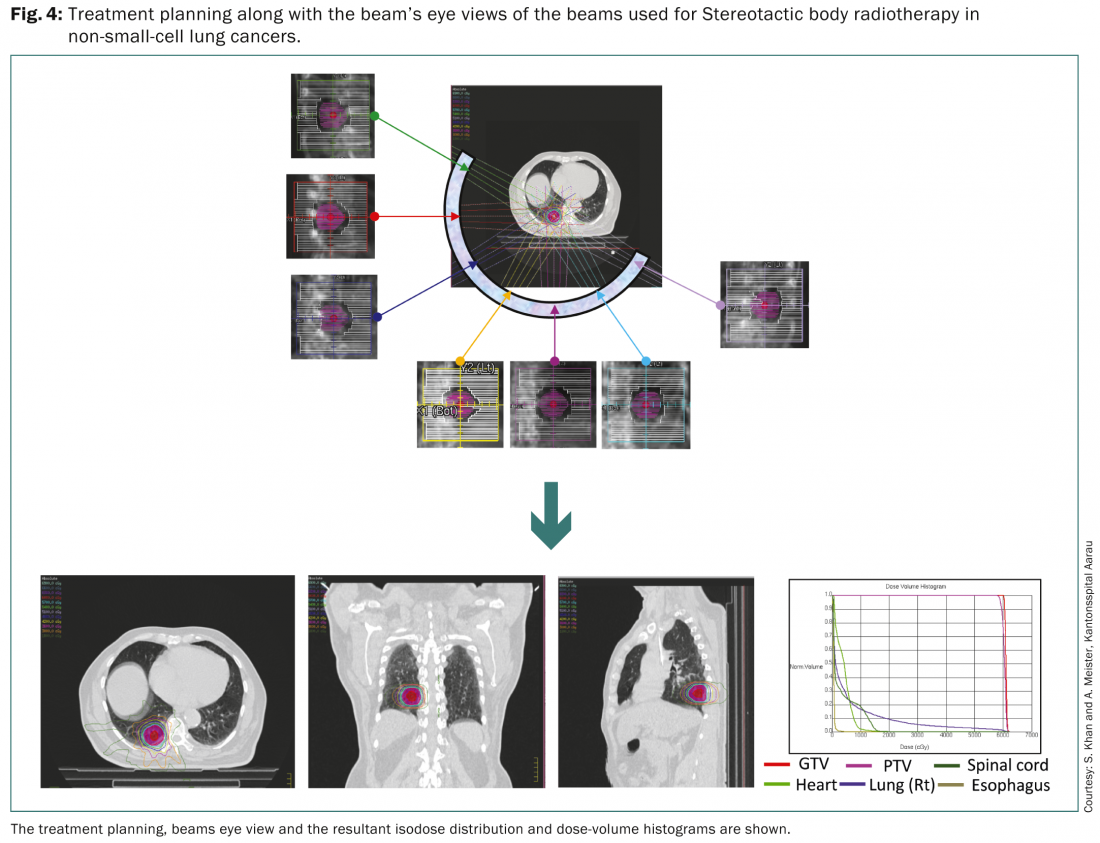
Radiothérapie stéréotaxique du corps (SBRT)
La SBRT permet d’administrer avec précision une dose de rayonnement élevée à de petits volumes tumoraux et permet la pratique d’une radiothérapie hyperfractionnée à haute dose. Selon l’Organisation européenne pour la recherche et le traitement du cancer (EORTC), la SBRT est une approche appropriée pour les patients présentant des lésions périphériques de moins de 6 cm sans ganglions et pourrait être utilisée pour les patients âgés qui ne sont pas aptes à subir une intervention chirurgicale [19]. Elle pourrait également être appliquée aux patients ayant subi une pneumonectomie antérieure. Le gating respiratoire ainsi que la planification du traitement basée sur la TEP-CT au FDG sont recommandés pour la délimitation des différents volumes cibles.
Une revue systématique rapportée par Soldà et al. a comparé les résultats avec une cohorte chirurgicale provenant d’une série de 45 rapports compromettant 3771 patients [20]. Un large éventail de schémas de fractionnement de la dose a été rapporté. Celles-ci allaient de 30 Gy en une seule fraction à 45-72,5 Gy en trois à dix fractions. La survie à 2 ans pour 3201 patients atteints de NSCLC de stade I avec SBRT était de 70% avec un contrôle local à 2 ans de 91%. Cela se compare bien à la survie à 2 ans de 68% chez 2038 patients de stade I traités par chirurgie. Il n’y avait pas de différence en termes de survie ou de survie sans progression locale entre les patients traités avec les différentes techniques de radiothérapie utilisées pour la SBRT.
Une méta-analyse récente, qui vient d’être rapportée, a été réalisée sur 4850 patients provenant de 40 études sur la SBRT et a été comparée aux résultats chirurgicaux de 23 études comprenant 7071 patients dans des cas de NSCLC de stade I [21]. L’âge moyen des patients sous SBRT était inférieur à celui des patients de la série chirurgicale, soit 74 et 66 ans, respectivement. Après ajustement de la proportion de patients opérables et de l’âge, la survie globale, la survie sans maladie et le contrôle local ne différaient pas significativement entre la SBRT et la chirurgie. Les auteurs ont conclu que les approches chirurgicales restaient la norme de soins actuelle pour les patients médicalement opérables, mais que pour ceux qui sont médicalement inaptes ou qui peuvent refuser la chirurgie, la SBRT devrait être proposée comme norme de soins en raison de son efficacité prouvée et de sa faible toxicité.
La SBRT est généralement préconisée pour les tumeurs périphériques et son utilisation dans les tumeurs situées au centre est encore incertaine en raison d’un risque de toxicité plus élevé. Les résultats de la SBRT chez 90 patients atteints d’un CBNPC de stade I localisé au centre (50 %) et à la périphérie (56 %) ont été rapportés par une base de données combinée de 13 centres universitaires de radiothérapie allemands et autrichiens [22]. Les tumeurs périphériques avaient reçu une dose biologiquement efficace (BED10) plus élevée (72 Gy pour les tumeurs centrales contre 84 Gy pour les tumeurs périphériques). La survie globale actuarielle à 3 ans était de 29 % pour les tumeurs centrales contre 51 % pour les tumeurs périphériques (p<0,001), tandis que la liberté correspondante pour la progression locale était de 52 % et 84 % respectivement (p<0,001). Aucune différence significative dans les toxicités liées au traitement n’a été signalée. Ces résultats indiquent toutefois que les tumeurs centrales pourraient être traitées par SBRT, mais ses résultats sont peut-être limités par une dose réduite dans les tumeurs centrales.
Ainsi, la SBRT pour le cancer du poumon est une approche thérapeutique viable pour les tumeurs périphériques jusqu’à 6 cm et pourrait être considérée comme une alternative pour les patients qui sont autrement médicalement inaptes à la chirurgie [3–5]. Un BED de >100Gy, prescrit à l’isodose englobante est généralement souhaitable pour obtenir les résultats optimaux.
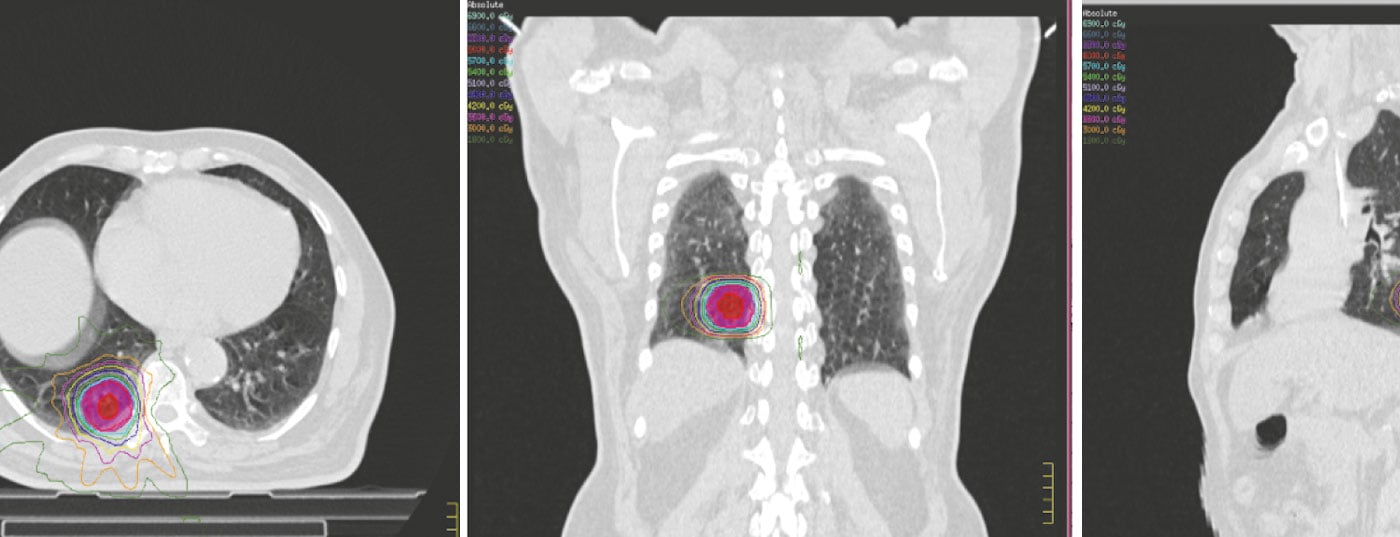
Radiothérapie isotoxique ou personnalisée
La radiothérapie isotoxique ou personnalisée implique l’administration de doses de rayonnement en fonction des contraintes des tissus normaux de chaque patient. La pratique actuelle de la radiothérapie implique des faisceaux de rayonnement de forme individuelle, adaptés aux dimensions de la tumeur de chaque patient, ce qui ouvre la voie à une planification individualisée de la radiothérapie. Cependant, le traitement individualisé pourrait également être étendu pour inclure la dose tumorale totale (TTD) la plus élevée pouvant être délivrée et tolérée chez un patient donné en respectant les contraintes des tissus normaux. Baardwijk et al. ont émis l’hypothèse que le meilleur programme d’irradiation réalisable comprendrait la DTT la plus élevée, basée sur des contraintes de dose individualisée pour les tissus normaux, délivrée dans un temps de traitement global de moins de cinq semaines [23]. Ils ont pu démontrer sa faisabilité et ont délivré une dose tumorale moyenne de 63 Gy (fourchette 46,8-79,2 Gy) chez des patients médicalement inopérables atteints de NSCLC localement avancé, avec une toxicité tissulaire aiguë et tardive acceptable. Ils ont obtenu une réponse métabolique complète chez 44% des patients avec une survie globale à 1 an de 57,1%. Plusieurs essais sont actuellement en cours dans plusieurs centres du Royaume-Uni et d’Europe.
Reymen et al. ont récemment rapporté les résultats, pour les stades T4N0-1 et la station ganglionnaire unique IIIA-N2, de la radiothérapie accélérée isotoxique individualisée (INDAR) et de la chimiothérapie dans le CBNPC [24]. 83 patients ont été traités avec une dose médiane de 65 Gy (43,5-72 Gy) dans un temps de traitement global médian de 30 jours (17-48 jours). Le traitement a consisté en 30 fractions de 1,5 Gy deux fois par jour, suivies de 2 Gy par fraction jusqu’à une TTD maximale limitée par les contraintes des tissus normaux. 52 patients ont reçu une chimiothérapie simultanée tandis que 31 ont été traités par une chimiothérapie séquentielle avec INDAR. Les survies globales pour T4N0-1 à 2 et 5 ans étaient respectivement de 55 et 25 %, tandis que les survies correspondantes pour IIIA-N2 étaient respectivement de 53 et 24 %. L’effet secondaire le plus grave observé était une œsophagite de grade 3 chez sept patients, mais ils ont tous été résolus par un traitement conservateur.
Ces résultats indiquent que la radiothérapie isotoxique avec des prescriptions de doses individualisées pourrait encore améliorer les résultats de ces tumeurs inopérables localement avancées et obtenir une survie à long terme avec une faible morbidité. Une augmentation supplémentaire de la dose grâce à l’amélioration de la planification et de l’administration de la radiothérapie, de nouveaux médicaments de chimiothérapie ou d’agents biologiquement ciblés, voire une combinaison avec la chirurgie, pourrait certainement être explorée dans les futurs essais de radiothérapie isotoxique.
Thérapie par faisceau de particules – protons et faisceaux de carbone
Le pic de Bragg caractéristique (faible dose à l’entrée du faisceau et chute rapide au moment du dépôt de la dose maximale) procure un avantage dosimétrique unique aux protons et aux faisceaux de carbone par rapport aux photons [25]. Sur le plan radiobiologique, bien que l’on pense que les photons sont presque similaires aux protons, les propriétés de transfert d’énergie linéaire élevées des ions carbone leur confèrent un avantage radiobiologique par rapport aux protons et aux photons. Ainsi, en théorie, les distributions de doses de protons et d’ions carbone pourraient être plus conformes aux volumes cibles avec des doses intégrales moindres par rapport à la radiothérapie basée sur les photons.
Un certain nombre d’études de phase I/II avec des faisceaux de particules se sont révélées sûres et efficaces dans le cancer du poumon non à petites cellules de stade 1. Une méta-analyse menée par Grutters et al. a examiné l’efficacité comparative des protons, des photons et des carbones [26]. La survie globale corrigée à 2 ans était de 53 % pour la radiothérapie conventionnelle par photons, de 70 % pour la SBRT, de 61 % pour les protons et de 74 % pour le carbone. À 5 ans, les survies globales de la radiothérapie conventionnelle (20 %) étaient significativement inférieures à celles de la SBRT (42 %), de la protonthérapie (40 %) et de la thérapie par ions carbone (42 %). Ainsi, il semble que même si les résultats obtenus avec les thérapies à particules sont meilleurs que ceux du faisceau de photons conventionnel, ils restent comparables à ceux de la SBRT. On pense que la thérapie par particules pourrait peut-être être plus bénéfique dans le CBNPC de stade III, où la survie globale à 2 ans tombe à seulement 26-36 % avec la chimioradiothérapie conventionnelle [26].
Un rapport récent de Chang et al. a mis en évidence la capacité de la protonthérapie à modulation d’intensité (IMPT) à être réalisable avec la gestion du mouvement respiratoire basée sur le CT 4D pour le NSCLC. Dans une étude pilote portant sur 34 patients consécutifs, il a été constaté que l’IMPT avec gating respiratoire produisait une réduction significative de tous les paramètres dosimétriques considérés par rapport à l’IMRT standard [27].
Avec la multiplication des installations de protonthérapie, l’introduction de la protonthérapie à modulation d’intensité (IMPT) et le guidage par image volumique embarquée, on pourrait s’attendre à une amélioration des résultats de la protonthérapie, bien que cela doive être confirmé par des essais randomisés avec la SBRT.
Conclusions
Le NSCLC continue d’imposer aux oncologues traitants le défi d’intégrer les meilleures options possibles d’une combinaison de chirurgie, radiothérapie et chimiothérapie. Même avec les derniers développements de chacune de ces modalités, le contrôle local et la survie globale continuent de préoccuper les oncologues traitants.
Les développements technologiques actuels en radiothérapie, ainsi que la compréhension des implications radiobiologiques des différents schémas de fractionnement des doses, ont certainement permis une administration plus sûre et plus précise de la radiothérapie. Cela a ouvert les différentes options comme la SBRT, la radiothérapie isotoxique, le faisceau de particules, etc. comme une alternative possible pour un groupe de patients sélectionnés. Cependant, l’intégration avec d’autres modalités comme les agents de chimiothérapie et les thérapies moléculaires ciblées nouvellement développées doit faire l’objet de recherches plus approfondies basées à la fois sur des preuves et sur la médecine personnalisée pour produire les résultats souhaités.
Prof. Dr. med. Niloy Ranjan Datta
Dr. med. Silvia Gómez Ordóñez
Prof. Dr. med. Stephan Bodis
Literatur :
- Ferlay J, et al : GLOBOCAN 2012 v1.0, Incidence et mortalité par cancer dans le monde : Base Cancer du CIRC n° 11 [Internet]. Lyon, France : Centre international de recherche sur le cancer ; 2013. Disponible à l’adresse : http://globocan.iarc.fr.
- Bordoni A, et al : Tendances de la survie au cancer du poumon en Suisse. Schweizer Krebsbulletin 2012 ; 3. Disponible à l’adresse : www.nicer.org/assets/files/skb_3-2012_nicer_lung_cancer_survival_in_ch.pdf.
- Vansteenkiste J, et al : Annl Oncol 2013 ; 24(suppl 6) : vi89-vi98.
- Directives de pratique clinique du NCCN en oncologie : Cancer du poumon non à petites cellules, version 4. 2014. Disponible à l’adresse : www.nccn.org/professionals/physician_gls/pdf/nscl.pdf.
- Société allemande de radio-oncologie (DEGRO) : Lignes directrices pour la radiothérapie stéréotaxique extracrânienne. Disponible à l’adresse : www.degro.org/dav/html/download/pdf/ESRT_Leitlinie.pdf.
- Commission internationale des unités et mesures de rayonnement : Prescribing, Recording and Reporting Photon Beam Therapy (Supplement to ICRU Report 50), ICRU Report 62, Bethesda, MD, 1999.
- Commission internationale des unités et mesures de radiations : Prescribing, Recording and Reporting Photon Beam Intensity Modulated Radiation Therapy, ICRU Report 83, Bethesda, MD, 2010.
- Chi A, Nguyen NP : Front Oncol 2014 Oct 7 ; 4 : 273.
- van Baardwijk A, et al : Eur J Cancer 2012 ; 48 : 2339-2346.
- Fleckenstein J, et al : Int J Radiat Oncol Biol Phys 2011 ; 81 : e282-289.
- Bradley JD, et al : Int J Radiat Oncol Biol Phys 2010 ; 77 : 367-372.
- Schild SE, et al : Int J Radiat Oncol Biol Phys 2006 ; 65 : 1106-1111.
- Sociniski MA, et al : J Clin Oncol 2008 ; 26 : 2457-2463.
- Bradley J, et al : J Clin Oncol 2013 ; 31(15) : 7501.
- Belani CP, et al : J Clin Oncol 2005 ; 23 : 3760-3767.
- Hatton M, et al : Int J Radiat Oncol Biol Phys 2011 ; 81 : 712-718.
- Saunders M, et al : Lancet 1977 ; 350 : 161-165.
- Bogart JA, et al : J Clin Oncol 2010 ; 28 : 202-206.
- Ruysscher DD, et al : J Clin Oncol 2010 ; 28 : 5301-5310.
- Soldà F, et al : Radiother Oncol 2013 ; 109 : 1-7.
- Zheng X, et al : Int J Radiat Oncol Biol Phys 2014 ; 90 : 603-611.
- Schanne DH, et al : Strahlenther Onkol 2014, doi : 10.1007/s00066-014-0739-5.
- van Baardwijk A, et al : Int J Radiat Oncol Biol Phys 2008 ; 71 : 1394-1401.
- Reymen B, et al : Radiother Oncol 2014 ; 110 : 482-487.
- Grant JD, Chang JY : Biomed Res Int 2014 : 389048. doi : 10.1155/2014/389048.
- Grutters JPC, et al : Radiother Oncol 2010 ; 95 : 32-40.
- Chang JY, et al : Int J Radiat Oncol Biol Phys 2014 ; 90 : 809-818.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(1) : 6-12