La fibrillation auriculaire est un trouble du rythme dynamique qui nécessite des examens et des approches thérapeutiques individuels et étendus. Le traitement complet des patients atteints de fibrillation auriculaire repose sur cinq piliers : 1. prévention des événements thromboemboliques ; 2. contrôle des symptômes ; 3. si possible, rétablir ou maintenir le rythme sinusal ; 4. Sinon, bon contrôle des fréquences ; 5. traitement de la cardiopathie sous-jacente et des facteurs prédisposants.
La fibrillation auriculaire touche 1 à 2 % de la population totale, ce qui en fait le trouble du rythme cardiaque le plus fréquent [1–3]. En raison de l’augmentation de la prévalence des facteurs de risque et des maladies cardiovasculaires et de l’augmentation de l’âge moyen de la population générale, nous sommes confrontés à un nombre croissant de patients atteints de fibrillation auriculaire dans notre pratique clinique quotidienne [1–3]. Le traitement global représente un défi. Outre la préservation de la qualité de vie, il convient de limiter le risque thromboembolique ainsi que le risque de morbidité et de mortalité généralement accru avec la fibrillation auriculaire [1,2]. Les découvertes de la recherche épidémiologique et clinique, l’apparition de nouveaux anticoagulants oraux (“non-vitamin K antagonist oral anticoagulants” (NOAC)) et les progrès de l’électrophysiologie interventionnelle ont révolutionné le traitement de la fibrillation auriculaire. Cet article vise à donner un aperçu des principaux concepts et des derniers paradigmes en matière de traitement de la fibrillation auriculaire.
Évaluations initiales et stratification des risques
En plus d’un bilan clinique et de laboratoire, les patients présentant une fibrillation auriculaire nouvellement détectée par électrocardiographie doivent également être évalués par échocardiographie et, le cas échéant, par ECG de longue durée [1,2]. L’anamnèse et les résultats recueillis constituent la base de la classification du type de fibrillation auriculaire (paroxystique, persistante, persistante de longue durée [>1 an], ou permanente), de la graduation des symptômes et de l’évaluation du risque thromboembolique et hémorragique. La procédure d’évaluation et de traitement primaire est sommairement résumée dans la figure 1. Il convient de noter que le score CHA2DS2-VASc a de fait remplacé le score CHADS2 pour évaluer le risque d’AVC [4].

Prophylaxie thromboembolique de la fibrillation auriculaire
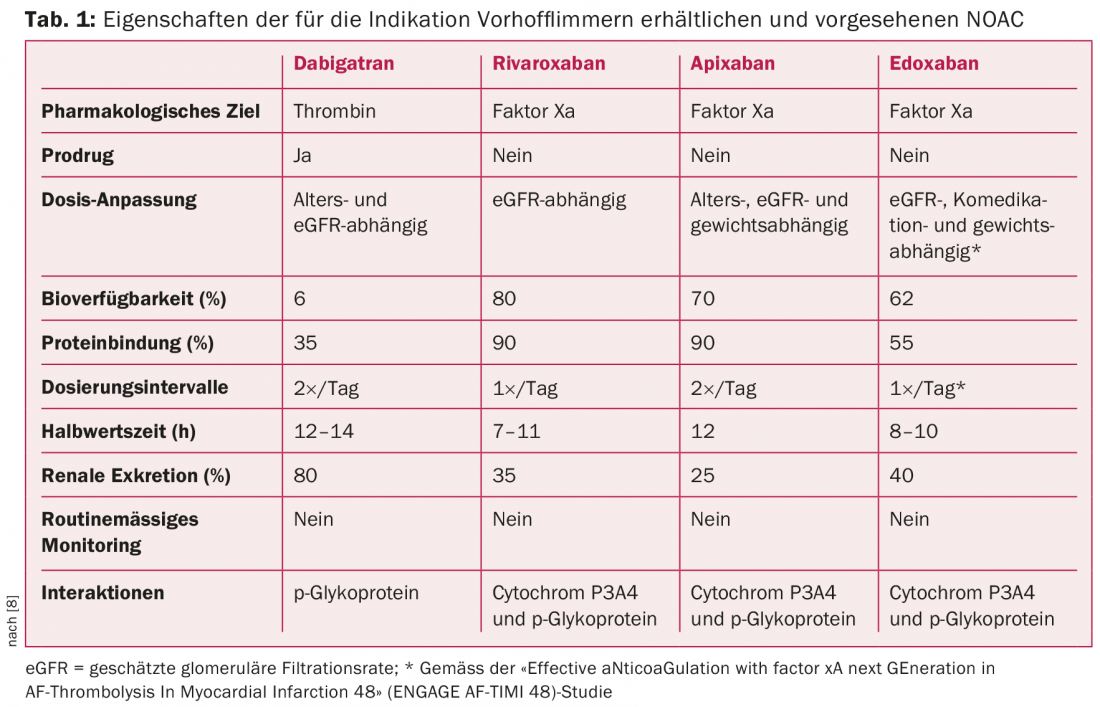
Parallèlement à l’introduction du score CHA2DS2-VASc, on a assisté il y a quelques années à un changement de paradigme dans le domaine de l’anticoagulation pour la fibrillation auriculaire [1,2,4]. Cette réorientation a été largement influencée par l’émergence de NOAC [4,5]. Jusqu’à présent, trois NOAC – l’apixaban, le dabigatran et le rivaroxaban (par ordre alphabétique) – se sont imposés dans la routine clinique pour la prophylaxie des événements thromboemboliques [4–7]. Un quatrième produit, l’edoxaban, est sur le point d’être mis sur le marché (n.d.r. : désormais autorisé) (tableau 1) [7]. Les NOAC ont révolutionné et simplifié le traitement anticoagulant.
De plus, le rôle des antiagrégants plaquettaires dans la prévention des AVC en cas de fibrillation auriculaire a été redéfini [1,2]. Il est aujourd’hui généralement déconseillé de prescrire de l’aspirine aux patients atteints de fibrillation auriculaire pour la prévention des AVC, car cela ne garantit pas une prophylaxie thromboembolique suffisante et augmente malgré tout de manière significative le risque d’hémorragie [1,4].
De très grandes études randomisées ont montré que les NOAC sont équivalents, voire supérieurs aux antagonistes de la vitamine K (AVK) chez les patients atteints de fibrillation auriculaire [1,5–8]. En particulier, la supériorité en termes de risque d’hémorragie intracrânienne constitue une caractéristique importante de la NOAC [1,5–8]. De manière générale, il convient de noter qu’avant d’initier un traitement anticoagulant, le risque d’interaction, de saignement et de complications générales doit être évalué, en tenant compte, le cas échéant, de scores de risque (par exemple, le score HAS-BLED). Compte tenu de la diffusion croissante des NOAC, il convient de garder à l’esprit qu’une réduction de la fonction rénale peut également entraîner une accumulation d’anticoagulants. L’ampleur de l’accumulation est corrélée à la sévérité du dysfonctionnement rénal et dépend également de la substance utilisée. (Tab. 1). Il faut également se préparer à des interactions médicamenteuses potentielles et savoir que, comme les AVK, le métabolisme des NOAC peut être influencé de manière significative par la co-médication et la fonction hépatique. (Tab.1) [4,5].
Il arrive que l’on soit confronté à des patients souffrant de fibrillation auriculaire et présentant un risque thromboembolique élevé, mais qui, en raison des risques d’hémorragie ou de saignement, ne peuvent pas être traités. -Les patients qui ne sont pas éligibles à l’anticoagulation en raison de complications de la maladie sont confrontés à des problèmes de santé. On sait maintenant que l’oreillette gauche est une source centrale de formation de thrombus dans la fibrillation auriculaire [9,10]. Pour les patients bien sélectionnés qui ne peuvent pas bénéficier d’un traitement anticoagulant en raison de contre-indications, une alternative est apparue ces dernières années avec l’introduction de systèmes d’occlusion de l’oreille antérieure, afin de réduire le risque d’AVC ou d’hémorragie. limiter le risque de saignement [1,2,9,10]. Plusieurs études ont déjà montré que ces systèmes de fermeture de l’oreillette peuvent constituer une option thérapeutique efficace [9,10].
Contrôle du rythme – Options médicamenteuses
Outre la prophylaxie thromboembolique, le deuxième élément central chez les patients atteints de fibrillation auriculaire est le traitement du trouble du rythme en soi. La stratégie de traitement doit être adaptée aux circonstances individuelles et s’oriente donc en fonction des symptômes du patient, de la durée de l’épisode de fibrillation auriculaire et de la situation clinique globale.
Les stratégies possibles de contrôle du rythme chez les patients atteints de fibrillation auriculaire paroxystique ou persistante sont présentées dans la figure 2. Les patients symptomatiques ainsi que les patients présentant une limitation de la fonction cardiaque sous fibrillation auriculaire (par exemple en cas de tachycardiomyopathie) bénéficient souvent d’un traitement de contrôle du rythme [2,3,11]. En fonction des symptômes et de la durée de l’épisode de fibrillation auriculaire, il est possible, après avoir déterminé la nécessité d’un traitement anticoagulant ou d’un traitement par voie intraveineuse, de prescrire un traitement par voie intraveineuse. après avoir exclu un thrombus intracardiaque, une cardioversion médicamenteuse ou électrique doit être envisagée. En règle générale, si la fibrillation auriculaire a duré plus de 48 heures ou plus, un traitement anticoagulant doit être instauré pendant au moins trois semaines avant la cardioversion, puis poursuivi pendant au moins quatre semaines, et ensuite indéfiniment en fonction du score CHA2DS2-VASc [1,2].
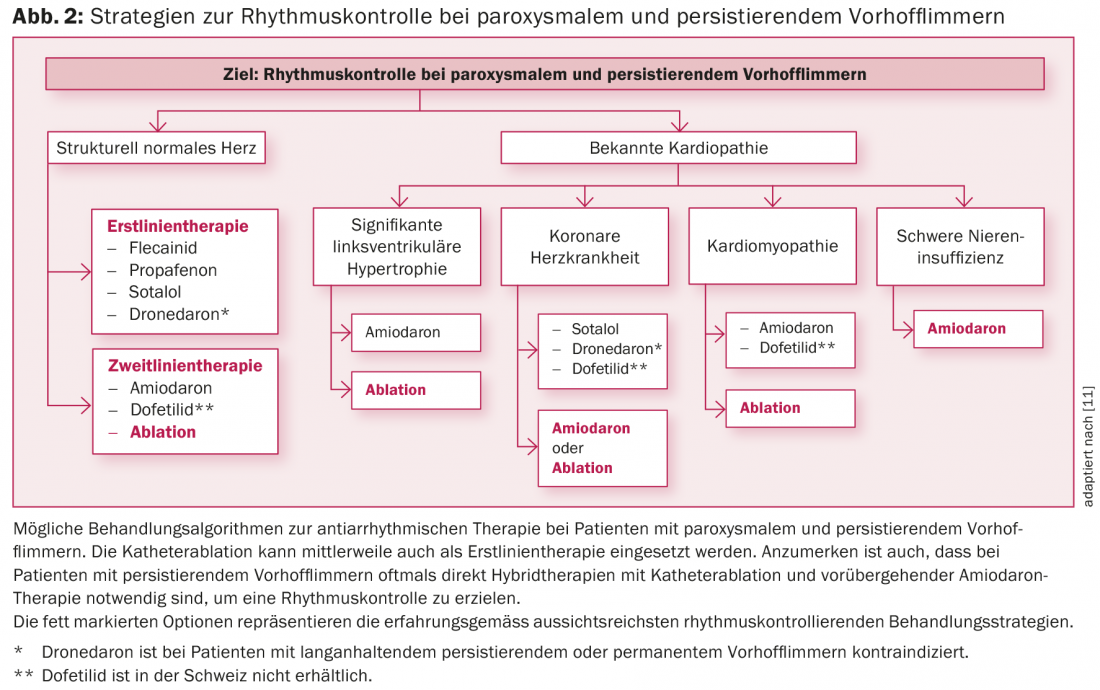
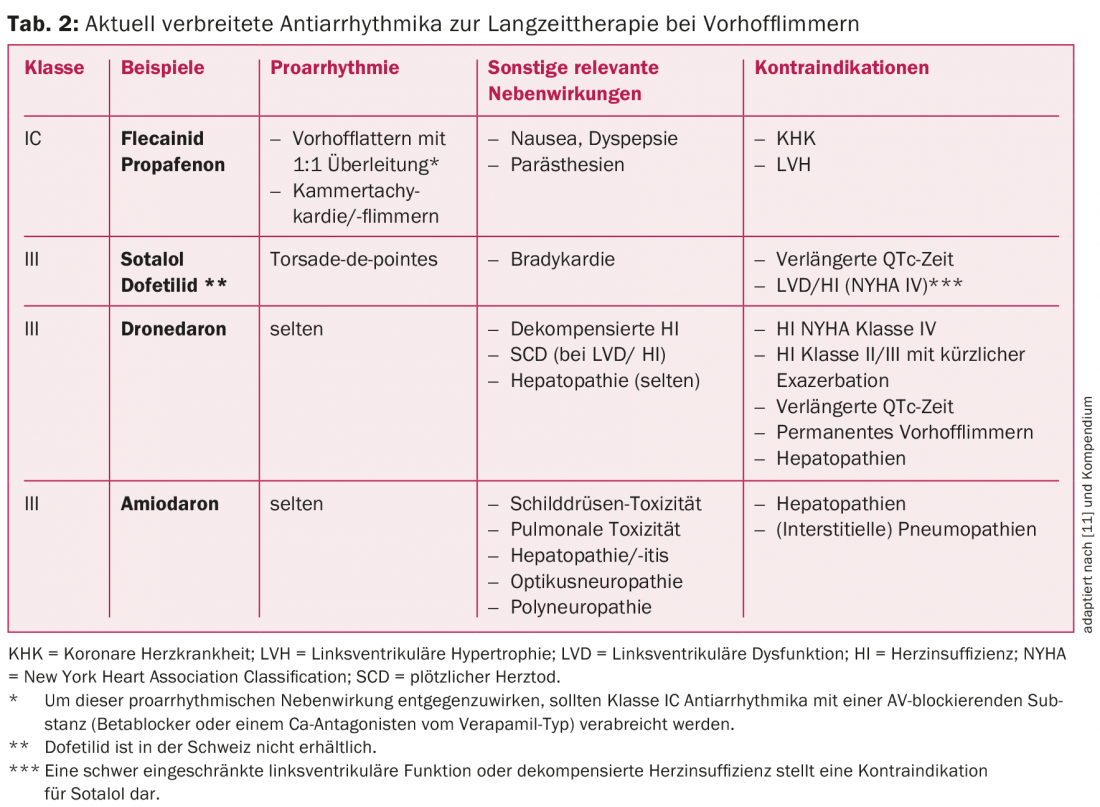
Les antiarythmiques les plus courants actuellement pour le contrôle du rythme à long terme ainsi que leurs indications dans la fibrillation auriculaire sont présentés dans le tableau 2 et la figure 2. Chez les patients sans cardiopathie structurelle, les antiarythmiques de classe IC (par ex. la flécaïnide ou la propafénone) associés à un β-bloqueur cardiosélectif constituent le premier choix [1]. L’amiodarone et le dofétilide (ce dernier n’est pas disponible en Suisse) sont les agents thérapeutiques de choix, en particulier chez les patients présentant une cardiopathie structurelle ou une fonction de pompe réduite (Fig. 2) [1,3]. L’amiodarone est l’antiarythmique le plus puissant disponible et doit, si possible, être administré de manière limitée dans le temps en raison de son profil d’effets secondaires et d’interactions important [2,3,11]. Les nouveaux antiarythmiques, tels que le vernakalant (disponible uniquement par voie intraveineuse) et la dronédarone, n’ont pas encore réussi à s’imposer durablement en raison de leur efficacité limitée et des résultats défavorables des études. La dronédarone, en particulier, ne devrait être utilisée qu’avec modération au vu des résultats des études PALLAS et ANDROMEDA [2,3,11]. Ainsi, la dronédarone n’est pas recommandée chez les patients souffrant d’une fibrillation auriculaire permanente ou d’un infarctus du myocarde. insuffisance cardiaque, voire même contre-indiqué [2,3,11]. Cependant, comme les antiarythmiques de classe IC et III établis n’ont également qu’un effet limité et que la fibrillation auriculaire est une maladie dynamique, le maintien du rythme par des médicaments à long terme est souvent peu efficace [2,3,11].
Contrôle du rythme – Options électrophysiologiques
La compréhension physiopathologique croissante de l’origine de la fibrillation auriculaire permet de définir en permanence de nouvelles cibles thérapeutiques. Depuis les premières interventions chirurgicales du rythme (procédures MAZE) visant à préserver le rythme sinusal, les choses ont beaucoup évolué dans le domaine du traitement interventionnel de la fibrillation auriculaire. Ainsi, on vise aujourd’hui à isoler électriquement les veines pulmonaires des patients souffrant de fibrillation auriculaire paroxystique et persistante au moyen d’une procédure d’ablation par cathéter et de la pose de lignes de sclérose, car les foyers électriquement actifs qui s’y trouvent sont considérés comme des déclencheurs importants du trouble du rythme (fig. 3) [1,2,11].
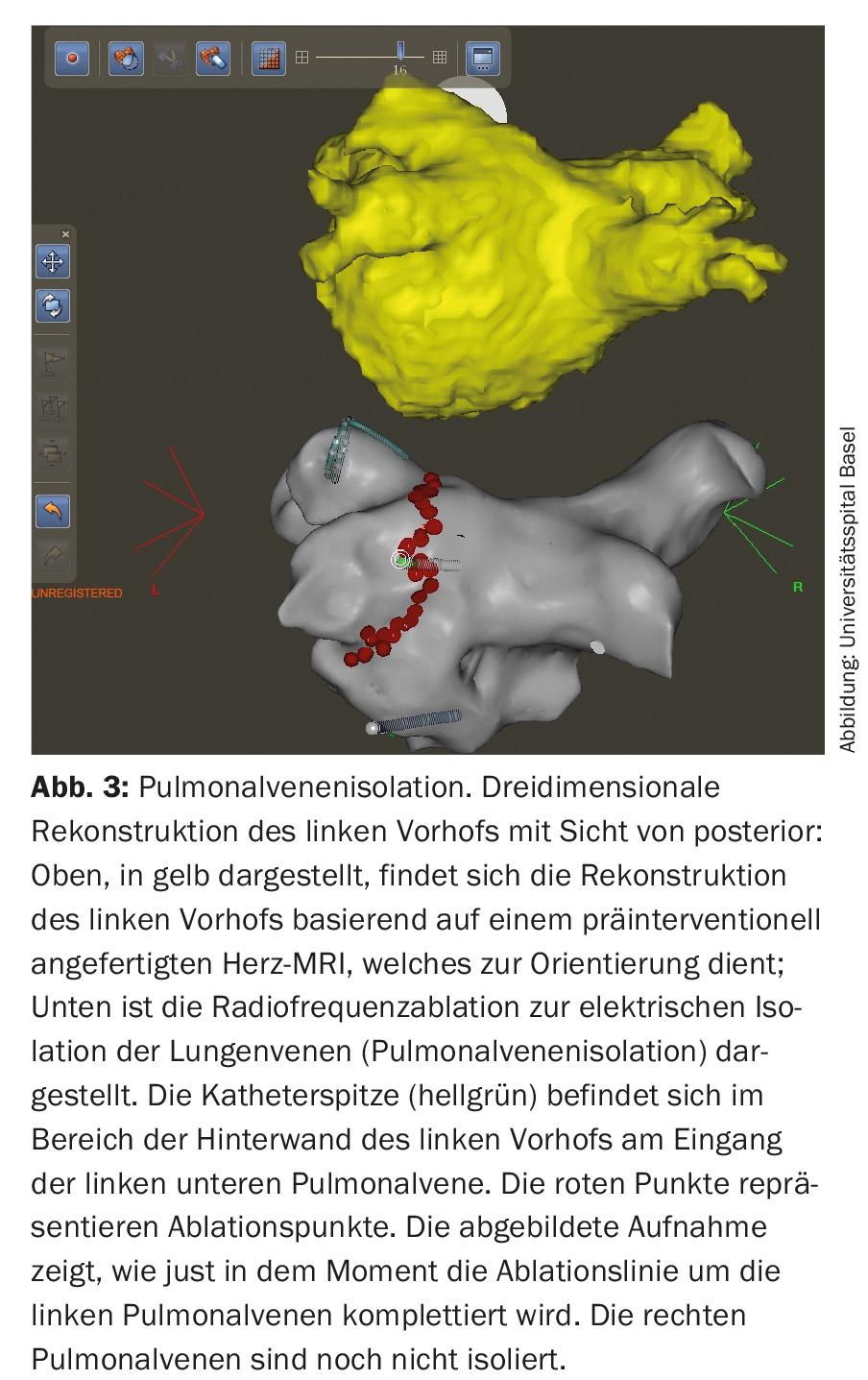
L’isolation des veines pulmonaires est réalisée par radiofréquence ou cryoablation et est devenue une intervention cardiologique de routine. Le risque de complications est désormais très faible dans les centres où le nombre d’interventions est élevé. Outre les complications au niveau du site de ponction inguinale (environ 2%), une tamponnade péricardique nécessitant un drainage peut survenir dans de rares cas (<1%). L’AIT ou l’AVC sont également rares (<1%), et la complication la plus redoutée, la fistule atrio-œsophagienne, est très rare (0,01-0,2%) [2,10,11]. De plus en plus, le traitement par ablation représente le traitement primaire pour de nombreux patients symptomatiques atteints de fibrillation auriculaire [1–3,11]. Néanmoins, l’indication d’un traitement interventionnel ne doit être posée qu’après une évaluation minutieuse des risques et des bénéfices. En général, les facteurs suivants doivent être évalués en plus des préférences du patient : le type et la durée de la fibrillation auriculaire, la taille des oreillettes et les cardiopathies sous-jacentes [1,2,11].
Les taux de réussite de l’ablation de la fibrillation auriculaire se sont considérablement améliorés au cours des dernières années. Une méta-analyse publiée récemment montre que l’ablation par cathéter permet à 77% des patients de ne plus présenter de fibrillation auriculaire symptomatique au bout d’un an, contre 52% pour le traitement par antiarythmiques [2]. L’expérience montre toutefois qu’environ un quart à un tiers de tous les patients ont besoin d’une deuxième intervention (appelée “redo ablation”) pour obtenir un contrôle durable des symptômes [3,11].
Contrôle de fréquence
Chez les patients asymptomatiques, mais aussi et surtout chez les patients âgés et polymorbides souffrant de fibrillation auriculaire, le contrôle de la fréquence cardiaque est souvent au premier plan. Cette approche s’appuie sur les données de plusieurs études randomisées (par ex. les études AFFIRM et RACE) qui n’ont pas pu montrer de bénéfice apparent en termes de mortalité d’un traitement rythmique par rapport à un traitement à fréquence contrôlée dans les populations de patients concernées [2,3,11]. Si la fibrillation auriculaire est acceptable, car le patient est asymptomatique, seule la fréquence ventriculaire est contrôlée par un bêtabloquant ou un antagoniste du calcium [2,3,11]. La digoxine est encore utilisée, par exemple, lorsqu’un contrôle de la fréquence est nécessaire dans le cadre d’une insuffisance cardiaque décompensée, mais les auteurs ne l’utilisent globalement plus que dans des cas très sélectionnés. L’étude TREAT-AF récemment publiée, une analyse rétrospective de plus de 120 000 patients, va dans le même sens en montrant que la digoxine est associée à une augmentation de la mortalité en cas de fibrillation auriculaire [12].
Si les médicaments ne permettent pas d’obtenir un contrôle suffisant de la fréquence, il convient d’envisager un contrôle interventionnel de la fréquence [2]. Dans ce cas, une section du nœud AV est également réalisée par ablation par cathéter, ce qui entraîne un contrôle de la fréquence ventriculaire, mais aussi une dépendance au stimulateur cardiaque [2]. Cette option thérapeutique connaît un regain d’intérêt car elle présente un taux de réussite élevé (>99%) et a pour effet secondaire positif pour le patient de permettre également l’arrêt des médicaments ralentisseurs de fréquence (et de leurs effets secondaires).
Traitement des facteurs de risque et des facteurs associés
De nombreuses études ont démontré que le traitement optimal des facteurs de risque cardiovasculaires classiques (hypertension artérielle, diabète, dyslipidémie et tabagisme) ainsi que des maladies associées fréquentes, telles que l’obésité, le syndrome d’apnée obstructive du sommeil et l’insuffisance rénale, a une influence positive sur l’incidence et l’évolution de la fibrillation auriculaire [2,3,11,13].
Dans un travail récemment publié, il a été démontré de manière impressionnante qu’une perte de poids rigoureuse associée à un traitement optimal des facteurs de risque cardiométaboliques permettait de réduire la fibrillation auriculaire symptomatique et d’influencer positivement le remodelage cardiaque [13]. Le terme de “thérapie en amont” est actuellement à la mode dans le contexte du traitement global de la fibrillation auriculaire [2,3,11]. Celle-ci comprend le traitement médicamenteux de facteurs tels que l’inflammation et la fibrose, qui favorisent la fibrillation auriculaire. À cet égard, plusieurs études ont montré que les inhibiteurs de l’ECA/antagonistes de l’AAT-2 et les statines, en particulier, pourraient avoir un effet positif à long terme et contrecarrer l’évolution de la fibrillation auriculaire.
Conflits d’intérêts
- Matthias Bossard n’a aucun conflit d’intérêt en rapport avec cet article.
- Stefan Osswald : Frais de conseil/lecture : Boehringer-Ingelheim
- Michael Kühne : Honoraires de conseil/lecture : Boehringer-Ingelheim, Bayer, Daiichi-Sankyo
Littérature :
- Camm AJ, et al. : 2012 focused update of the ESC Guidelines for the management of atrial fibrillation : an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Développé avec la contribution spéciale de l’Association Européenne du Rythme Cardiaque. Eur Heart J 2012 Nov ; 33(21) : 2719-2747.
- European Heart Rhythm A, European Association for Cardio-Thoracic S, Camm AJ, et al. : Guidelines for the management of atrial fibrillation : the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010 Oct ; 31(19) : 2369-2429.
- Trulock KM, Narayan SM, Piccini JP : Rhythm control in heart failure patients with atrial fibrillation : contemporary challenges including the role of ablation. J Am Coll Cardiol 2014 Aug 19 ; 64(7) : 710-721.
- Lip GY : Stroke and bleeding risk assessment in atrial fibrillation : when, how, and why ? Eur Heart J 2013 avril ; 34(14) : 1041-1049.
- Heidbuchel H, et al : EHRA practical guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation : executive summary. Eur Heart J 2013 juillet ; 34(27) : 2094-2106.
- Granger CB, et al : Apixaban versus warfarine chez les patients atteints de fibrillation auriculaire. N Engl J Med 2011 Sep 15 ; 365(11) : 981-992.
- Giugliano RP, et al : Edoxaban versus warfarine chez les patients atteints de fibrillation auriculaire. N Engl J Med 2013 Nov 28 ; 369(22) : 2093-2104.
- Hart RG, et al : Anticoagulants chez les patients atteints de fibrillation auriculaire et de maladie rénale chronique. Nat Rev Nephrol 2012 Oct ; 8(10) : 569-578.
- Reddy VY, et al : Fermeture percutanée de l’appendice auriculaire gauche vs warfarine pour fibrillation auriculaire : un essai clinique randomisé. JAMA 2014 Nov 19 ; 312(19) : 1988-1998.
- John Camm A, et al : Fermeture de l’appendice auriculaire gauche : une nouvelle technique pour la pratique clinique. Heart Rhythm 2014 Mar ; 11(3) : 514-521.
- Woods CE, Olgin J : Atrial fibrillation therapy now and in the future : drugs, biologicals, and ablation. Circ Res 2014 Apr 25 ; 114(9) : 1532-1546.
- Turakhia MP, et al : Increased mortality associated with digoxin in contemporary patients with atrial fibrillation : findings from the TREAT-AF study. J Am Coll Cardiol 2014 Aug 19 ; 64(7) : 660-668.
- Abed HS, et al : Effect of weight reduction and cardiometabolic risk factor management on symptom burden and severity in patients with atrial fibrillation : a randomized clinical trial. JAMA 2013 Nov 20 ; 310(19) : 2050-2060.
CARDIOVASC 2015











