Le traitement du cancer colorectal s’est considérablement amélioré. Les patients bénéficient aujourd’hui d’approches thérapeutiques multimodales, même à des stades avancés et en présence de métastases. La gestion doit être interdisciplinaire.
Le cancer colorectal (CCR) est le deuxième cancer le plus fréquemment diagnostiqué en Europe. La résection de la tumeur est indispensable si l’intention est curative. Au cours des 20 dernières années, le traitement du cancer colorectal s’est considérablement amélioré. Les patients bénéficient aujourd’hui, même à des stades avancés et en présence de métastases, de l’utilisation stratégique d’un traitement multimodal [1].
Interdisciplinarité et tumorboard dans la CRC
Les disciplines de l’oncologie, de la chirurgie, de la gastro-entérologie, de la radio-oncologie et de la génétique médicale sont étroitement liées dans le diagnostic et le traitement du cancer colorectal. Tous les patients atteints d’un cancer du côlon ou du rectum doivent être présentés à un tumorboard interdisciplinaire dès que le diagnostic est posé, en particulier les patients présentant des métastases ou des récidives. Il a été démontré que la présentation d’un tumorboard augmente significativement le nombre de patients auxquels on propose une ablation et une chirurgie des métastases [2].
Staging du KRK
Les examens obligatoires pour la décision de traitement des cancers du côlon et du rectum sont le toucher rectal digital et la coloscopie complète avec biopsie. En cas de sténose non franchissable, il convient de compléter la coloscopie trois à six mois après l’opération, ou, si elle est disponible, de réaliser une coloscopie virtuelle ou un lavement baryté. L’antigène carcinoembryonnaire (ACE) en tant que marqueur tumoral et la tomodensitométrie du thorax font partie du staging complet. Selon les lignes directrices S3, une échographie du foie est suffisante pour exclure la présence de métastases hépatiques [3], alors que les lignes directrices européennes de l’ESMO recommandent un scanner ou une IRM avec contraste [1]. Dans le cas du cancer du rectum, un staging local plus précis et une rectoscopie rigide pour indiquer la hauteur du bord inférieur de la tumeur devraient être effectués en plus pour déterminer le traitement néoadjuvant éventuellement nécessaire. La relation avec le sphincter et la détermination des stades T et N peuvent être obtenues aussi bien par endosonographie rectale (ERUS) que par IRM pelvienne – mais l’indication de la distance de la tumeur au fascia mésorectal, importante sur le plan thérapeutique et pronostique, ne peut être obtenue que par IRM pelvienne. Si un cancer du rectum s’étend jusqu’à 1 mm ou moins du fascia mésorectal, le risque de récidive locale est nettement plus élevé [4].
Le PET-CT ne joue actuellement aucun rôle dans le diagnostic de routine de l’IRC. La place du PET-CT dans la maladie métastatique (stade IV) est controversée. Une étude randomisée a montré que le PET-CT permettait de réduire le nombre de tentatives de résection superflues [5], mais d’autres études n’ont pas montré de différence en termes d’événements pertinents pour le patient avec ou sans PET-CT [6]. Il est considéré comme certain qu’un PET-CT n’a pas de valeur diagnostique dans les quatre semaines suivant l’administration d’une chimiothérapie ou d’un traitement par anticorps [7]. Le staging des ganglions lymphatiques par imagerie reste peu fiable, tant pour le cancer du côlon que pour le cancer du rectum, et, dans le cas du cancer du rectum, la combinaison de l’ERUS, du scanner et de l’IRM n’a pas changé grand-chose, comme le montrent de récentes méta-analyses. Le staging des ganglions lymphatiques doit en fin de compte être laissé à la pathologie. La proximité du cancer du rectum avec le fascia mésorectal, appelée “marge de résection circonférentielle” (CRM), et la présence d’une “invasion vasculaire extramurale” (EMVI) sont plus importantes que le statut ganglionnaire pour la décision de traitement néoadjuvant, mais aussi pour le pronostic du cancer du rectum.
Le staging peropératoire consiste à explorer la cavité abdominale et à réséquer la tumeur en respectant des distances suffisantes entre les marges de résection. L’excision du ganglion sentinelle (“sentinel node biopsy”) ne joue aucun rôle dans le traitement du cancer colorectal. Il est important de procéder à une résection radicale du pédicule vasculaire nourricier avec la zone de drainage lymphatique correspondante.
Selon les lignes directrices S3, la recherche de microsatellites est facultative en cas de cancer non métastatique, mais recommandée en cas de suspicion de HNPCC ou de carcinome colique peu différencié. Étant donné que les critères d’Amsterdam ou de Bethesda (Tab. 1) sont trop peu sensibles en raison de la taille actuelle des familles, les directives européennes de l’ESMO recommandent, pour exclure un cancer du côlon familial dans le cadre d’un cancer du côlon héréditaire (HNPCC ou syndrome de Lynch), le dépistage systématique d’une éventuelle instabilité des microsatellites chez tous les patients de moins de 70 ans. ans et chez les patients de plus de 70 ans années avec des critères Bethesda positifs. De nombreux centres certifiés de lutte contre le cancer colorectal se conforment aujourd’hui aux directives ESMO plus strictes. Dans le cas du CCR métastatique, le statut mutationnel RAS et B-RAF ainsi que l’instabilité des microsatellites doivent être testés en raison de leur pertinence pronostique et thérapeutique. D’autres biomarqueurs, tels que les cellules tumorales circulantes, la biopsie liquide et l’analyse du whole-genome/exome/transcriptome, font l’objet de discussions, mais n’ont pas encore de conséquences pratiques dans la pratique quotidienne [1].

Des données récentes indiquent que les tumeurs coliques droites et gauches sont des tumeurs pathogénétiquement différentes (mot-clé “sidedness”). Les tumeurs du côlon gauche répondent probablement mieux au traitement anti-EGFR (cetuximab) que les tumeurs du côlon droit et les tumeurs du côlon gauche présentent des marqueurs pathogéniques différents de ceux des cancers du rectum [8].
Traitement néoadjuvant et adjuvant pour les KRK des stades 1 à 3
Pour le cancer du côlon résécable sans métastases, un traitement néoadjuvant n’est pas indiqué. L’indication d’un traitement néoadjuvant du cancer du rectum est posée en fonction de la localisation (rectum proximal, moyen ou distal), en fonction du stade T et du stade N. Le traitement néoadjuvant peut être administré par voie orale ou par injection. Quelle que soit la localisation en hauteur, un CRM ≤1 mm ou une EMVI + est toujours une indication de traitement néoadjuvant.
Une irradiation consiste soit en une irradiation à court terme de 5× 5 Gy suivie d’une chirurgie immédiate (schéma à court terme), soit en une radiochimiothérapie fractionnée conventionnelle (1,8-2,0 Gy à 45-50,4 Gy) avec un intervalle de six à dix semaines avant la chirurgie (schéma à long terme).
Le traitement adjuvant est indiqué dans le cancer du côlon en cas d’envahissement des ganglions lymphatiques (stade 3) ou dans des situations à risque sélectionnées au stade 2 (T4, perforation tumorale, opération en urgence, nombre de ganglions lymphatiques examinés <12) et consiste le plus souvent, chez les patients de moins de 70 ans, en des protocoles contenant de l’oxaliplatine. Étant donné que dans les études randomisées, une chimiothérapie adjuvante réussie a généralement été initiée dans les six semaines, le traitement adjuvant après chirurgie doit être initié si possible dans les six semaines ou moins. se faire dès que possible. L’indication de la (radio)chimiothérapie postopératoire pour le cancer du rectum est basée sur T, N, CRM et Mercury (exhaustivité de l’excision mésorectale dans le staging pathologique) [4].
Résection radicale du côlon
Le traitement chirurgical du cancer du côlon consiste en une résection radicale incluant le drainage lymphatique. Le nombre minimum de ganglions lymphatiques dans la préparation est de 12. Les organes adhérents à la tumeur doivent être également enlevés par résection en bloc multiviscérale. Pour les tumeurs du cæcum et du côlon ascendant, une hémicolectomie droite est pratiquée. Cela implique une ablation centrale de l’artère iléocolique et donc une résection de 5 à 10 cm d’iléon distal, l’ablation des branches droites de l’artère colique moyenne, du grand épiploon droit et, si une artère colique dextre est présente (seulement 15% des patients), une ablation centrale de celle-ci. En cas d’hémicolectomie élargie à droite, l’artère colique moyenne est également ligaturée au centre et les ganglions lymphatiques de l’artère gastroépiploïque dextre, de la grande courbure gastrique et au-dessus de la tête du pancréas sont réséqués.
En cas de tumeur transversale, les deux fléchisseurs coliques sont également réséqués, l’artère colique moyenne est décollée au centre, l’épiploon est réséqué et une lymphadénectomie de la grande courbure gastrique est pratiquée.
Pour les tumeurs de la fléchisseuse colique gauche, l’artère colique moyenne et l’artère colique sinistre sont détachées à leurs sorties, l’épiploon gauche est réséqué à proximité de l’estomac.
Pour les tumeurs du côlon descendant, une section centrale de l’artère mésentérique inférieure et une dépose du côlon gauche dans le tiers supérieur du rectum sont effectuées.
En cas de carcinome sigmoïde, il est également obligatoire de procéder à une ablation centrale de l’artère mésentérique inférieure et à une section du côlon dans le tiers supérieur du rectum, avec une distance aborale minimale de 5 cm par rapport à la tumeur. Une excision mésocolique complète (CME) avec respect des fascias embryonnaires, analogue à l’excision mésorectale totale (TME) dans le cas du cancer du rectum, est certes conceptuellement évidente dans le sens d’une radicalité locale maximale et d’un rendement ganglionnaire élevé, mais n’est pas encore clairement assurée en termes de pronostic.
Résection radicale du rectum
L’excision totale du mésorectum (TME) ou l’excision partielle du mésorectum (PME) pour les cancers du tiers supérieur du rectum est fondamentale dans le traitement chirurgical du cancer du rectum. Étant donné que des métastases ganglionnaires peuvent apparaître jusqu’à 5 cm de la tumeur, le mésorectum est sectionné horizontalement au moins à 5 cm de la tumeur en cas de cancer du rectum proximal, et une excision mésorectale totale est nécessaire en conséquence en cas de cancer plus profond. Les organes adhérents à la tumeur doivent être enlevés par résection en bloc multiviscérale. Les nerfs pelviens autonomes doivent être préservés en respectant le bon niveau d’exérèse. En ce qui concerne les marges de résection aborale, une marge de sécurité au niveau de la paroi intestinale de 1 à 2 cm in situ peut être acceptée pour les tumeurs “low-grade” (G1-2) du tiers inférieur du rectum, tandis qu’une marge de sécurité plus importante est souhaitable pour les tumeurs “high-grade”. Après une radiochimiothérapie néoadjuvante, une marge de résection libre aborale de 0,5 cm peut être acceptée, mais elle doit être confirmée par un examen peropératoire rapide. La décision de conserver le sphincter dans les cancers rectaux profonds après radiochimiothérapie néoadjuvante peut être prise au plus tôt six semaines après la fin de la radiochimiothérapie.
Pour les cancers du rectum T1 sans facteurs de risque (G1/2, L0, V0), une excision transanale, le plus souvent endoscopique, de la paroi complète du rectum peut être réalisée. Pour les tumeurs T2 ainsi que les tumeurs avec suspicion de métastases ganglionnaires, l’excision totale de la paroi n’est pas adéquate.
Extirpation du rectum
Lorsque les stratégies de conservation du sphincter ne permettent pas d’obtenir des marges de résection sans tumeur, l’excision cylindrique de l’anorectum, ou exérèse rectale, reste le gold standard.
Reconstruction après résection antérieure profonde
Les reconstructions après résection rectale profonde sont l’anastomose de bout en bout, la coloplastie transversale, l’anastomose de côté à bout et le J-pouch du côlon. Les résultats fonctionnels à deux ans de toutes les procédures sont identiques. Cependant, les résultats à court terme de ces deux dernières procédures sont supérieurs à ceux de l’anastomose de bout en bout – de sorte qu’en raison de la simplicité technique de l’anastomose de bout en bout, cette procédure de reconstruction est la plus utilisée.
Pose d’une stomie en cas de KRK
En cas d’excision d’un cancer du rectum avec ETM et anastomose profonde, une stomie de déviation temporaire doit être mise en place, en particulier après une radiochimiothérapie néoadjuvante, une iléostomie étant généralement préférée. Si la stomie de déviation ne réduit pas le taux d’insuffisance anastomotique, elle en diminue la morbidité et la mortalité. La prévention initiale des stomies dans la chirurgie rectale n’entraîne pas une diminution du taux global de stomies. Les conseils préopératoires des stomathérapeutes et le marquage de l’emplacement de la stomie en position couchée, assise et debout simplifient les soins postopératoires pour ce groupe de patients.
Stratégie “Watch and Wait” pour le cancer du rectum
La stratégie dite “Watch and Wait” en cas de réponse complète après traitement néoadjuvant est le premier exemple de traitement curatif non chirurgical du cancer du rectum. L’équipe de Habr-Gama au Brésil a montré que 27% des 265 patients n’avaient plus de tumeur détectable par endoscopie et radiologie après une radiochimiothérapie néoadjuvante pour des cancers du rectum de stade 2-3. Ces patients ont été désignés “stade 0” et suivis avec une stratégie de suivi appelée “Watch and Wait” avec un taux de récidive de seulement 7,4% pour un suivi médian de 58 mois [9]. Bien que le concept visant à préserver les organes ne se soit pas encore imposé, il fait l’objet de nombreuses discussions internationales, est suivi avec intérêt et est désormais étudié par d’autres groupes [10].
Laparoscopie dans le cadre de l’IRC
La résection laparoscopique des cancers du côlon et du rectum est aujourd’hui considérée comme équivalente à la résection ouverte, à condition que les patients soient correctement sélectionnés. Des méta-analyses montrent une morbidité postopératoire moindre dans les 30 ou 90 premiers jours par rapport à la chirurgie ouverte. En ce qui concerne le résultat oncologique, il n’y a pas de différence entre les méthodes (essai CLASICC, essai COLOR, etc.) [11]. L’excision mésorectale totale transanale (taTME) consiste en une ablation laparoscopique combinée des cancers du rectum par voie transanale et transabdominale. La voie d’abord transanale présente des avantages décisifs, en particulier dans le cas d’un bassin masculin étroit et/ou obèse. L’opération peut alors être réalisée en tant qu'”opération à une équipe” ou en tant qu'”opération à deux équipes”, c’est-à-dire par deux équipes chirurgicales simultanément (fig. 1). Les premières méta-analyses montrent une équivalence oncologique avec la résection antérieure profonde du rectum par laparoscopie [12] et les premiers documents de consensus soutiennent une mise en œuvre prudente [13].
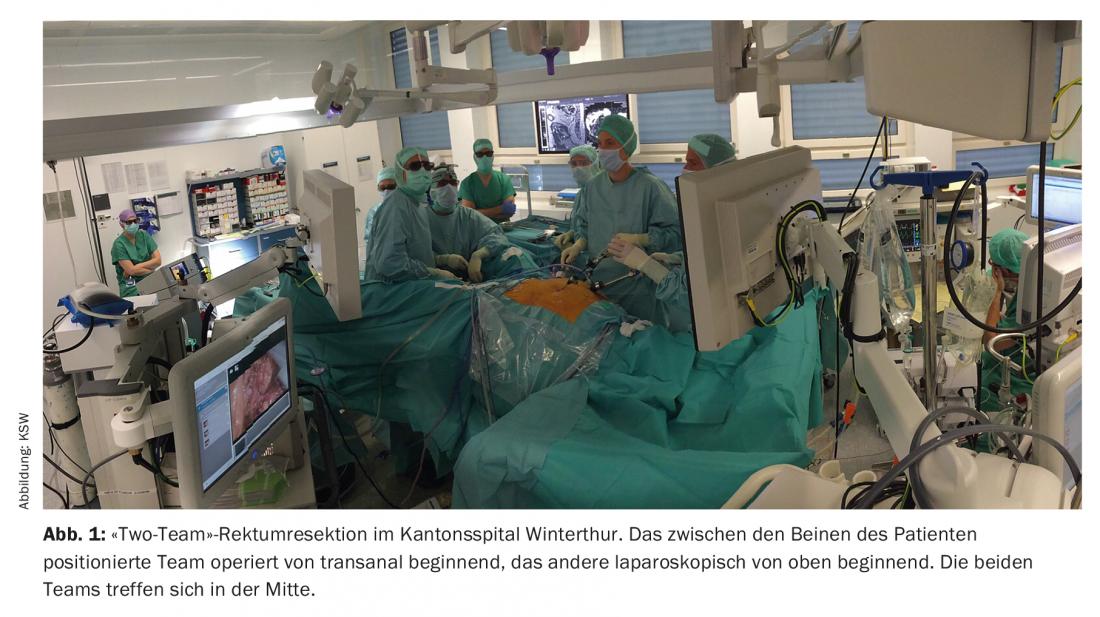
Gestion postopératoire, ERAS et préhabilitation
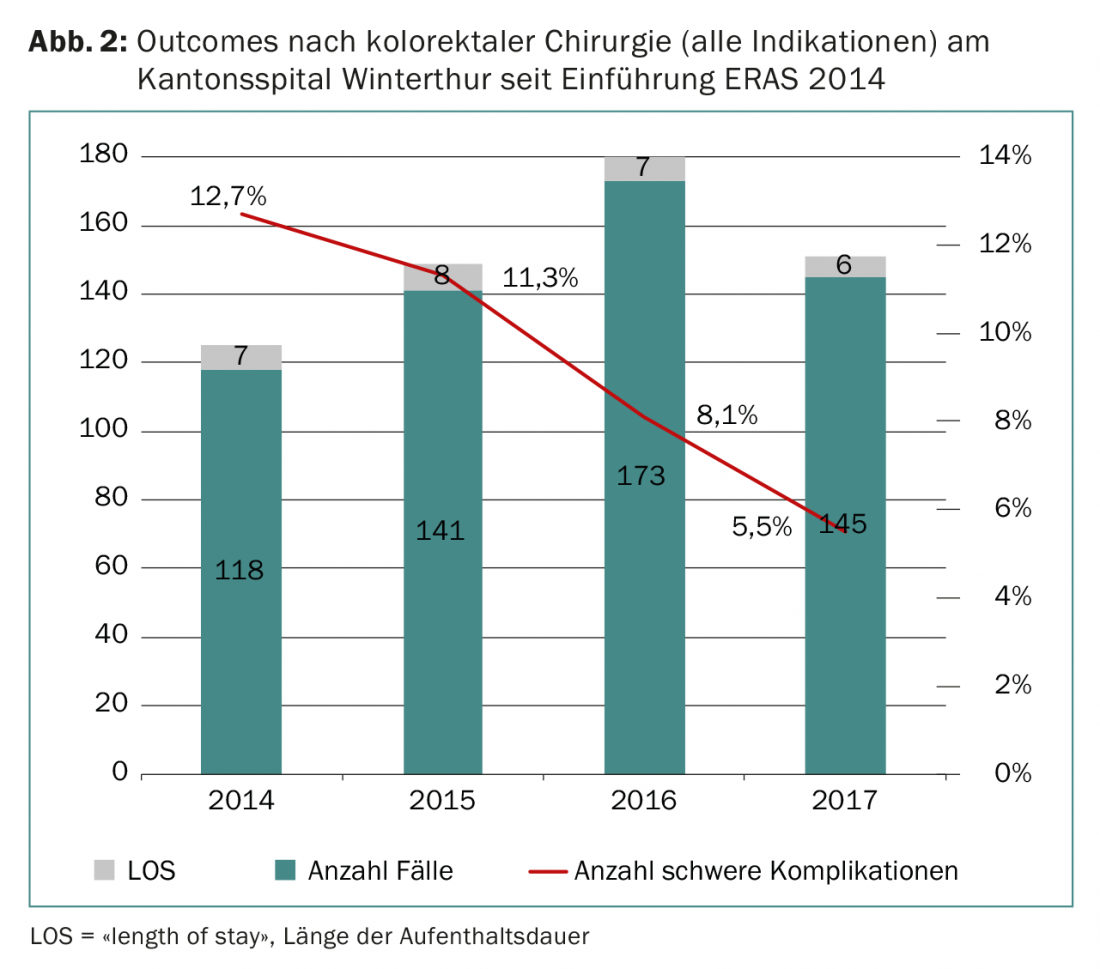
ERAS signifie “enhanced recovery after surgery” et désigne un parcours de soins postopératoires composé de faisceaux de pratiques dont l’efficacité a été démontrée par des preuves scientifiques. L’ERAS-Society a été fondée en 2001 en Scandinavie. L’adhésion des centres individuels implique un contrôle de qualité actif via une base de données. L’ERAS permet de réduire de manière significative la durée de séjour postopératoire des patients ainsi que le taux de complications postopératoires (Fig. 2) [14]. Dans la continuité du principe ERAS, l’équipe colorectale de Winterthur mène une étude randomisée sur l’effet de la préhabilitation sur la morbidité postopératoire chez les patients ayant subi une résection du côlon et du rectum [15].
La chirurgie de la carcinose péritonéale du CCR
Il y a quelques années encore, les patients atteints de carcinose péritonéale étaient considérés comme incurables. Désormais, en cas de carcinose péritonéale limitée, une chirurgie cytoréductrice combinée à une chimiothérapie intrapéritonéale hyperthermique (HIPEC) peut être réalisée si le “peritoneal cancer index” (PCI) est inférieur à 20, s’il n’y a pas de métastases extra-abdominales et si l’ablation de toutes les manifestations tumorales macroscopiques est possible. Souvent, le facteur limitant pour une résection complète est l’atteinte du mésentère de l’intestin grêle. Les données relatives au traitement cytoréducteur et à la HIPEC sont de plus en plus nombreuses. Elle est désormais bien établie dans de nombreux centres disposant d’une expertise en la matière. Il est essentiel de sélectionner soigneusement les patients [16].
Chirurgie d’urgence et CRC
Les indications classiques d’intervention d’urgence en cas de CCR sous-jacent sont l’hémorragie, l’obstruction tumorale et la perforation tumorale. Une résection radicale doit toujours être recherchée. Les saignements peuvent être stoppés dans la majorité des cas par des interventions endoscopiques. L’obstruction tumorale peut être corrigée dans des cas sélectionnés par la pose d’un stent endoscopique (concept de “bridge to surgery”). En cas de cancer obstructif du rectum, une stomie de déviation est dans la plupart des cas nécessaire en raison de la taille de la tumeur, afin de pouvoir effectuer le traitement néoadjuvant souhaité pour ces tumeurs avancées.
Métastases hépatiques et pulmonaires
Les métastases hépatiques isolées qui ne nécessitent pas de résection hépatique majeure (c’est-à-dire plus de trois segments, appelés hépatectomie majeure) peuvent être retirées simultanément à la résection colique. Toutefois, cela doit être évité chez les patients présentant des comorbidités et âgés (>70 ans). Pour les métastases uniques inférieures à 3 cm, une procédure ablative par radiofréquence ou par micro-ondes est probablement équivalente à la résection sur le plan oncologique.
Chez les patients présentant des métastases multiples ou nécessitant une résection dite majeure, il convient de pratiquer une résection en deux temps.
La plupart des patients atteints de métastases hépatiques synchrones ont un statut ganglionnaire positif et reçoivent donc de toute façon une chimiothérapie adjuvante. La chimiothérapie adjuvante pour les métastases hépatiques reste controversée. Une étude randomisée a montré que la chimiothérapie périopératoire par six cycles de FOLFOX en cas de statut ganglionnaire mixte entraînait une réduction des récidives, mais ne prolongeait pas la survie [17].
Les patients présentant des métastases hépatiques bilobaires initialement non résécables (foie métastatique) et une tumeur primaire asymptomatique devraient se voir proposer un traitement dit de conversion par FOLFOX ou FOLFIRI (“doublet”) et des anticorps (bevacizumab ou cetuximab ou panitumumab), voire un traitement “triplet” (FOLFOXIRI) avec des anticorps. Après réduction de la masse tumorale, une résécabilité secondaire peut être obtenue. La supériorité du cétuximab sur le bévacizumab dans les tumeurs KRAS de type sauvage est bien établie [18]. De même, les tumeurs mutées BRAF avec la mutation V600 répondent probablement mieux à une combinaison de FOLFIRI avec le cetuximab et les inhibiteurs de BRAF.
Pour les patients chez qui, après une conversion réussie, il n’y a toujours pas assez de tissu hépatique résiduel pour une résection complète, il existe des méthodes de chirurgie hépatique régénérative. Parmi celles-ci figurent la résection hépatique en deux temps avec embolisation ou ligature de la veine porte dans l’intervalle, ainsi que des méthodes plus récentes telles que l’ALPPS (“associating liver partition and portal vein ligation for staged hepatectomy”) ou la double embolisation simultanée de la veine porte et de la veine hépatique.
Plus de 50% des résections hépatiques pour métastases devraient actuellement être réalisables par laparoscopie dans des centres expérimentés.
Les métastases pulmonaires ont généralement peu d’influence sur la survie globale, mais devraient également être enlevées chirurgicalement si leur localisation est favorable.
Résumé
La gestion du cancer colorectal nécessite une étroite collaboration interdisciplinaire. Les approches thérapeutiques multimodales permettent également une approche thérapeutique curative pour les stades avancés et métastatiques.
Messages Take-Home
- La résection radicale par ablation proximale des axes vasculaires des segments coliques correspondants est le principe chirurgical de base de la chirurgie colique.
- La distance de la tumeur par rapport à la “circumferential resection margin” (CRM) (<1 mm) et l'”extramural vascular invasion” (EMVI) (“yes”) sont les deux éléments les plus importants dans la décision d’une radiochimiothérapie néoadjuvante pour le cancer du rectum.
- Les résultats périopératoires de la chirurgie colorectale ont été améliorés de manière significative au cours des deux dernières décennies grâce à la chirurgie laparoscopique et aux parcours de soins périopératoires tels que l’ERAS.
- L’innovation technique la plus excitante de la chirurgie colorectale de ces dernières années est l’excision mésorectale totale transanale.
- Le traitement de conversion et la chirurgie régénérative du foie permettent aujourd’hui d’obtenir jusqu’à 30 % de survie à 5 ans, même en cas de métastases hépatiques extensives.
Littérature :
- Van Cutsem E, et al : ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Annals of oncology : official journal of the European Society for Medical Oncology/ESMO 2016 ; 27 : 1386-1422.
- Segelman J, et al : Differences in multidisciplinary team assessment and treatment between patients with stage IV colon and rectal cancer. Colorectal disease : the official journal of the Association of Coloproctology of Great Britain and Ireland 2009 ; 11 : 768-774.
- AWMF : Lignes directrices S3 sur le cancer colorectal. Situation en 2017.
- Glynne-Jones R, et al : Rectal cancer : ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of oncology : official journal of the European Society for Medical Oncology/ESMO 2017 ; 28 : iv22-iv40.
- Ruers TJ, et al : Amélioration de la sélection des patients pour la chirurgie hépatique des métastases du foie colorectal avec (18)F-FDG PET : une étude randomisée. Journal of nuclear medicine : publication officielle, Society of Nuclear Medicine 2009 ; 50 : 1036-1041.
- Serrano PE, et al : Positron Emission Tomography-Computed Tomography (PET-CT) Versus No PET-CT in the Management of Potentially Resectable Colorectal Cancer Liver Metastases : Cost Implications of a Randomized Controlled Trial. J Oncol Pract 2016 ; 12 : e765-774.
- Glazer ES, et al : Efficacité de la tomographie par émission de positons pour prédire la réponse à la chimiothérapie dans les métastases hépatiques du cancer colorectal. Archives of surgery 2010 ; 145 : 340-345 ; discussion 5.
- Arnold D, et al : Valeur pronostique et prédictive du côté primaire de la tumeur chez les patients atteints de cancer colorectal métastatique de type sauvage RAS traités par chimiothérapie et anticorps dirigés contre l’EGFR dans six essais randomisés. Annals of oncology : official journal of the European Society for Medical Oncology/ESMO 2017 ; 28 : 1713-1729.
- Habr-Gama A, et al : Traitement chirurgical versus traitement non chirurgical pour le cancer rectal distal de stade 0 après chimioradiothérapie : résultats à long terme. Annals of surgery 2004 ; 240 : 711-717 ; discussion 7-8.
- Kong JC, et al : Résultat et chirurgie de sauvetage après “Watch and Wait” pour le cancer du rectum après un traitement néoadjuvant : A Systematic Review. Diseases of the colon and rectum 2017 ; 60 : 335-345.
- Guillou PJ, et al : Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer (MRC CLASICC trial) : multicentre, randomised controlled trial. Lancet 2005 ; 365 : 1718-1726.
- Ma B, et al : Excision mésorectale totale transanale (taTME) pour le cancer du rectum : une revue systématique et une méta-analyse des résultats oncologiques et périopératoires par rapport à l’excision mésorectale totale laparoscopique. BMC cancer 2016 ; 16 : 380.
- Adamina M, et al : St.Gallen consensus on safe implementation of transanal total mesorectal excision. Surgical endoscopy 2018 ; 32 : 1091-1103.
- Greco M, et al : Enhanced recovery program in colorectal surgery : a meta-analysis of randomized controlled trials. World journal of surgery 2014 ; 38 : 1531-1541.
- Merki-Kunzli C, et al : Assessing the Value of Prehabilitation in Patients Undergoing Colorectal Surgery According to the Enhanced Recovery After Surgery (ERAS) Pathway for the Improvement of Postoperative Outcomes : Protocol for a Randomized Controlled Trial. JMIR research protocols 2017 ; 6 : e199.
- Sugarbaker PH : Improving oncologic outcomes for colorectal cancer at high risk for local-regional recurrence with novel surgical techniques. Expert review of gastroenterology & hepatology 2016 ; 10 : 205-213.
- Nordlinger B, et al : Chimiothérapie périopératoire FOLFOX4 et chirurgie versus chirurgie seule pour les métastases hépatiques résécables du cancer colorectal (EORTC 40983) : résultats à long terme d’un essai randomisé, contrôlé, de phase 3. The lancet oncology 2013 ; 14 : 1208-1215.
- Van Cutsem E, et al : Cetuximab et chimiothérapie comme traitement initial du cancer colorectal métastatique. The New England journal of medicine 2009 ; 360 : 1408-1417.
InFo ONKOLOGIE & HÉMATOLOGIE 2018 ; 6(3) : 7-12











